Unter einer Oxidation kann verschiedene chemische Vorgänge verstehen. Im Chemie-Anfangsunterricht, beispielsweise in der 7. Klasse, verbrennt man Metalle wie Magnesium und Kupfer und bestaunt dann die Oxidationsprodukte, die ganz anders aussehen als die Metalle. Hier lernt man dann, dass die Aufnahme von Sauerstoff als Oxidation bezeichnet wird:
Oxidation= Aufnahme von Sauerstoff
Im Chemie- und im Biologie-Unterricht wird dann in den oberen Klassen der Sek. I ein neuer Oxidationsbegriff eingeführt:
Oxidation= Abgabe von Wasserstoff
Wenn zum Beispiel ein primärer Alkohol zu einem Aldehyd reagiert, indem er zwei Wasserstoff-Atome abgibt, so bezeichnet man dies als eine Oxidation:
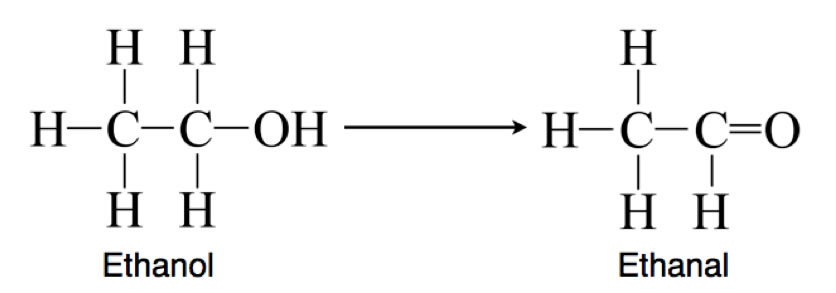
Ein dritter Oxidations-Begriff wird meistens in der 8. oder 9. Klasse eingeführt, wenn man sich mit Elektrochemie beschäftigt. Eine Reaktion wie
$Cu^{2+}_{(aq)} + Fe_{(s)} \to Fe^{2+}_{(aq)} + Cu_{(s)}$
kann man nicht mehr mit der Aufnahme von Sauerstoff oder der Abgabe von Wasserstoff erklären, dennoch handelt es sich um eine Redoxreaktion, bei der Kupfer-Ionen reduziert und das Eisen oxidiert wird. Hier lernen die Schüler dann folgende Definition:
Oxidation= Abgabe von Elektronen
Ein weiteres bekanntes Beispiel ist die Bildung von Natriumchlorid aus Natrium und Chlor.
Bei dieser Reaktion gibt das Natrium Elektronen ab, es wird also oxidiert. Das Chlor nimmt die Elektronen vom Natrium auf und wird daher reduziert (siehe Reduktion).
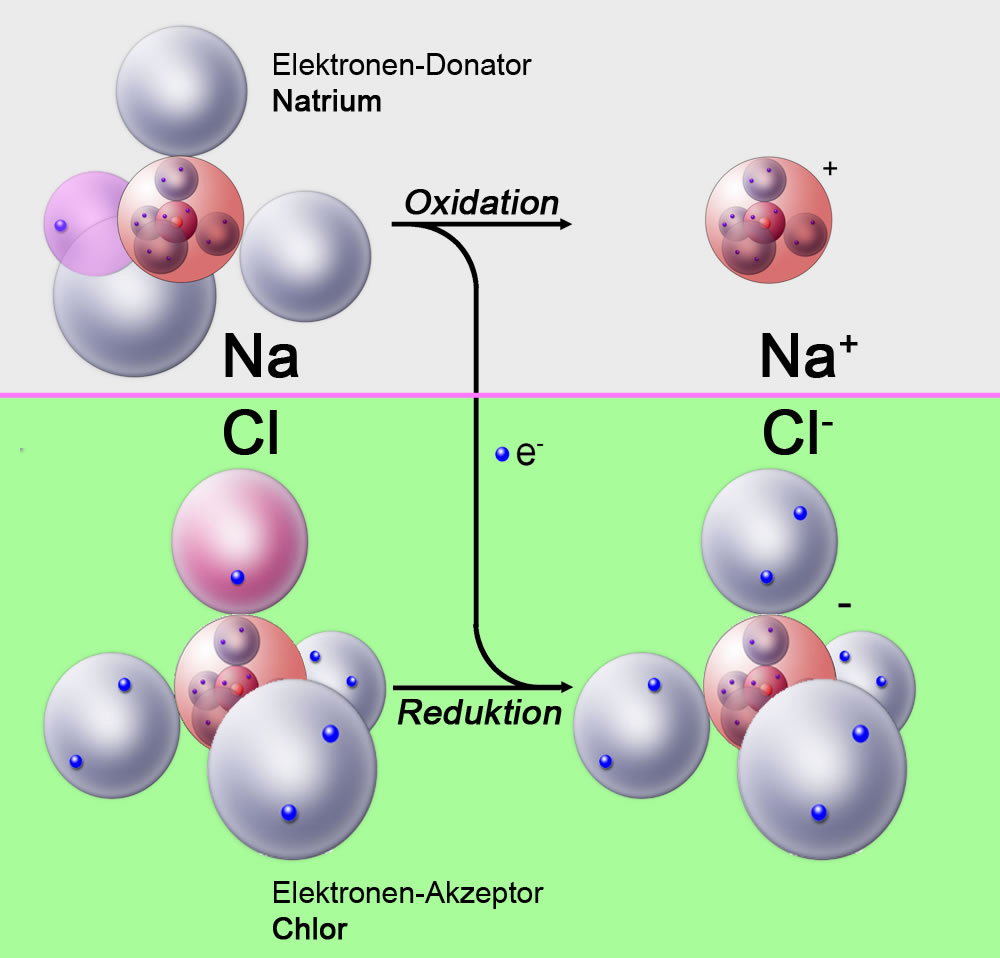
Elektronenübertragung vom Natrium zum Chlor
Autor: Ulrich Helmich 2014, Lizenz: Public domain
Ein weiteres bekanntes Beispiel aus dem Chemieunterricht ist die Oxidationsreihe der Alkane, zum Beispiel die folgende:
Ethan → Ethanol → Ethanal → Ethansäure
Bei jedem dieser Schritte gibt das erste C-Atom formal zwei Elektronen ab, was man an der Oxidationszahl erkennen kann, die um je zwei Einheiten zunimmt.
Hier die Oxidationsreihe vom Propan-1-ol über Propanal zur Propansäure:
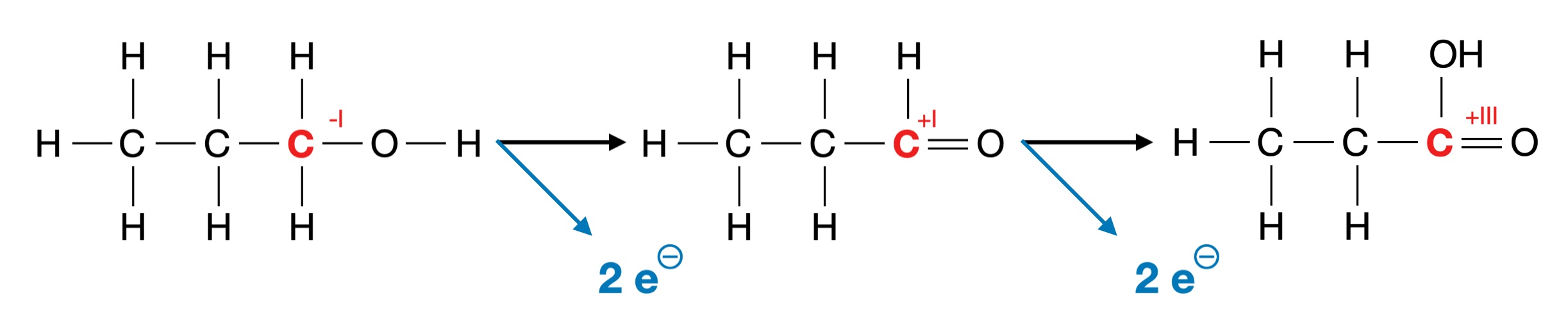
Oxidationsreihe eines primären Alkohols
Autor: Ulrich Helmich 12/2024, Lizenz: Public domain