Einfache Erklärung Sek. II
Wasserstoffbrücken-Bindungen gehören zu den drei Typen der schwachen chemischen Bindung.
Zur Erinnerung: Unter starken chemischen Bindungen versteht man die Ionenbindung, die kovalente Bindung und die metallische Bindung.
Die zwei Typen der schwachen chemischen Bindung sind die drei Komponenten der van-der-Waals-Wechselwirkung sowie die Wasserstoffbrücken-Bindung (H-Brücken). Die H-Brücken sind wesentlich stärker als die Keesom-, Debye- oder London-Wechselwirkung, die als van-der-Waals-Wechselwirkung zusammengefasst werden.
Um zu verstehen, was eine solche Wasserstoffbrücken-Bindung eigentlich ist, schauen wir uns folgendes Bild an:
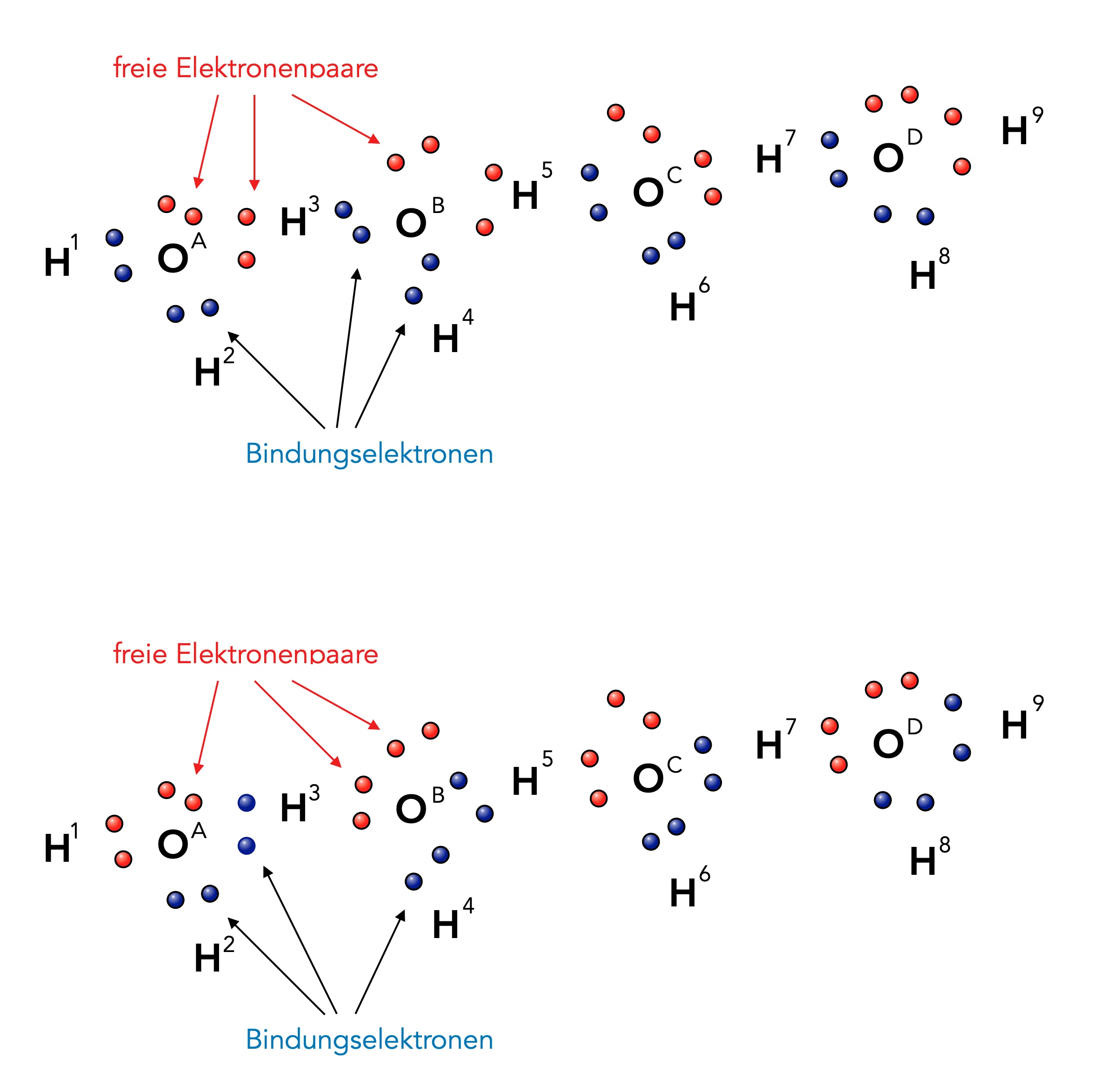
Zwei Wasser-Moleküle sind durch eine Wasserstoffbrücke miteinander verbunden
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Wir sehen hier vier H2O-Moleküle nebeneinander. Die Kugelwolken bzw. Orbitale sind bewusst nicht mit eingezeichnet worden, sondern nur die Bindungselektronen (blau) und die freien Elektronenpaare der O-Atome (rot).
Vergleichen wir nun die obere Reihe mit der unteren Reihe. Die Position der H- und O-Atome hat sich hier um keinen Deut geändert. Aber aus freien Elektronenpaaren sind plötzlich Bindungselektronen geworden, und umgekehrt sind aus Bindungselektronen jetzt freie Elektronenpaare entstanden. Das H-Atom H3 war beispielsweise vorher mit dem O-Atom OB verbunden, im unteren Bild ist H3 aber mit OA verknüpft.
Im Linder, einem sehr guten Biologie-Lehrbuch für die Oberstufe, wird das folgendermaßen erklärt: "Aufgrund der positiven Teilladung können die Wasserstoffatome eines Wassermoleküls mit einem freien Elektronenpaar eines benachbarten Wassermoleküls in Wechselwirkung treten. So entsteht eine Wasserstoffbrückenbindung".
Ausführlichere Erklärung Studium
Für die meisten Zwecke reicht die obige einfache Erklärung völlig aus. In diesem Abschnitt wollen wir uns aber mal ein wenig eingehender mit den Wasserstoffbrücken-Bindungen beschäftigen.
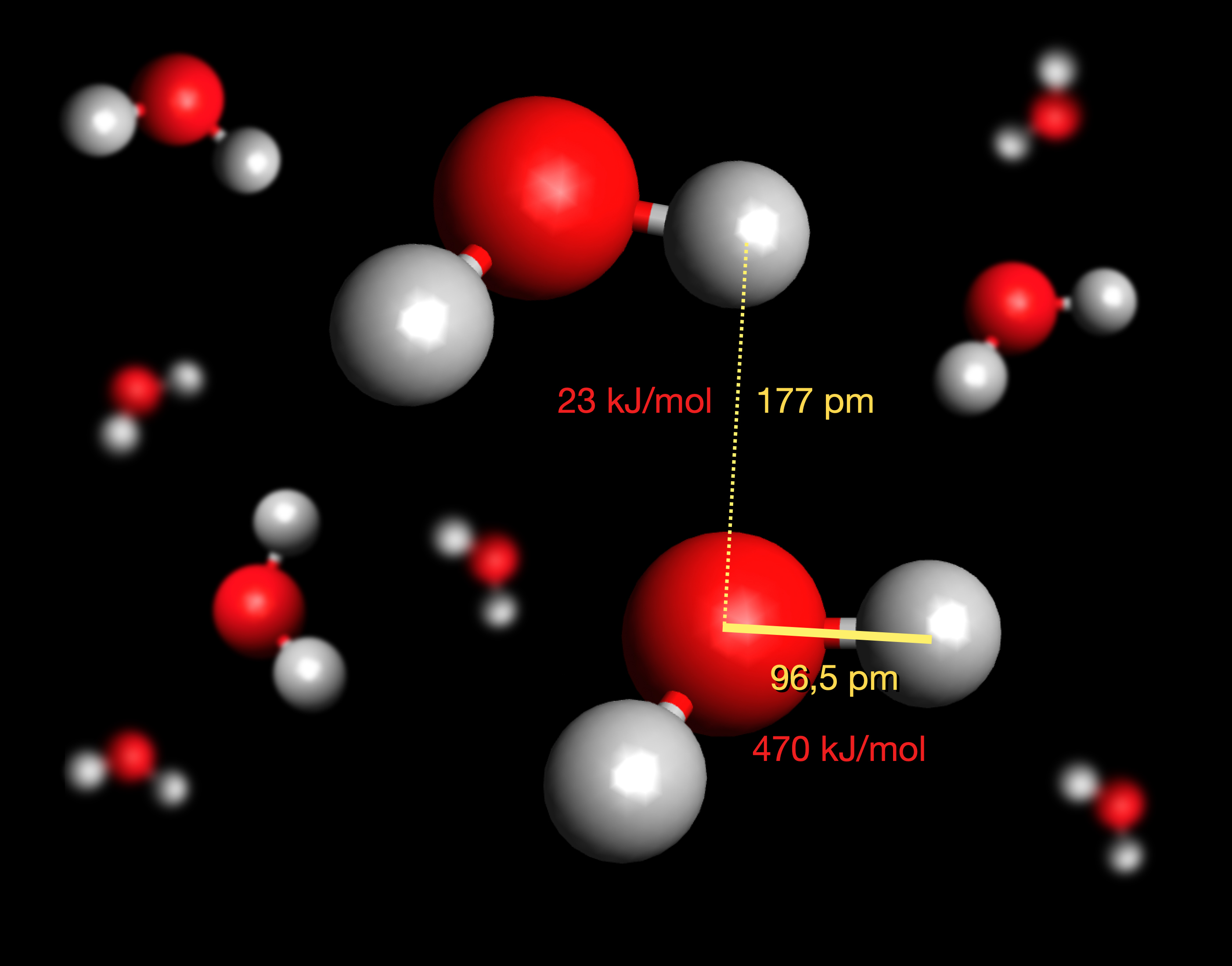
Quantitative Betrachtungen zu H-Brücken
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Bindungslängen
Eine H---O-Brücke ist mit 177 pm recht lang im Vergleich zu einer kovalenten H-O-Bindung mit 96,5 pm. Die Abbildung 1 im vorherigen Abschnitt ist also nicht ganz korrekt, dort waren die Abstände zwischen den H- und O-Atomen gleich groß, egal ob es sich um eine kovalente H-O-Bindung oder um eine H---O-Wasserstoffbrücken-Bindung handelte [3].
Bindungsdissoziationsenergien
Noch interessanter ist die Energie, die man aufwenden muss, um eine Bindung zu trennen. Für die kovalente H-O-Bindung ist eine Bindungsdissoziationsenergie von 470 kJ/mol notwendig, für eine H---O-Brücke aber nur 23 kJ/mol. Eine H---O-Brücke ist also ca. 20 mal schwächer als eine kovalente H-O-Bindung. Da der kovalente Anteil an einer H---O-Brücke aber ca. 10% ausmacht (90% sind elektrostatische Wechselwirkungen), ist eine H---O-Brücke immer noch wesentlich stärker als eine Dipol-Dipol-Wechselwirkung [3].
Interessant ist die F-H---F--Wasserstoffbrücken-Bindung, die ein Fluorwasserstoff-Molekül mit einem Fluorid-Ion bildet. Diese H-Brücke ist die stärkste intermolekulare Bindung, die man kennt. Die Bindungsdissoziationsenergie beträgt nämlich 150 kJ/mol [5].
Zeitliche Dimension
Im aktuellen Lehninger finden wir auch Angaben zur zeitlichen Dimension von H-Brücken. Die Lebensdauer einer H-Brücke liegt zwischen 1 und 20 Picosekunden. Eine Picosekunde ist der billionste Teil einer Sekunde, also 1 ps = 10-12 s. Sobald sich im Wasser eine H-Brücke auflöst, bildet das H2O-Molekül innerhalb von 0,1 ps eine neue H-Brücke.
Ein H2O-Molekül kann mit maximal vier anderen Wasser-Molekülen solche H-Brücken bilden. In flüssigem Wasser sind die Moleküle allerdings in ständiger Bewegung, so dass ein H2O-Molekül durchschnittlich mit 3,4 anderen H2O-Molekülen über H-Brücken verbunden ist.
H-Donatoren und -Akzeptoren Sek. II, Studium
Wasserstoffbrücken-Bindungen können sich nicht nur zwischen H2O-Molekülen bilden, sondern allgemein zwischen einem H-Brücken-Donator und einem H-Brücken-Akzeptor.
H-Brücken-Donator:
Ein Wasserstoff-Atom, das an ein stark elektronegatives Atom kovalent gebunden ist. Es gibt drei H-Brücken-Donatoren, nämlich -O-H, -N-H und -F-H.
H-Brücken-Akzeptor:
Ein elektronegatives Atom mit mindestens einem freien Elektronenpaar, also Sauerstoff, Stickstoff oder Fluor. Dieses Atom muss kovalent durch eine Einfach- oder Doppelbindung an ein Atom mit geringerer Elektronegativität gebunden sein, zum Beispiel Kohlenstoff.
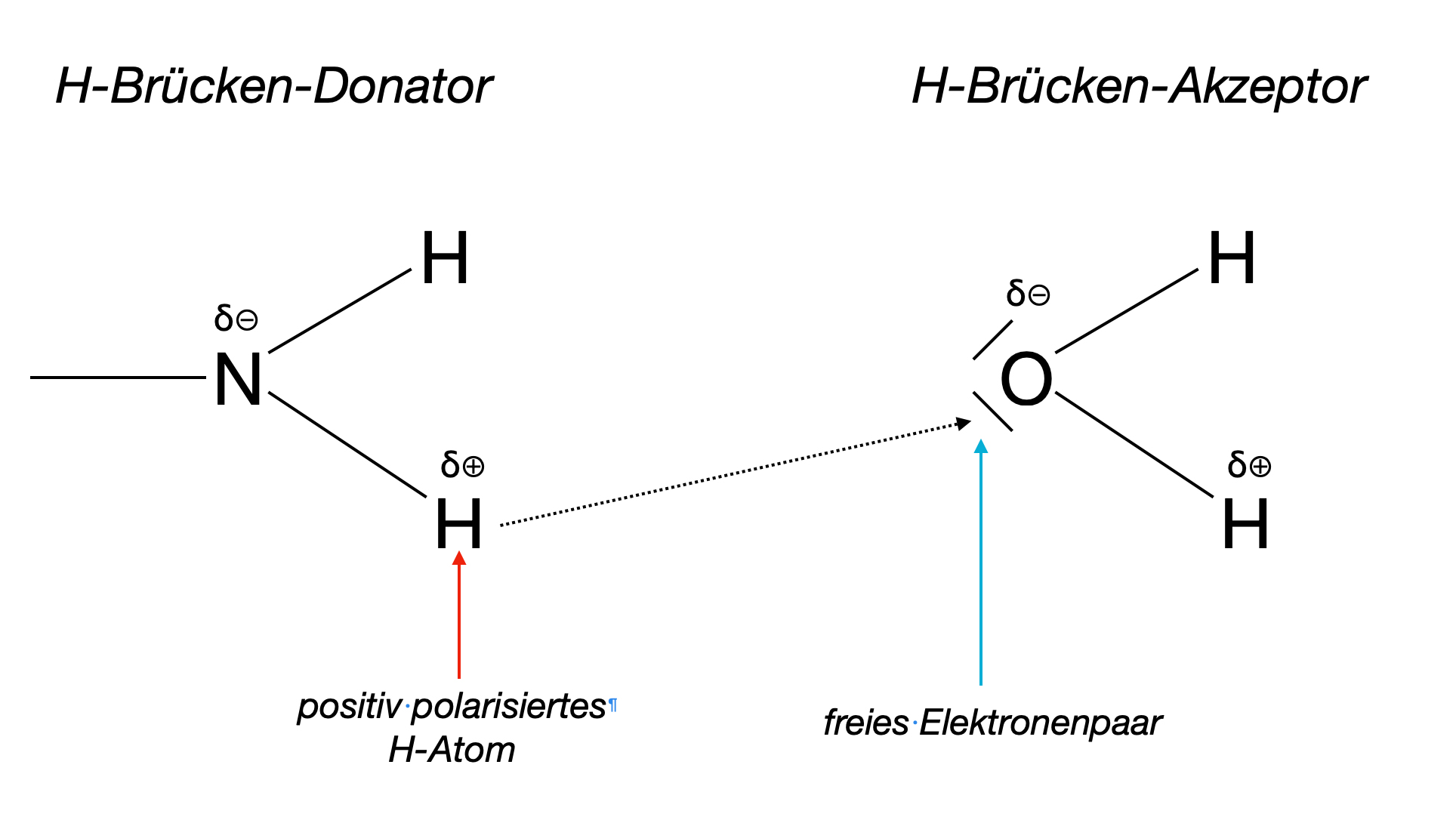
Wasserstoffbrücken-Bindung zwischen einer Amino-Gruppe und Wasser
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Beispiele für mögliche H-Brücken:
Das folgende Bild zeigt einige der möglichen H-Brücken zwischen Donatoren und Akzeptoren:
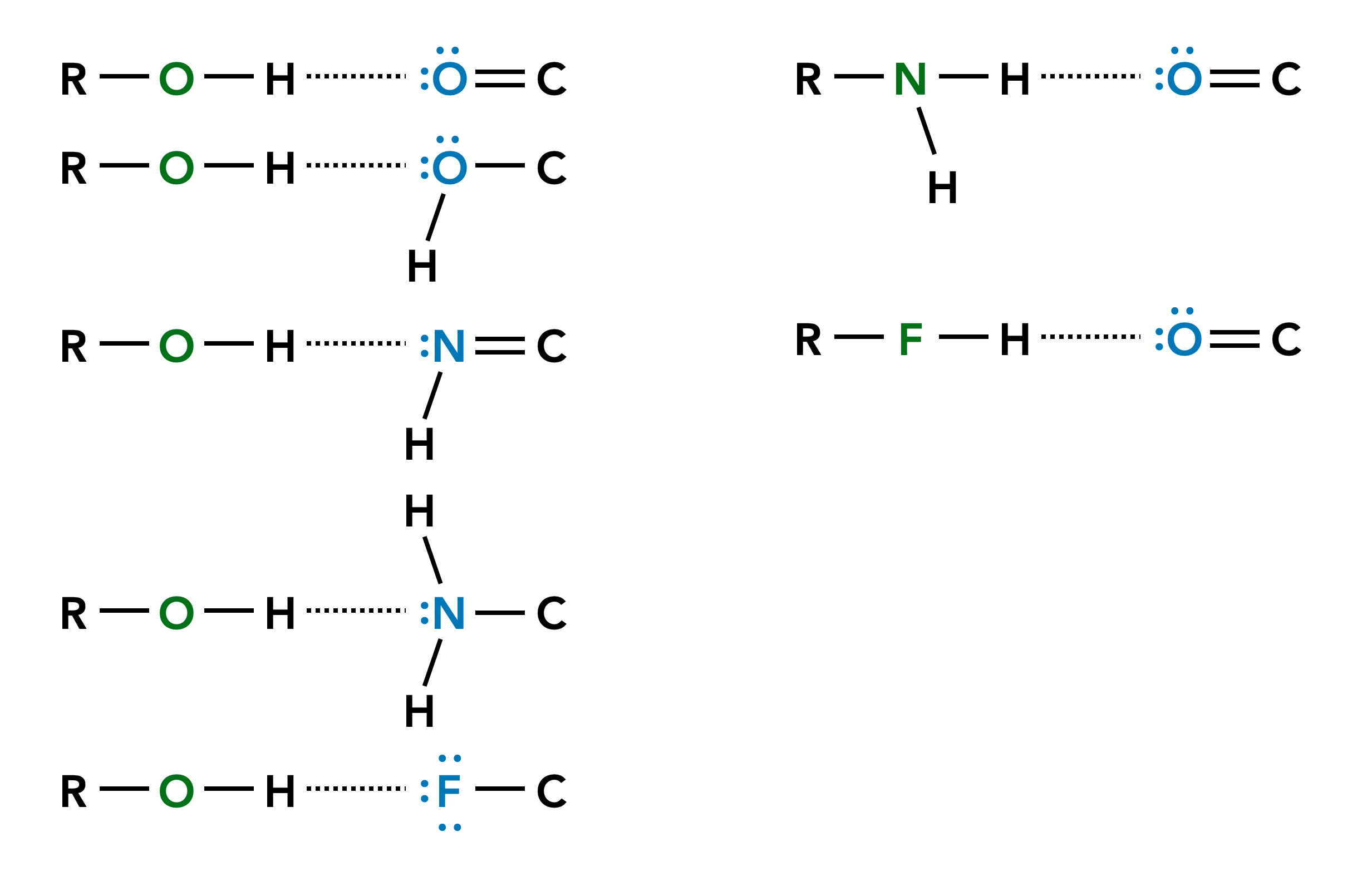
Einige der möglichen Wasserstoffbrücken-Bindungen
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
In der Biochemie spielen vor allem Sauerstoff- und Stickstoff-Atome eine wichtige Rolle als H-Brücken-Akzeptoren bzw. als Träger der H-Brücken-Donatoren. So werden beispielsweise die Sekundärstrukturen der Proteine (alpha-Helix und beta-Faltblatt) durch H-Brücken zusammengehalten. Noch bekannter ist vielleicht die Basenpaarung der DNA, die ebenfalls durch H-Brücken zwischen den komplementären DNA-Basen Adenin-Thymin bzw. Guanin-Cytosin ermöglicht wird.
Auf dieser Seite in der Zellbiologie-Abteilung wird auf die Struktur des H2O-Moleküls und auf die H-Brücken zwischen Wasser-Molekülen eingegangen. Auch die biologischen Auswirkungen dieser H-Brücken werden behandelt, zum Beispiel die Dichteanomalie des Wassers, die Wassertieren im Winter das Überleben sichert.
H-Brücken und Schlittschuhlaufen
Was haben Wasserstoffbrücken mit Schlittschuhlaufen zu tun, könnte man sich fragen?
Im festen Eis ist ein H2O-Molekül durch H-Brücken mit genau vier anderen H2O-Molekülen verbunden, in flüssigem Wasser jedoch nur mit durchschnittlich 3,4 anderen H2O-Molekülen. Daher hat Eis auch eine geringere Dichte als flüssiges Wasser und schwimmt auf dem Wasser. Verhielte sich Wasser wie eine "normale" Flüssigkeit, müsste das Eis eine höhere Dichte habe und nach unten auf den Seeboden sinken - Schlittschuhlaufen ginge dann nur mit einer Taucherausrüstung.
Nach dem Prinzip von Le Chatelier (Prinzip des kleinsten Zwangs) kann man durch einen Druck auf das Eis das Gleichgewicht zwischen festem und flüssigem Wasser verschieben. Im Eis benötigen die Wasser-Moleküle mehr Volumen als im flüssigen Wasser. Dem Druck weicht das Wasser dann aus, indem es flüssig wird. Beim Schlittschuhlaufen wird ein enormer Druck auf das Eis ausgeübt, durch diesen Druck wird das Eis zum flüssigen Wasser, und die Kufen der Schlittschuhe gleiten auf dieser dünnen Wasserschicht mühelos über das Eis [5].
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Peter Huy, Vorlesung Organische Chemie Teil 21 (Uni Rostock).
- Binnewies et al., Allgemeine und anorganische Chemie, 3. Auflage, Springer-Verlag 2016.