Noch ein kleines Problem
Wir hatten gerade gesehen, wie der Protonengradient im Mitochondrium aufrecht erhalten wird. Bestimmte Proteine entladen auf der Matrixseite die Coenzyme NADH/H+ und FADH2, die dabei freigesetzten Protonen werden aber nicht in die Matrix abgegeben, sondern gelangen durch die Proteine in den Zwischenmembranraum. Die Energie für diesen Transport stammt letztlich aus einer abgemilderten Knallgasreaktion:
2 NADH/H+ + O2 →2 NAD+ + 2 H2O + viel Energie
2 FADH2 + O2 →2 FAD + 2 H2O + viel Energie
Allerdings findet die Reaktion nicht in einem Schritt statt, wie die Reaktionsgleichungen vielleicht nahe legen, sondern die Umsetzungen sind in viele kleine Schritte untergliedert, die jeweils eine kleinere Energiemenge zur Verfügung stellen, so dass die Zelle nicht geschädigt werden kann. Wie das jetzt genau funktioniert, wollen wir uns auf dieser Seite ansehen. Dazu müssen wir aber wieder mal etwas weiter ausholen, ganz ohne Kenntnisse der Sekundarstufen I - Chemie geht es leider nicht.
Redoxreaktionen
Die Thermitreaktion
Aus dem Chemie-Unterricht der Sekundarstufe I kennen Sie vielleicht die Thermitreaktion, bei der Aluminium und Eisenoxid zu flüssigem Eisen und Aluminiumoxid reagieren und dabei sehr viel Energie freisetzen:
Fe2O3 + 2 Al → Al2O3 + 2 Fe ΔH = -851,5 kJ/mol
Bei der Thermitreaktion gibt man Eisenoxid und Aluminium zusammen in ein Gefäß, das im Boden ein Loch hat. Das Gefäß wird auf zwei Eisenbahnschienen gestellt, die verschweißt werden sollen. Dann entzündet man das Thermitgemisch mit einer Art Wunderkerze, und los geht die Reaktion. Die Reaktion verläuft extrem heftig, stark exotherm, und aus dem Behälter tropft das flüssige Eisen auf die Schweißstelle.

Thermitreaktion zum Schweißen von Eisenbahnschienen
Skatebiker, Public domain, via Wikimedia Commons
Was passiert eigentlich bei dieser extrem exothermen Reaktion?
Die Aluminium-Atome geben die drei Elektronen ab, die sich auf ihrer Außenschale befinden. Die Atome gelangen dadurch in den Edelgaszustand mit 8 Elektronen auf der Außenschale.
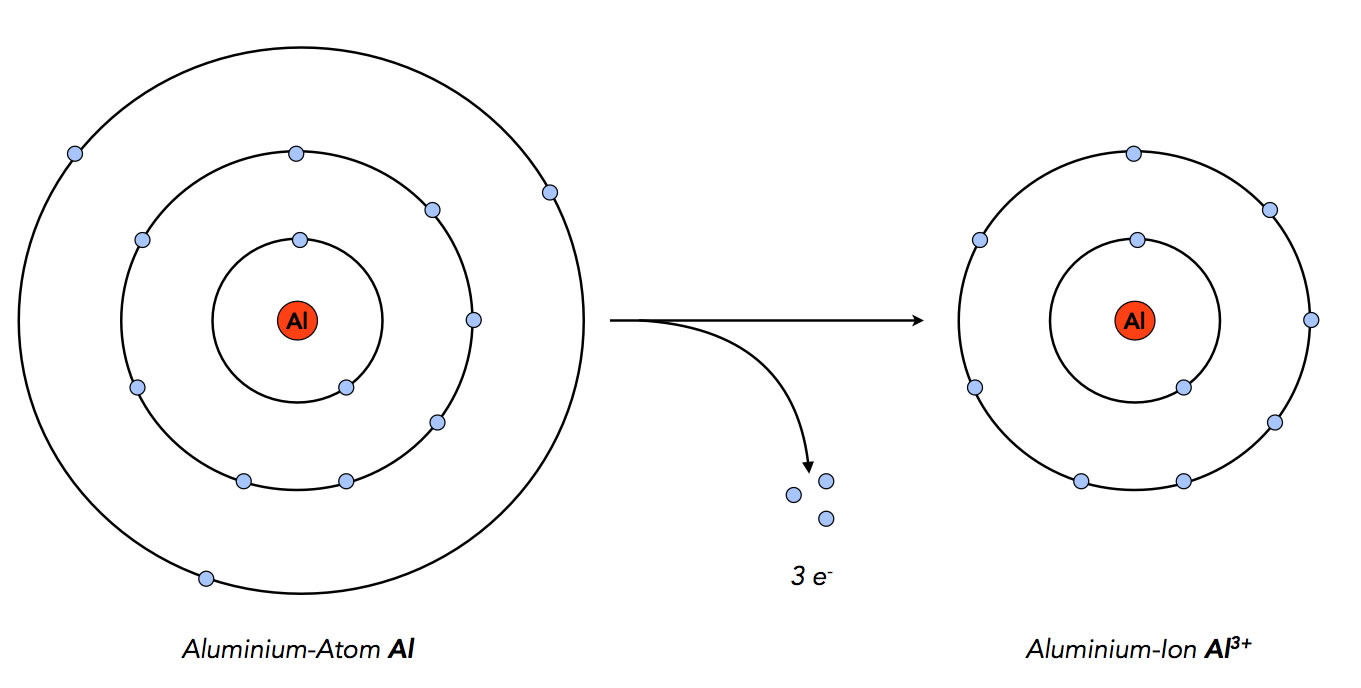
Aluminium-Atome geben drei Elektronen ab, um in den Edelgaszustand zu gelangen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das Eisen liegt in Form von Eisenoxid vor. In diesem Zustand sind die Eisen-Teilchen dreiwertig positiv, ihnen fehlen also drei Elektronen in ihrer Elektronenhülle. Bei der Reaktion geben die Aluminium-Atome ihre Elektronen an die Eisen-Ionen Fe3+ ab, dabei entsteht metallisches Eisen Fe. Durch die große Wärmemenge, die bei der Reaktion abgegeben wurde, wird das Eisen flüssig und fließt in die Nahtstelle zwischen den Schienen, wo es dann fest wird.
Diesen Vorgang kann man auch auf etwas abstraktere Weise darstellen:
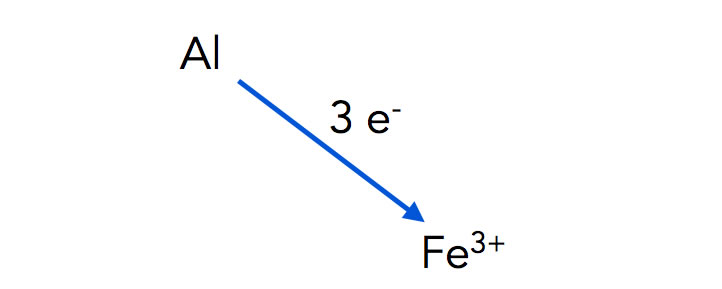
Aluminium-Atome geben drei Elektronen an Eisen-Kationen ab
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Warum diese Art der Darstellung? Denken Sie an das Wassermühlen-Beispiel von der letzten Seite. Wasser fließt immer bergab, solange es nicht hoch gepumpt wird. Auch Elektronen fließen immer bergab. Aluminium ist unedler als Eisen, daher können Aluminium-Atome problemlos Elektronen an Eisen-Kationen abgeben, denen ja Elektronen fehlen. Umgekehrt geht das nicht, Eisen-Atome können nicht freiwillig Elektronen an Aluminium-Kationen abgeben. Das wäre dann ein Bergauf-Transport, der eine gewisse Energiezufuhr benötigen würde.
Ein zweiter Versuch sollte Ihnen ebenfalls aus dem Chemie-Unterricht bekannt sein: Man stellt einen Eisennagel in eine Lösung aus Kupfersulfat. Nach kurzer Zeit überzieht sich der Eisennagel mit einem rotbraunen Überzug aus Kupfer. Die Reaktion kann man als Reaktionsgleichung formulieren:
Fe (s) + Cu2+(aq) → Fe2+(aq) + Cu(s)
Oder man stellt sie wieder abstrakt graphisch dar:
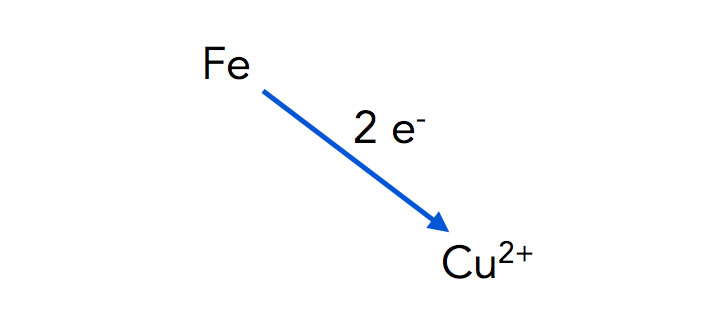
Eisen-Atome geben zwei Elektronen an Kupfer-Kationen ab
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Taucht man dagegen einen Kupfernagel in eine Eisensulfat-Lösung, passiert gar nichts. Die Elektronen müssten dazu ja "bergauf" transportiert werden, was nur unter Einsatz von Energie ginge.
Stellt man den Kupfernagel jedoch in eine Silbernitrat-Lösung, kann man wieder eine Reaktion beobachten. Die Kupfer-Atome geben Elektronen an die Silber-Kationen ab. Fasst man die Ergebnisse dieser drei Versuch graphisch zusammen, dann erhält man folgendes Schema:
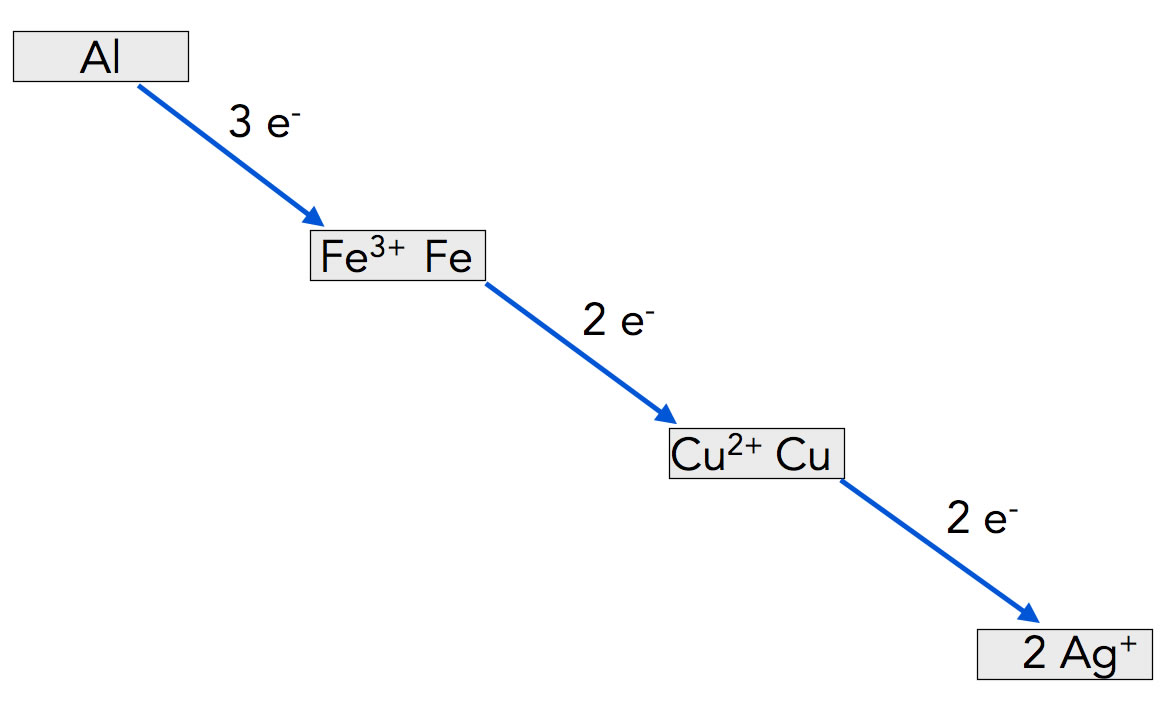
Elektronentransportkette vom Aluminium zum Silber
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Was wir hier sehen, ist eine sogenannte Elektronentransportkette. Das unedelste Metall steht ganz oben (Aluminium), das edelste ganz unten. Wenn Elektronen von einem weiter oben stehendem Metall zu einem weiter unten stehenden Metall-Kation fließen, so wird mehr oder weniger viel Energie freigesetzt. Bei der Thermitreaktion reicht diese Energiemenge sogar aus, um Eisen zum Schmelzen zu bringen.
Ein Elektronentransport kann Energie liefern
Nach diesem Ausflug in die Chemie sollten Sie eigentlich verstanden haben, dass ein Elektronentransport durchaus Energie liefern kann. Man kann damit zum Beispiel eine Batterie oder einen Akkumulator betreiben. Aus mehreren Kupfer- und Zinkscheiben beispielsweise kann man sich eine einfache Batterie zusammenbauen. Alessandro Volta, der Erfinder der ersten Batterie, hat das bereits um das Jahr 1800 herum gemacht.
Ein ähnlicher Elektronentransport findet in den Mitochondrien der Zellen statt. Und die hier ablaufende Elektronentransportkette treibt die Pumpe an, mit der Protonen aus der Matrix in den Zwischenmembranraum gepumpt werden.
Die Energie zum ständigen Hinauspumpen der Protonen stammt aus einem Elektronentransport, der an der inneren Membran des Mitochondriums stattfindet.
Das Redoxpotenzial
Betrachten wir noch einmal die Abbildung 5 mit der Elektronentransportkette. Der Fachbegriff "Redoxpotenzial" beschreibt die Fähigkeit eines Teilchens, Elektronen abzugeben. Das Redoxpotenzial wird in Volt oder Millivolt angegeben.
Schauen wir uns einmal die Redoxpotenziale der vier Metalle aus der Abbildung 5 an:
- Aluminium: -1,66 V
- Eisen: -0,44 V
- Kupfer: +0,16 V
- Silber: +0,80 V
Ein unedles Metall wie Aluminium, Zink oder Eisen (negatives Redoxpotenzial!) kann Elektronen an ein die Kationen eines edleren Metalls wie Kupfer oder Silber (positiveres Redoxpotenzial) abgeben. Die Begriffe "edel" und "unedel" sind allerdings recht ungenau und vor allem relativ. Zink kann beispielsweise Elektronen an Eisen abgeben, trotzdem würde man Eisen nicht als "edel" bezeichnen. Kupfer (edel) kann dagegen Elektronen an das Silber (ebenfalls edel) abgeben, aber Kupfer ist gegenüber dem Silber unedel. Diese Begriffe stiften nur Verwirrung, und um dies zu vermeiden, hat man den Begriff Redoxpotenzial eingeführt, der dem Ganzen einen quantitativen Aspekt verleiht.
Stoffe mit einem negativen Redoxpotenzial werden bei solchen Graphiken immer oben eingezeichnet, Stoffe mit einem positiven Redoxpotenzial unten. In der Skizze hat beispielsweise das Aluminium das negativste Redoxpotenzial und Silber (Ag) das positivste. Wollte man die Graphik um Natrium ergänzen, so müsste man dieses noch oberhalb des Aluminiums einzeichnen, dann Natrium hat mit -2,71 V ein noch negativeres Redoxpotenzial als Aluminium. Umgekehrt hat Gold mit +1,50 V ein noch positiveres Redoxpotenzial als Silber, müsste also noch unterhalb des Silbers eingezeichnet werden.
Auch organische Verbindungen können ein Redoxpotenzial haben
Nicht nur Metalle haben ein Redoxpotenzial und sind in der Lage, Elektronen abzugeben und dadurch oxidiert zu werden. Auch viele organische Verbindungen sind dazu in der Lage. Und damit sind nicht nur kleine Moleküle wie der Protonen- und Elektronentransporter NAD+ gemeint, sondern auch richtig große Enzyme.
Elektronen- und Protonentransport an der inneren Mitochondrien-Membran
In der inneren Membran der Mitochondrien befinden sich vier große Enzymkomplexe (also aus mehreren einzelnen Enzymen zusammengesetzte Gebilde), und diese vier Enzymkomplexe unterscheiden sich in ihrem Redoxpotenzial. Schauen Sie sich dazu bitte die folgende Abbildung an, die in Anlehnung an [4, S. 869] entstand:
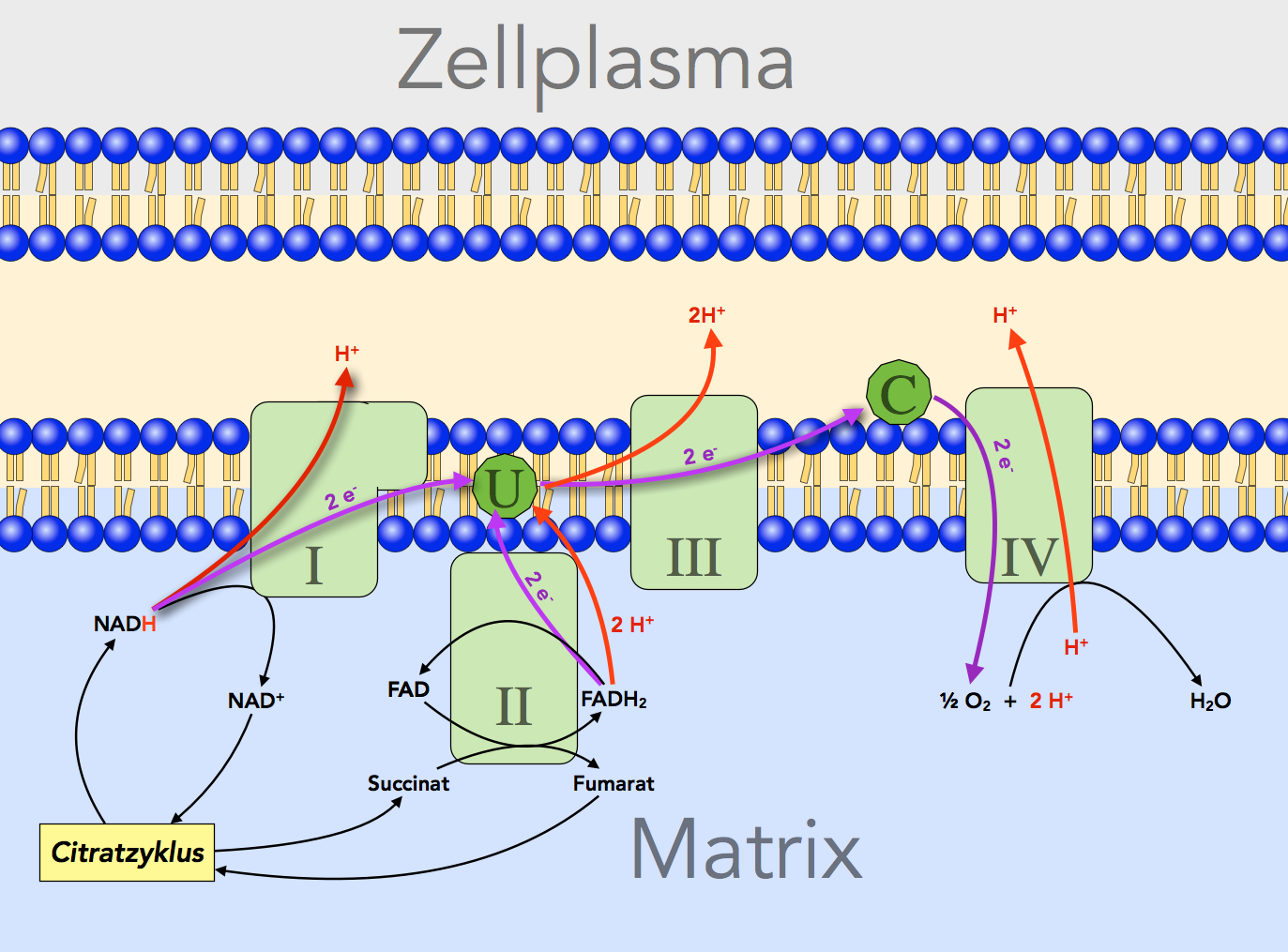
Ausschnitt aus der inneren Membran eines Mitochondriums mit vier Enzymkomplexen (I, II, III, IV), Ubichinon (U) und Cytochrom (C)
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
In diesem Bild ist auf vereinfachte Weise der Elektronen- und Protonentransport quer über die innere Mitochondrienmembran dargestellt. Die grün eingezeichneten Rechtecke symbolisieren große Multienzymkomplexe, die hier der Einfachheit halber als I bis IV bezeichnet werden. Der Enzymkomplex II ist nichts anderes als die Succinat-Dehydrogenase aus dem Schritt 7 des Citratzyklus.
Beginnen wir mit der Besprechung der Abbildung ganz links, beim Enzymkomplex I, der auch als NADH-Dehydrogenase bezeichnet wird.
Enzymkomplex I: NADH-Dehydrogenase
Das mit Wasserstoff beladene Coenzym NADHtransportiert ein Proton und zwei Elektronen. Meistens ist ein zweites Proton mit diesem Coenzym assoziiert, daher schreibt man oft auch NADH/H+ für das beladene NAD+. In einigen Fachbüchern wird dagegen die Schreibweiese NADHtransportiert bevorzugt, so auch im aktuellen Lehninger, an dem sich die Abbildung orientiert.
Die beiden Elektronen werden vom Enzymkomplex I auf eine kleinere Verbindung namens Ubichinon übertragen, chemisch gesehen ein komplexeres Keton. Durch die Reduktion (Aufnahme von Elektronen = Reduktion) wird aus dem Keton ein Alkohol namens Ubichinol, was in der Abbildung aber nicht dargestellt ist.
Durch den "Bergabtransport" der beiden Elektronen wird genau Energie freigesetzt, um drei bis vier Protonen quer durch die Membran zu transportieren. Das war ja das Ziel der Atmungkette, die Erzeugung eines Protonengradienten quer über die innere Membran.
Eine wesentlich ausführlichere Darstellung habe ich für Studierende der Biologie geschrieben. Sie finden diese Darstellung in dem Biologie-Lexikon auf dieser Homepage.
Enzymkomplex II: Succinat-Dehydrogenase
Dieses Enzym kennen wir bereits aus dem Citratzyklus. Die Succinat-Dehydrogenase ist das einzige Enzym des Citratzyklus, das in der inneren Membran des Mitochondriums lokalisiert ist. Alle anderen Enzyme des Citratzyklus befinden sich im Plasma der Matrix.
Bei der Oxidation des Succinats zum Fumarat werden die beiden freigesetzten Elektronen und Protonen zunächst auf das Coenzym FAD übertragen und dort "zwischengelagert". Vom FADH2, der reduzierten Form des FAD; gelangen die Elektronen dann ebenfalls auf das Ubichinon. Aber auch die beiden Protonen des FADH2 werden auf den Keton Ubichinon übertragen. Durch die Aufnahme der beiden Elektronen und der beiden Protonen wird aus dem Keton ein Alkohol. Ubichinon wird oft einfach als Q dargestellt, und dann kann man folgende Reaktionsgleichung aufstellen:
FADH2 + Q → FAD + QH2
So steht es in den meisten Büchern. Wenn wir die Reduktion des Ketons verdeutlichen wollen, müssten wir allerdings etwas ausführlicher verfahren, vielleicht so:
FADH2 + Q=O → FAD + HQ-OH
Enzymkomplex III: Cytochrom c - Reduktase
Das reduzierte Ubichinon, also das QH2, gibt nun die beiden Elektronen an den zweiten Enzymkomplex ab, die Cytochrom c - Reduktase. Die beiden Protonen werden von diesem Enzym in den Zwischenmembranraum transportiert. Die Cytochrom c - Reduktase hat ein etwas positiveres Redoxpotenzial als das reduzierte Ubicinol, daher fließen die Elektronen hier "bergab" zum Cytochrom, das dadurch reduziert wird. Das Enzym hat daher auch seinen Namen "Reduktase".
C: Cytochrom c
Diese Verbindung ist wieder etwas einfacher aufgebaut als die Enzymkomplexe. Cytochrom c hat ein positiveres Redoxpotenzial als der Enzymkomplex II und kann daher die beiden Elektronen vom Ubichinol (QH2) aufnehmen.
Enzymkomplex IV: Cytochrom c - Oxidase
Vom reduzierten Cytochrom c fließen die Elektronen nun bergab zum Enzymkomplex III, der Cytochrom c - Oxidase. Dieser Komplex verdankt seinen Namen der Tatsache, dass durch die Aufnahme der beiden Elektronen das Cytochrom c wieder oxidiert wird (Oxidation = Abgabe von Elektronen). Die Energie, die bei dem Bergabtransport der Elektronen freigesetzt wird, kann wieder genutzt werden, um Protonen in den Zwischenmembranraum zu pumpen und so den Protonengradienten zu vergrößern.
Sauerstoff
Kommen wir nun zum letzten Glied in dieser Elektronentransportkette. Der Sauerstoff wird von den heterotrophen Lebewesen
Schauen wir uns nun das folgende Schema an:
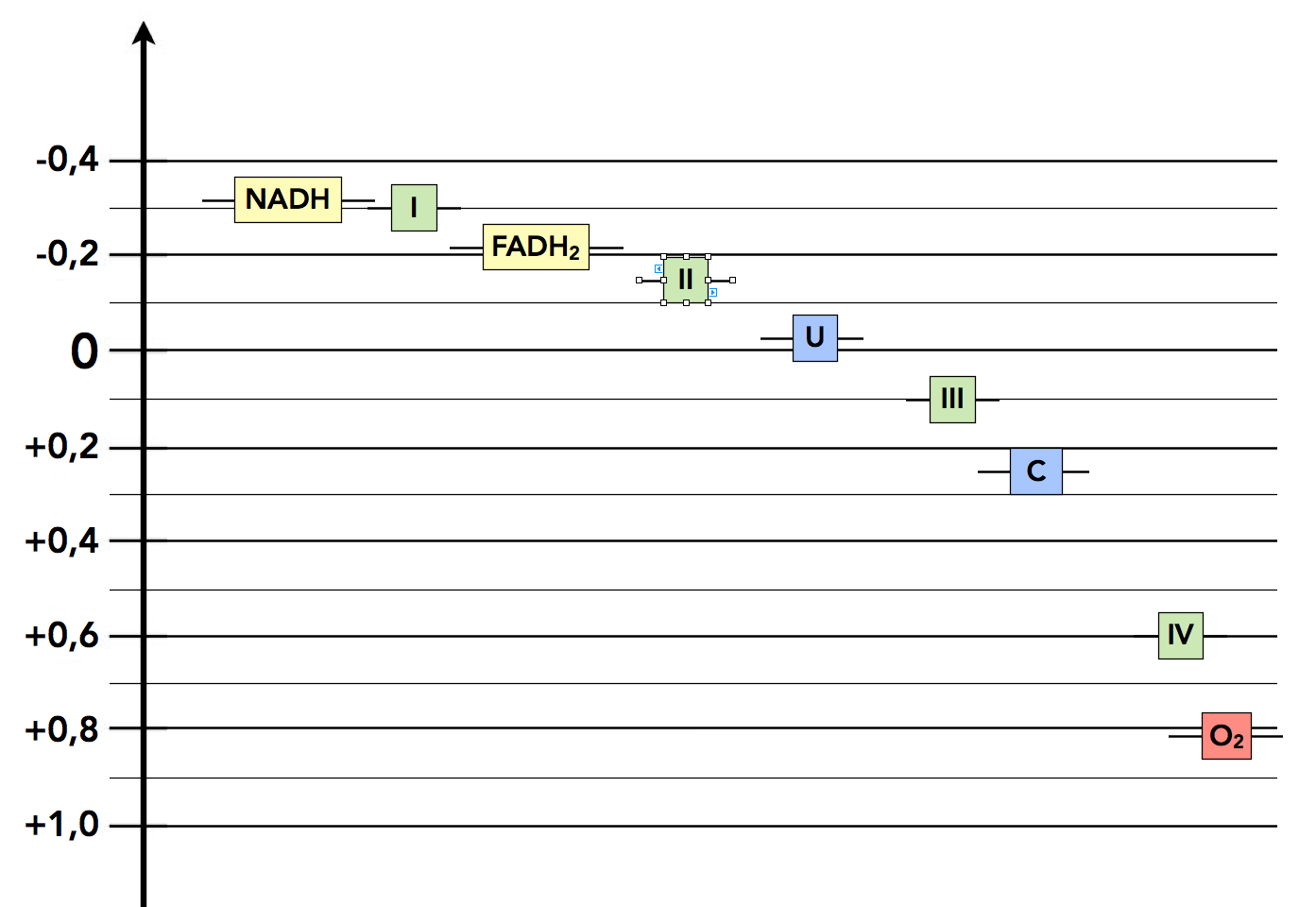
Die Redoxpotenziale in der Elektronentransportkette
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Hier sehen wir die Redoxpotenziale der Komponenten der Elektronentransportkette. Ganz oben (negatives Redoxpotenzial) stehen die beladenen Coenzyme (gelb). Die Komplexe I und II haben ein etwas positiveres Redoxpotenzial, so dass sie die Elektronen der Coenzyme übernehmen können. Das Ubichinon nimmt dann den beiden Komplexen I und II die Elektronen ab und leitet sie an den Komplex III weiter, von dort geht es weiter zum Cytochrom und zum Komplex IV. Der Sauerstoff ist dann der sogenannte Endakzeptor der Elektronen.
Die Werte der Redoxpotenziale wurden der in den Quellen aufgelisteten Fachliteratur übernommen. Im aktuellen Lehninger [1] findet man zum Beispiel:
- NADH: -0,32 V
- NADH-Dehydrogenase: -0,30 V
- Ubichinon: +0,045 V
- Cytochrom c: + 0,254 V
- Sauerstoff: + 0,817 V
Der Stillwell [3] nennt für FADH2 ein Redoxpotenzial von -0,22 V, im Alberts [4] findet sich nur eine Zeichnung, und im Stryer [2] findet man ähnliche Werte wie in der anderen Literatur.
Protonentransport
Der Komplex I ist für das "Entladen" von NADH/H+ verantwortlich. Der Komplex nimmt dem Coenzym die beiden Protonen (und die beiden Elektronen) ab. Die Protonen werden dann auf die andere Seite der Membran transportiert, in den Membranzwischenraum.
Der Komplex II ist für das "Entladen" von FADH2 zuständig. Die beiden Protonen werden dann vom Komplex III durch die Membran gepumpt.
Der Komplex IV hat zwei Aufgaben. Zum einen pumpt er Protonen in den Zwischenmembranraum, zum anderen katalysiert er die Herstellung von Wasser. Die Protonen entstammen der Mitochondrien-Matrix, und der Sauerstoff kommt aus der Außenluft. Durch den Verbrauch der beiden Protonen für die Synthese von Wasser wird die Konzentration der Protonen in der Matrix noch einmal verringert, was ja gut ist für die Aufrechterhaltung des Protonengradienten.
Quellen:
- Nelson, Cox. Lehninger Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Stillwell, William. An Introduction to Biological Membranes. Elsevier Science 2016.
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.