Übersicht
Als Alkalimetalle werden die Elemente der Hauptgruppe I des Periodensystems bezeichnet. Der Wasserstoff, der ganz oben in der Hauptgruppe I steht, gehört allerdings nicht dazu. Und das sind die sechs Alkalimetalle:
- Lithium Li
- Natrium Na
- Kalium K
- Rubidium Rb
- Cäsium Cs
- Francium Fr
Didaktisches
Die Alkalimetalle spielen eine große Rolle im Chemie-Unterricht, weil sie alle sehr ähnliche Eigenschaften haben, die sich sehr leicht mit dem atomaren Aufbau der Metalle erklären lassen (Struktur-Eigenschafts-Konzept; Stoff-Teilchen-Konzept). Experimente mit den Alkalimetallen selbst sind wegen der hohen Reaktivität der Elemente nicht als Schülerversuch geeignet, aber mit den Salzen der Alkalimetalle lässt sich in Schülerversuch viel anfangen.
Eigenschaften
Die Eigenschaften der Alkalimetalle lassen sich leicht zusammenfassen und merken. Alle Alkalimetalle sind außergewöhnlich leicht (für ein Metall) und weich (für ein Metall). Natrium und Kalium lassen sich mit dem Messer schneiden. Lithium ist dafür etwas zu hart, und die drei anderen Metalle (Rb, Cs und Fr) sind dafür zu reaktiv. Die Schmelzpunkte der Alkalimetalle sind sehr niedrig (für ein Metall), Cäsium schmilzt bereits durch Handwärme. Man könnte fast meinen, dass Lithium, Natrium und die anderen Elemente der ersten Hauptgruppe gar keine Metalle sind. Das ist aber ein Irrtum. Wenn man Natrium mit dem Messer durchschneidet, sieht man eine metallisch glänzende Schnittfläche, die allerdings sehr schnell trübe wird, weil das Element mit dem Luftsauerstoff reagiert. Auch leitet das Element den elektrischen Strom, wie man sehr leicht nachweisen kann. Das alles spricht dafür, dass Natrium (wie die anderen Alkalimetalle) ein richtiges Metall ist.
Chemisch sind alle Alkalimetalle sehr reaktiv. Am wenigsten reaktiv und damit noch für vorsichtige Schülerversuch geeignet ist das Lithium. Natrium und Kalium lassen sich mit dem Messer schneiden, dabei läuft die metallisch glänzende Schnittfläche sehr schnell matt an, weil das Metall mit dem Luftsauerstoff zu Natriumoxid bzw. Kaliumoxid reagiert. Mit Wasser reagieren beide Metalle heftig; Kalium entzündet sich sogar dabei. Zu den Reaktionen und den Reaktionsgleichungen kommen wir später noch.
Rubidium und Cäsium können nicht wie Natrium und Kalium auf ein Filtrierpapier gelegt und mit dem Messer durchgeschnitten werden, weil sie sofort, wenn man sie aus dem Vorratsgefäß herausnimmt, unter Selbstentzündung mit dem Luftsauerstoff reagieren. Beim Francium, das noch reaktiver ist als Rubidium und Cäsium, hat man noch ganz andere Probleme: Francium ist nämlich ein radioaktives Alkalimetall.
Reaktionen
Reaktion mit Sauerstoff
Die Alkalimetalle reagieren sehr schnell mit dem Sauerstoff in der Luft. Dies soll am Beispiel Natrium verdeutlicht werden:
$Na_{(s)} + O_{2}{(g)} \to Na_{2}O{(s)}$
Wenn diese und die folgenden Reaktionsgleichungen nicht korrekt dargestellt werden, dann ist der verwendete Browser entweder veraltet oder nicht mit dem Internet verbunden, um sich das MathJax-Paket zu holen.
Noch ist die Reaktionsgleichung nicht vollständig. Sie gibt aber die Wortgleichung
$Natrium + Sauerstoff \to Natriumoxid$
recht gut wieder. Allerdings handelt es sich noch nicht um eine Reaktionsgleichung, denn die Zahl der dargestellten Atome ist auf beiden Seiten der "Gleichung" unterschiedlich. Links steht zum Beispiel ein Na-Atom, rechts befinden sich aber zwei. Man muss ein bisschen "herumprobieren", bis man die Gleichung aufgestellt hat:
$2 Na_{(s)} + \frac{1}{2}O_{2}{(g)} \to Na_{2}O{(s)}$
Das sieht schon eher nach einer Gleichung aus. Allerdings stört der Term $ \frac{1}{2}O_{2}{(g)}$. Viele Chemie-Lehrer mögen es gar nicht, wenn man mit halben Molekülen oder Atomen arbeitet. Daher multiplizieren wir die gesamte Gleichung mit dem Faktor 2 und erhalten die endgültige Reaktionsgleichung für die Reaktion von Natrium mit Sauerstoff:
$4 Na_{(s)} + O_{2}{(g)} \to 2 Na_{2}O{(s)}$
Reaktion mit Wasser
Versuch
Reaktion von Natrium mit Wasser
Durchführung (Lehrerversuch im Abzug!):
Eine große Glaswanne wird mit Wasser (Leitungswasser) gefüllt, dem ein paar Tropfen Phenolphthalein-Lösung zugesetzt wurden.
Dann wird mit dem Küchenmesser ein kleines Stück Natrium von einem größeren Natriumstück abgeschnitten. Das Natriumstück muss anschließend vollständig entrindet werden, alle Seiten des Stücks müssen metallisch glänzen.
Anschließend wird das Natriumstück mit der Pinzette in die Schüssel mit dem Wasser gegeben. Dann wird die Scheibe des Abzugs sofort heruntergezogen.
Beobachtungen:
Das Natriumstück flitzt auf dem Wasser hin und her, dabei kann man ein mehr oder weniger lautes Zischen vernehmen. Das Natriumstück wird immer kleiner und formt sich dabei zu einer Kugel. Manchmal sind auch gelbe Flammen zu beobachten, wenn die Kugel auf dem Wasser hin- und herflitzt. Oft gibt es am Ende einen kleinen Knall, und die restliche Kugel zerplatzt. Das Wasser, in dem das Natrium hin- und hergeschwommen ist, fühlt sich am Ende des Versuchs seifig an; außerdem hat es eine violette Farbe angenommen.
Bei der Reaktion mit Wasser entsteht ein farb- und geruchloses Gas, das man mit Hilfe der Knallgasprobe leicht als Wasserstoff identifizieren könnte, was wir aber aus Sicherheitsgründen nicht machen. Die Violettfärbung des Phenolphthaleins und das seifige Gefühl deuten darauf hin, dass bei dem Versuch eine Lauge entstanden ist. Im Chemieunterricht spielen eigentlich nur vier Laugen eine wichtige Rolle: Natronlauge NaOH, Kalilauge KOH, Kalkwasser Ca(OH)2 und Ammoniakwasser (NH4OH). Welche dieser vier Laugen wird hier wohl entstanden sein? Natürlich kommt nur die Natronlauge NaOH in Frage.
Auf dem YouTube-Video "Chemie Experiment 22 - Natrium und Wasser" wird der Versuch übrigens sehr schön dargestellt, angefangen vom sorgfältigen Schneiden des Natriumstücks bis zur eigentlichen Reaktion. Auch die Violettfärbung des Wassers ist gut zu sehen.
Herleitung der Reaktionsgleichung
Wir wollen nun die Reaktionsgleichung für die Umsetzung von Natrium mit Wasser erarbeiten. Zuerst stellen wir die einfache Wortgleichung auf. Das sollte eigentlich jeder schaffen, der den Versuch gut beobachtet hat. Was haben wir als Ausgangsstoffe eingesetzt? Wasser und Natrium. Was ist dabei herausgekommen? Wasserstoff als gasförmiges Reaktionsprodukt und Natronlauge. Natronlauge ist aber nichts anderes als die Verbindung Natriumhydroxid, die in Wasser gelöst wurde.
Wortgleichung:
$Natrium_{(s)} + Wasser_{(l)} \to Natriumhydroxid_{(aq)} + Wasserstoff_{(g)}$
Wir setzen diese Wortgleichung nun in eine Reaktionsungleichung um.
Reaktionsungleichung:
$Na_{(s)} + H_{2}O_{(l)} \to NaOH_{(aq)} + H_{2(g)}$
Schließlich entwickeln wir die korrekte Reaktionsgleichung. Auf der rechten Seite stehen drei H-Atome, auf der linken aber nur zwei. Also setzen wir zwei Wasser-Moleküle ein. Dann stehen auf der linken Seite aber zwei O-Atome, auf der rechten Seite aber nur eines. Also müssen wir auch NaOH verdoppeln. Nun aber fehlt auf der linken Seite wieder ein Na-Atom, daher müssen wir hier ebenfalls zwei Atome einsetzen.
Korrekte Reaktionsgleichung:
$2 Na_{(s)} + 2 H_{2}O_{(l)} \to 2 NaOH_{(aq)} + H_{2(g)}$
Das war's dann auch schon. Wer jetzt Schwierigkeiten hatte, die Herleitung der Reaktionsgleichung zu verstehen, geht bitte auf die Hilfeseite "Aufstellen einer Reaktionsgleichung". Hier wird das ganze Verfahren noch einmal ausführlich erläutert.
Für Experten
Warum flitzt das Natriumkügelchen auf der Wasseroberfläche hin- und her?
Bei der Reaktion mit Wasser entsteht gasförmiger Wasserstoff. Dieses Gas kann nicht vollständig nach oben entweichen, ein Teil verbleibt unter der Natriumkugel. Diese schwimmt sozusagen auf einem Wasserstoffkissen. Durch den Rückstoß, der sich bei der Gasentwicklung ergibt, flitzt die Kugel dann auf der Wasseroberfläche hin- und her.
Wieso bildet sich bei der Reaktion überhaupt eine Kugel?
Bei der exothermen Reaktion wird so viel Energie frei, dass das Natriumstück schmilzt - der Schmelzpunkt von Natrium beträgt ja auch nur 98 ºC, das ist für ein Metall sehr wenig. Flüssige Körper nehmen stets eine Form an, bei der ihre Oberfläche minimal ist - die Kugelform eben. Das kann man schön in Sciencefiction-Filmen sehen, wenn in der Schwerelosigkeit Wasser verschüttetet oder Blut verspritzt wird, die Flüssigkeit bildet dann auch kleine Kugeln, die eindrucksvoll durch das Bild schweben...
Reaktivität der Alkalimetalle
Das Element Lithium ist lange nicht so reaktiv wie Natrium (siehe auch YouTube-Video "Lithium reagiert mit Wasser"). Gibt man ein kleines Stück Lithium in einen Sieblöffel, kann man es in einer mit Wasser gefüllten Glaswanne unter die Öffnung eines mit Wasser gefüllten Reagenzglases halten. Der entstehende Wasserstoff steigt dann in das Reagenzglas auf und kann mit der Knallgasprobe nachgewiesen werden. Wenn man die entsprechenden Sicherheitsmaßnahmen einhält, kann man diesen Versuch sogar als Schülerversuch durchführen.
Wenn man ein kleines Stück Kalium in eine Schüssel mit Wasser gibt, so setzt sofort eine viel heftigere Reaktion ein als mit Natrium. Meistens kommt es sehr schnell zur Selbstentzündung (siehe "Kalium in Wasser (Zeitlupe)" auf YouTube).
Rubidium und Cäsium reagieren noch heftiger als Kalium mit Wasser; die Versuche dürfen in der Schule nicht durchgeführt werden. Bereits das Schneiden von Rubidium und Cäsium an der Luft ist nicht möglich, weil die Metalle sofort mit dem Luftsauerstoff heftig und unter Entzündung reagieren.
Wir sehen also: Die Reaktivität der Alkalimetalle nimmt innerhalb der Elementgruppe des Periodensystems von oben nach unten ständig zu. Wenn wir diese Zunahme der Reaktivität durch eine einfache Graphik darstellen wollen, könnte dabei folgendes herauskommen:
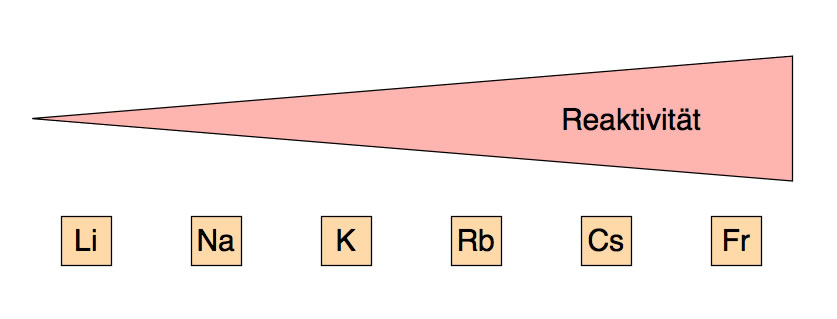
Reaktivität der Alkalimetalle
Die Reaktivität der Alkalimetalle nimmt innerhalb der Gruppe von oben nach unten zu. Lithium ist am wenigsten reaktiv, Francium am stärksten.
Bei der Besprechung des Atommodells von Dalton hatten wir gesagt, dass dieses Modell zwar viele chemische Phänomene gut erklären kann, andere aber nicht. Bei der Erklärung der zunehmenden Reaktivität der Alkalimetalle stoßen wir bereits an die Grenzen dieses Dalton-Modells. Nach Dalton kann man die Zunahme der Reaktivität der Alkalimetalle nämlich nicht erklären.
