Inhaltsübersicht
Struktur, Nomenklatur
Physikalische Eigenschaften
Chemische Reaktionen
Diene und Polyene
Struktur, Nomenklatur ⇑
Alkene sind im Grunde Alkane mit einer C=C-Doppelbindung.
Physikalisch wirkt sich diese Doppelbindung nicht sonderlich stark aus, die physikalischen Eigenschaften der Alkene ähneln denen der Alkane: niedrige Schmelztemperaturen und Siedetemperaturen, geringe Dichte, so gut wie keine Wasserlöslichkeit. Aus diesem Grund gibt es auf dieser Seite auch keinen eigenen Abschnitt über die physikalischen Eigenschaften der Alkene.
Die chemischen Eigenschaften dagegen ändern sich durch das Vorhandensein einer C=C-Doppelbindung sehr stark. Konnten Alkane nur oxidiert werden und Radikalische Substitutionen eingehen, können Alkene zusätzlich auch Elektrophile Additionen durchführen.
Ethen, Propen ↑
Ethen C2H4 ist das einfachste Glied der homologen Reihe der Alkene. In der Natur entsteht es zum Beispiel als Pflanzenhormon vor, das zur Fruchtreifung dient (Reifungsgas in der Landwirtschaft).
Propen C3H6 ist das zweite Glied der der homologen Reihe der Alkene.
In der Medizin haben Ethen und Propen keine besondere Bedeutung.
Buten ↑
Das dritte Glied der Alkene ist das Buten C4H8. Beim Buten tauchen zwei neue interessante chemisches Phänomene auf, nämlich die Stellungsisomerie und die cis-trans-Isomerie.
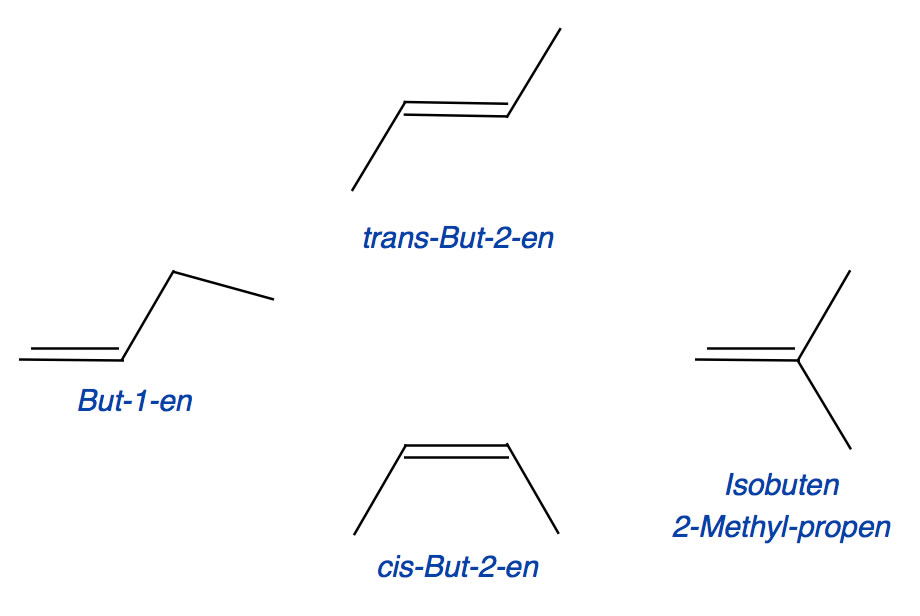
Die vier isomeren Butene, But-1-en, trans-But-2-en, cis-But-2-en und 2-Methyl-propen
Autor: Ulrich Helmich 2023, Lizenz: CC BY-NC-SA 4.0
Auf diesem Bild sehen wir vier verschiedene Isomere des Butens, und auf dem Bild kommen mehrere verschiedene Formen der Isomerie vor.
Konstitutions-Isomerie
Die drei Buten-Isomere But-1-en, cis-But-2-en und trans-But-2-en haben alle das gleiche Butan-Grundgerüst. Das Isomer 2-Methyl-propen hat dagegen ein Propan-Grundgerüst.
Stellungsisomerie
Die C=C-Doppelbindung des Butens kann zwischen dem 1. und dem 2. C-Atom liegen oder zwischen dem 2. und dem 3. C-Atom. Entsprechend benennt man diese Butene als But-1-en und But-2-en oder alternativ auch als 1-Buten und 2-Buten (das liest sich etwas besser, ist aber auch etwas ungenauer).
cis-trans-Isomerie
Es gibt zwei Formen des But-2-ens, die als cis-But-2-en und trans-But-2-en bezeichnet werden. Achten Sie darauf, dass die Präfixe cis und trans immer kursiv geschrieben werden.
Die cis-trans-Isomerie wirkt sich auch auf die physikalischen Eigenschaften der Verbindung aus. Das cis-Isomer hat ein größeres Dipolmoment als das trans-Isomer, daher ist zum Beispiel der Siedepunkt beim cis-Isomer mit 3,7 ºC etwas höher als beim trans-Isomer mit nur 0,9 ºC.
Für Experten: Der Schmelzpunkt ist beim trans-Isomer mit -105,5 ºC deutlich höher als beim cis-Isomer mit -138,9 ºC. Auf Grund des höheren Dipolmoments des cis-Isomers sollte man eigentlich das Gegenteil erwarten. Man vermutet hier, dass die Packungsdichte im festen trans-Buten-Kristall größer ist als im cis-Buten-Kristall, und das daher mehr Energie erforderlich ist, die Moleküle beim Schmelzen voneinander zu trennen.
Auf dieser Seite im Chemie-Lexikon wird nicht nur näher auf die cis-trans-Isomerie eingegangen, sondern auch auf die E/Z-Terminologie, die etwas genauer ist als die cis/trans-Terminologie.
Wie würden Sie beispielsweise ein 1-Brom-1,2-dichlor-buten bezeichnen, bei dem die beiden Chlor-Atome auf der gleichen Seite der Doppelbindung liegen? Mit der cis/trans-Terminologie kommen Sie damit nicht weit. Allerdings ist das Thema E/Z-Terminologie nicht prüfungsrelevant, jedenfalls nicht für Mediziner.
Nomenklatur ↑
Im Grund gelten für die Benennung der Alkene die gleichen Nomenklatur-Regeln wie bei den Alkanen. Allerdings ist die C=C-Doppelbindung eine funktionelle Gruppe und hat damit eine höhere Priorität als eine Alkyl-Seitenkette. Die Hauptkette ist also so zu wählen, dass die Doppelbindung in ihr vorkommt.

Ein verzweigtes Alken
Autor: Ulrich Helmich 2023, Lizenz: CC BY-NC-SA 4.0
Zunächst könnte man denken, dass die Hauptkette aus 15 C-Atomen besteht, so wie links unten gezeichnet. Diese Pentadecan-Kette hätte aber keine C=C-Doppelbindung.
Rechts sehen wir eine Tridecan-Seitenkette mit der Doppelbindung an Position 2, also handelt es sich um eine Tridec-2-en-Kette oder - besser zu lesen - um eine 2-Tridecen-Kette.
Der Name dieses Alkens wäre also 5-Hexyl-tridec-2-en bzw. 5-Hexyl-2-tridecen.
Physikalische Eigenschaften ⇑
Zu den physikalischen Eigenschaften der Alkene ist nicht viel zu sagen, sie ähneln denen der Alkane. Auch die Moleküle der Alkene sind sehr unpolar, sie werden nur von den sehr schwachen London-Kräften zusammengehalten, entsprechend niedrig sind die Schmelztemperaturen, die Siedetemperaturen und die Dichten. Auch die Wasserlöslichkeit der Alkene ist zu vernachlässigen, die Moleküle können keine H-Brücken zu Wasser-Molekülen bilden, und da sie keine Dipole sind, können sie auch keine H2O-Moleküle rein elektrisch anziehen.
Bei den Schmelzpunkten gibt es einen kleinen Unterschied zwischen den cis- und den trans-Isomeren eines Alkens. Weil sich die cis-Isomere im festen Zustand nicht so gut zusammenpacken lassen, haben sie niedrigere Schmelzpunkt als ihre trans-Isomere. Das cis-2-Buten hat einen Schmelzpunkt von -139 ºC, das trans-2-Buten einen Schmelzpunkt von -106 ºC.
Auch auf die Siedepunkte wirkt sich die cis-trans-Isomerie etwas aus, da die cis-Isomere ein etwas größeres Dipolmoment haben als die trans-Isomere.

cis-2-Buten ist ein Dipol
Autor: Ulrich Helmich 02/2023, Lizenz: siehe Seitenende
Beim trans-2-Buten heben sich die +I-Effekte der beiden Methylgruppen gegenseitig auf, während sie sich beim cis-2-Buten verstärken. Daher hat cis-2-Buten einen etwas höheren Siedepunkt als sein trans-Isomer.
Chemische Reaktionen ⇑
Oxidation
Genau wie die Alkane sind auch die Alkene Kohlenwasserstoffe und können leicht oxidiert werden. Die Reaktion verläuft ähnlich ab wie bei den Alkanen, daher müssen wir hier nicht näher darauf eingehen.
Radikalische Substitution ↑
Alkene sind Alkane mit einer C=C-Doppelbindung irgendwo in der C-Kette. Alkene können daher genau wie die Alkane eine Radikalische Substitution eingehen. Allerdings ist die SR nicht die "Hauptreaktion" der Alkene. Wenn man sich mit Alkenen beschäftigt, behandelt man normalerweise die "typische" Reaktion, nämlich die Elektrophile Addition sowie die etwas weniger bekannte Radikalische Addition. Die Elektrophile Addition müssten Sie eigentlich noch aus dem Schulunterricht kennen.
Elektrophile Addition ↑
1. Addition von HBr oder H2O
Beginnen wir mit den beiden einfachsten Reaktionen, nämlich der Addition von Bromwasserstoff und der Addition von Wasser an die C=C-Doppelbindung. Diese Reaktionen werden auch als Hydrobromierung und Hydratisierung bezeichnet.
Schritt 1
Bei beiden Reaktionen lagert sich zunächst ein Proton H+ an die C=C-Doppelbindung an. Dabei entsteht ein Carbenium-Ion als Zwischenprodukt.
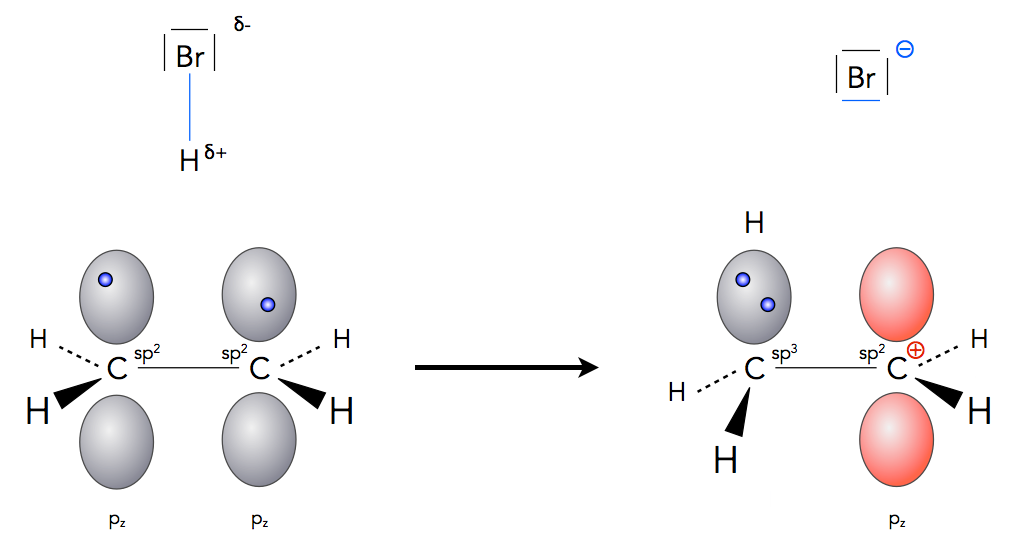
Die Bildung eines Carbenium-Ions bei der Hydrobromierung
Autor: Ulrich Helmich 2020, Lizenz: siehe Seitenende.
Hier sieht man den ganzen Vorgang mit Hilfe des Orbitalmodells dargestellt. Die beiden C-Atome der Doppelbindung sind sp2-hybridisiert, und die beiden pz-Orbitale enthalten je ein Elektron. Der Bromwasserstoff (oder das Wasser) gibt nun ein Proton ab, das sich in eines der beiden pz-Orbitale setzt. Dabei entsteht eine neu C-H-Bindung. Wenn Sie genau hinschauen, stellen Sie auch fest, dass dieses C-Atom nun einen Hybridisierungswechsel von sp2 nach sp3 durchgemacht hat. Die Bindungswinkel betragen jetzt nicht mehr 120º, sondern 109,5º.
Das Elektron für das neue Bindungselektronenpaar der C-H-Bindung stammt aus dem anderen pz-Orbital, das nun leer ist (daher rot gezeichnet). Das C-Atom mit dem leeren Orbital ist nun positiv geladen und bleibt dabei sp2-hybridisiert. Was wir hier sehen, ist ein typisches Carbenium-Ion.
Schritt 2
Der zweite Reaktionsschritt ist nun recht einfach. Das Carbenium-Ion ist positiv geladen und zieht nun alle Teilchen in der Umgebung an, die negativ geladen sind. Bei der Hydrobromierung sind das Bromid-Ionen, bei der Hydratisierung Wasser-Moleküle oder vorzugsweise Hydroxid-Ionen. Bei der Hydrobromierung bildet sich Bromethan als Endprodukt, bei der Hydratisierung Ethanol.
Achten Sie bei einer Prüfung darauf, dass Sie Bromethan nicht mit Brommethan verwechseln. An sich sind Bindestriche vor der Hauptkette nicht üblich, aber hier könnte es helfen, Brom-methan und Brom-ethan zu schreiben.
Wenn die Hydrobromierung in wässriger Lösung und nicht in der Gasphase durchgeführt wird, bildet sich als Nebenprodukt auf jeden Fall Ethanol, da ja neben den Bromid-Ionen auch noch jede Menge H2O-Moleküle und OH--Ionen in der Lösung schwimmen.
2. Addition von Wasserstoff ↑
Die Hydrierung von Alkenen, also die Reaktion mit Wasserstoff, ist eine wichtige Reaktion in der industriellen Chemie.
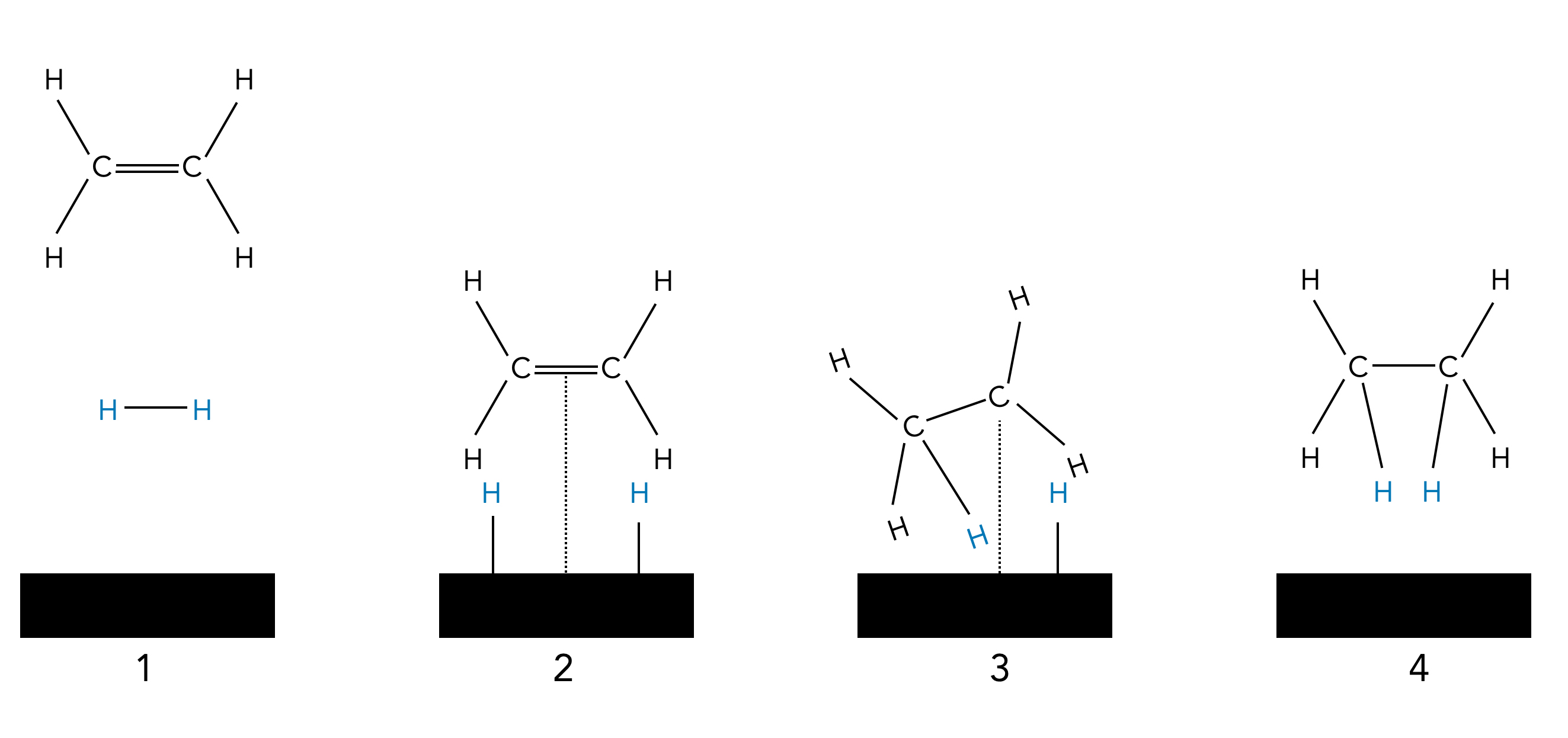
Hydrierung einer C=C Doppelbindung auf einer Katalysatoroberfläche
Autor: Ulrich Helmich 05/2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
Auf diesem Bild sehen wir, wieso die Addition von H2 stets eine cis-Addition ist. Beide H-Atome werden auf die gleiche Seite der C=C-Doppelbindung addiert. Das liegt daran, dass sich das H2-Molekül zunächst an die Oberfläche eines Metall-Katalysators wie Platin heftet. Dort holt sich das Ethen-Molekül dann erst das eine, dann das andere H-Atom ab.
3. Addition von Brom ↑
Die Bromierung von Alkenen wird im Schulunterricht meistens sehr ausführlich behandelt. Hier daher nur eine Kurzfassung.
Diese Seite wurde für Schüler(innen) der Qualifikationsphase (12/13) geschrieben. Die Addition von Brom an ein Alken wird hier sehr ausführlich beschrieben.
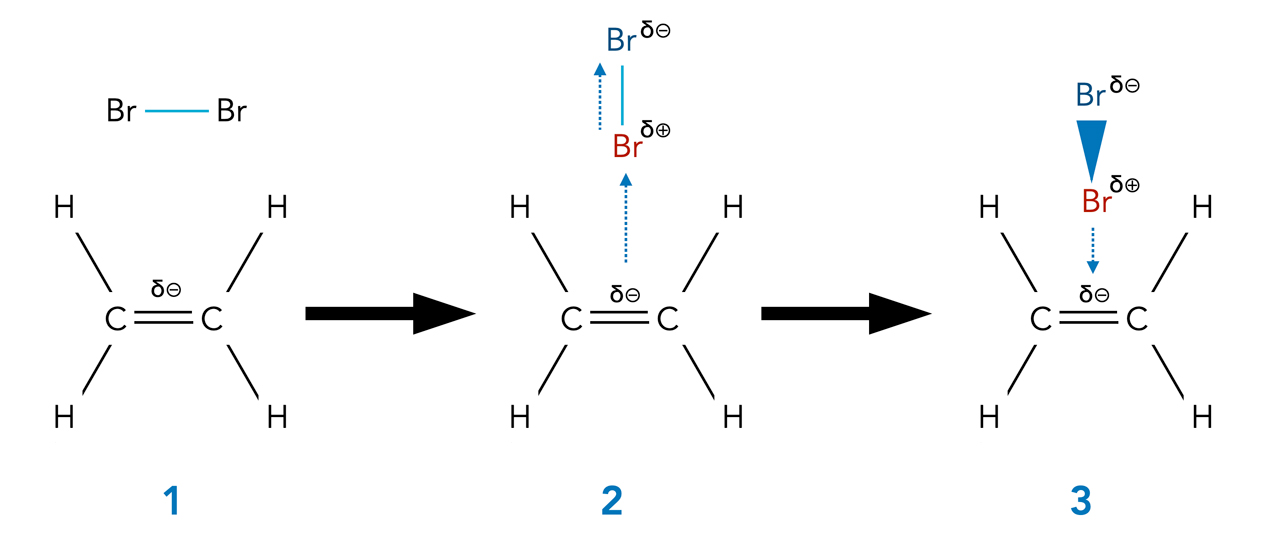
Die ersten Phasen der Br2-Addition an Ethen
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Die hohe Elektronendichte der C=C-Doppelbindung induziert einen temporären Dipol in dem völlig unpolaren Br2-Molekül. Das positive Ende dieses induzierten Dipol wird dann von der Doppelbindung angezogen.
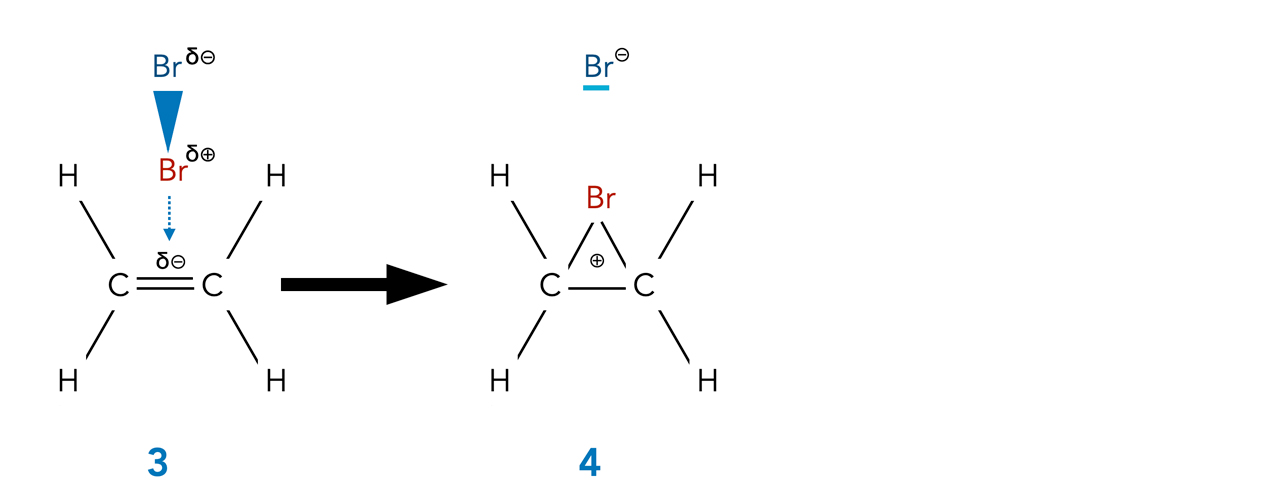
Die ersten Phasen der Br2-Addition an Ethen
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Zunächst bildet sich ein lockerer π-Komplex, bei dem die Elektronenwolken des einen Br-Atoms mit den Elektronenwolken der Doppelbindung Kontakt aufnehmen. Als Nächstes (4) wird das polare Br2-Molekül heterolytisch gespalten, es bilden sich ein Br-- und ein Br+-Ion. Das Br+-Ion bildet dann zwei kovalente Bindungen zu den beiden C-Atomen der Doppelbindung aus. Die positive Ladung ist über die drei Atome weitgehend delokalisiert, der Ladungsschwerpunkt befindet sich jedoch beim Br-Atom. Diesen σ-Komplex bezeichnet man auch als Bromonium-Ion.
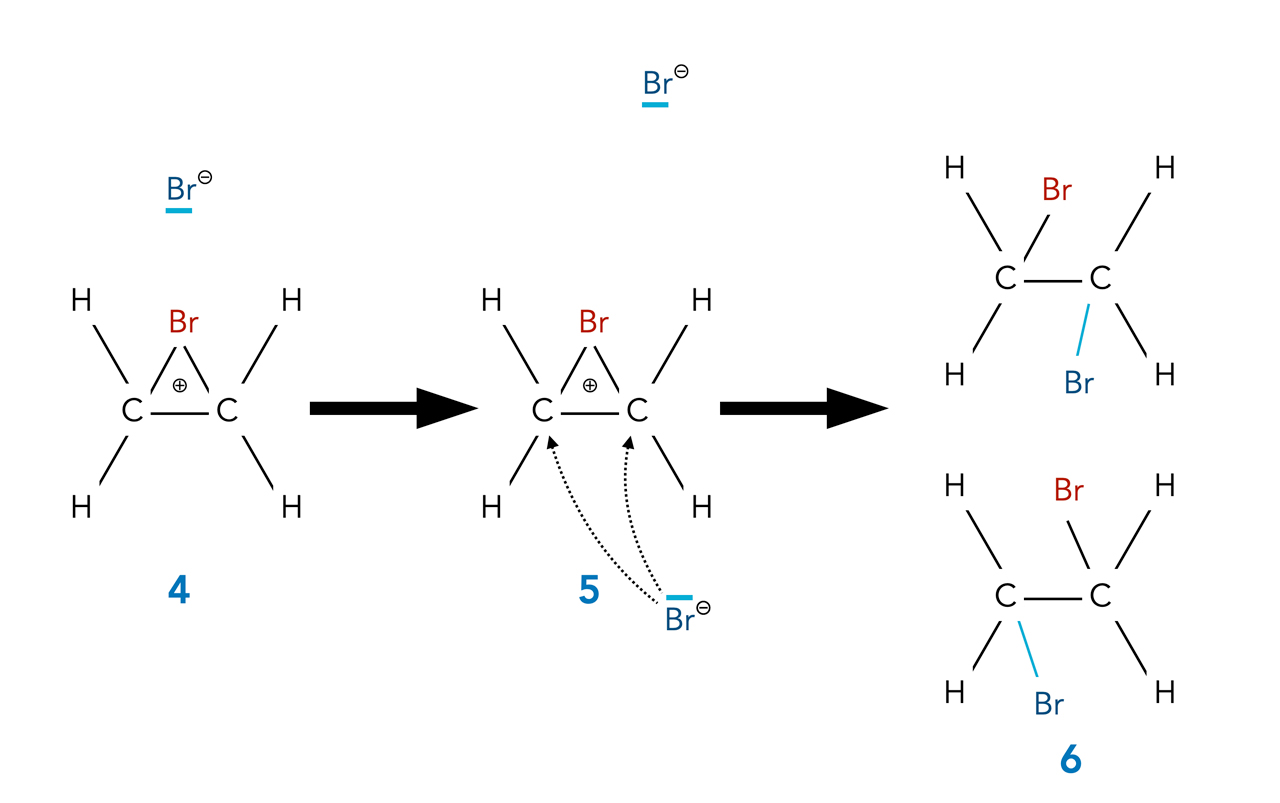
Die ersten Phasen der Br2-Addition an Ethen
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Das Bromid-Ion kann nun das Bromonium-Ion angreifen. Allerdings ist die eine Seite der ehemaligen Doppelbindung durch das gebundene Brom-Atom sterisch blockiert. Das Br--Anion kann nur von der Rückseite angreifen (Rückseiten-Angriff).
Einen Beweis für diesen Rückseiten-Angriff liefert ein Experiment, bei dem Cyclohexen bromiert wird.
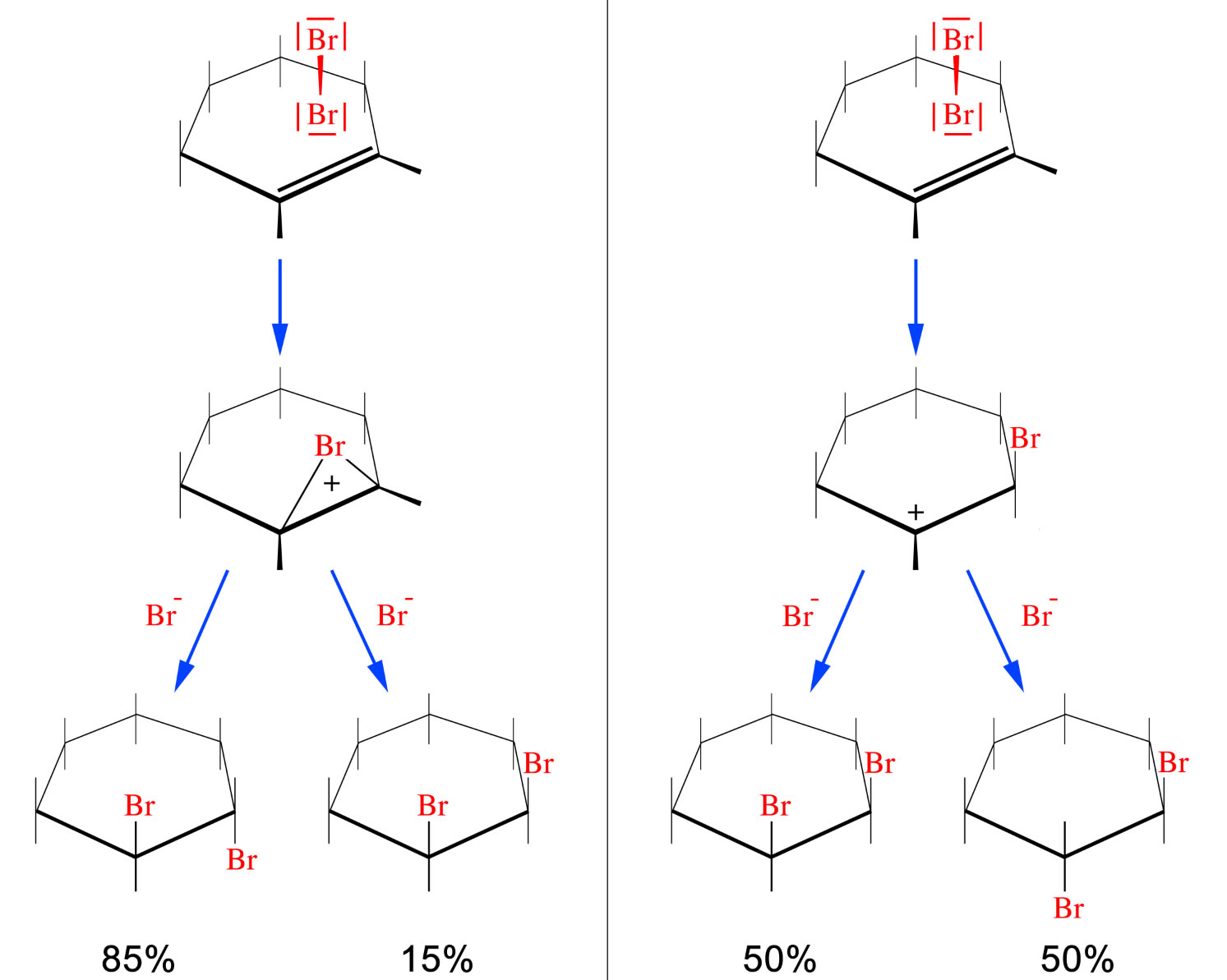
Zwei Alternativen der Cyclohexen-Bromierung
Autor: Ulrich Helmich 2020, Lizenz: siehe Seitenende.
Bei der Bromierung von Cyclohexen entsteht zu ca. 85% das trans-Produkt, während das cis-Produkt nur ca. 15% ausmacht. Würde die Bromierung ähnlich ablaufen wie die Hydrobromierung oder die Hydratisierung, also mit einem "richtigen" Carbenium-Ion als Zwischenstufe, so sollte man ungefähr 50% von jedem der beiden möglichen Produkte erwarten. Vielleicht etwas mehr von dem trans-Produkt, aber auf jeden Fall keine 85%.
Diese Seite richtet sich an Studierende des Faches Chemie, hier wird die Bromierung in allen Einzelheiten sehr ausführlich erklärt, auch auf die Frage, ob die Bildung von Carbenium-Ionen bei der Bromierung eine Rolle spielt, wird hier eingegangen.
Diene und Polyene ⇑
Konjugierte Doppelbindungen
Polyene sind Kohlenwasserstoffe mit zwei, drei, vier oder noch mehr C=C-Doppelbindungen. Für Polyene mit zwei Doppelbindungen hat sich auch die Bezeichnung Diene eingebürgert.
Besonders interessant sind Polyene mit konjugierten C=C-Doppelbindungen. Zwei C=C-Doppelbindungen sind konjugiert, wenn sie durch genau eine C-C-Einfachbindung getrennt werden und nicht durch zwei oder mehr. Das hat dann nämlich den Vorteil, dass die pz-Orbitale der beiden Doppelbindungen miteinander überlappen und ein großes Molekülorbital bilden, in dem sich alle vier pi-Elektronen frei bewegen können (delokalisierte Elektronen). Ein schönes Beispiel für ein Dien mit konjugierten Doppelbindungen ist das Buta-1,3-dien.
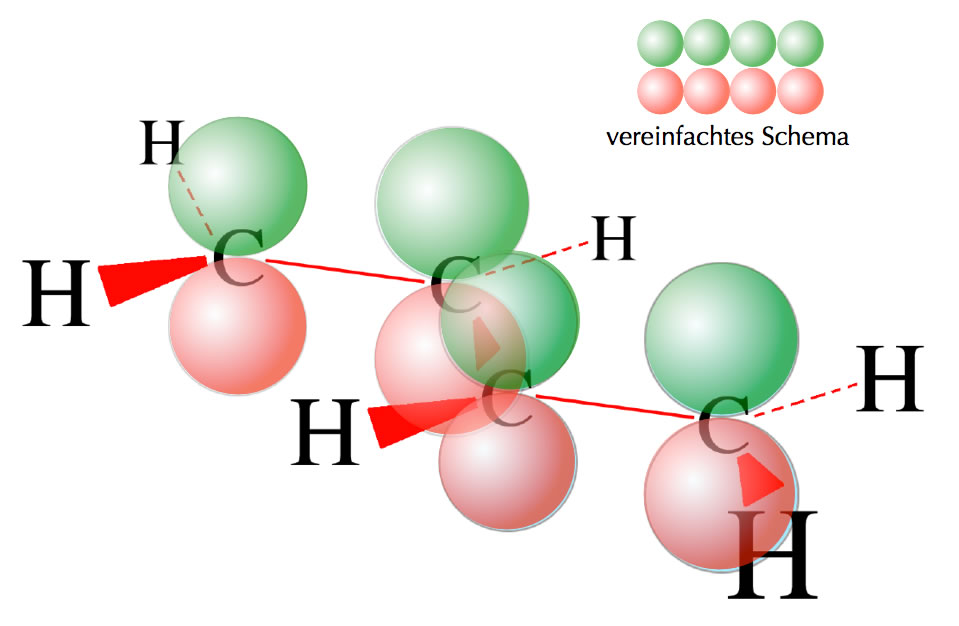
Das erste bindende MO des Butadiens
Autor: Ulrich Helmich 2018, Lizenz: CC BY-NC-SA 4.0
Hier sieht man die vier pz-Orbitale des Butadiens, alle vier Orbitale sind gleich ausgerichtet, so dass ein großes bindendes Molekülorbital entstehen kann.
Auf dieser Seite des Chemie-Lexikons werden die vier Molekülorbitale des Butadiens dargestellt und erklärt. Für Medizin-Studenten eher nicht prüfungsrelevant, aber sehr interessant!
Diese Seiten für Oberstufen-Schüler(innen) behandeln das Thema "Wieso sind viele Polyene farbig?". Auch hier wird auf die konjugierten Doppelbindungen und die Molekülorbitale der Verbindungen näher eingegangen.
1,2- und 1,4-Addition ↑
Beim Butadien begegnet uns ein interessantes chemisches Phänomen. Wenn man die Verbindung Buta-1,3-dien bromiert, erhält man zwei verschiedene Additionsprodukte, nämlich 3,4-Dibrom-but-1-en und 1,4-Dibrom-but-2-en.

Die 1,2- und die 1,4-Addition an Butadien
Autor: Ulrich Helmich 12/2023, Lizenz: siehe Seitenende
Isopren ↑
Isopren ist ein Baustein vieler biologisch wichtiger Moleküle und sollte daher hier kurz vorgestellt werden.

Isopren und Moleküle mit Isopren-Bausteinen
Autor: Ulrich Helmich 12/2023, Lizenz: siehe Seitenende
Das Isopren, eigentlich 2-Methyl-buta-1,3-dien, kann Polymere bilden. Ein Beispiel für ein biologisch (und medizinisch) wichtiges Polymer des Isoprens ist das beta-Carotin, der orangefarbene Farbstoff der Karotte (Möhre), der im menschlichen Körper in zwei Retinal-Moleküle gespalten wird und dann eine wichtige Rolle beim Sehprozess spielt.
Seitenanfang -
Weiter mit den Alkinen...