Addition von Br2 an Ethen
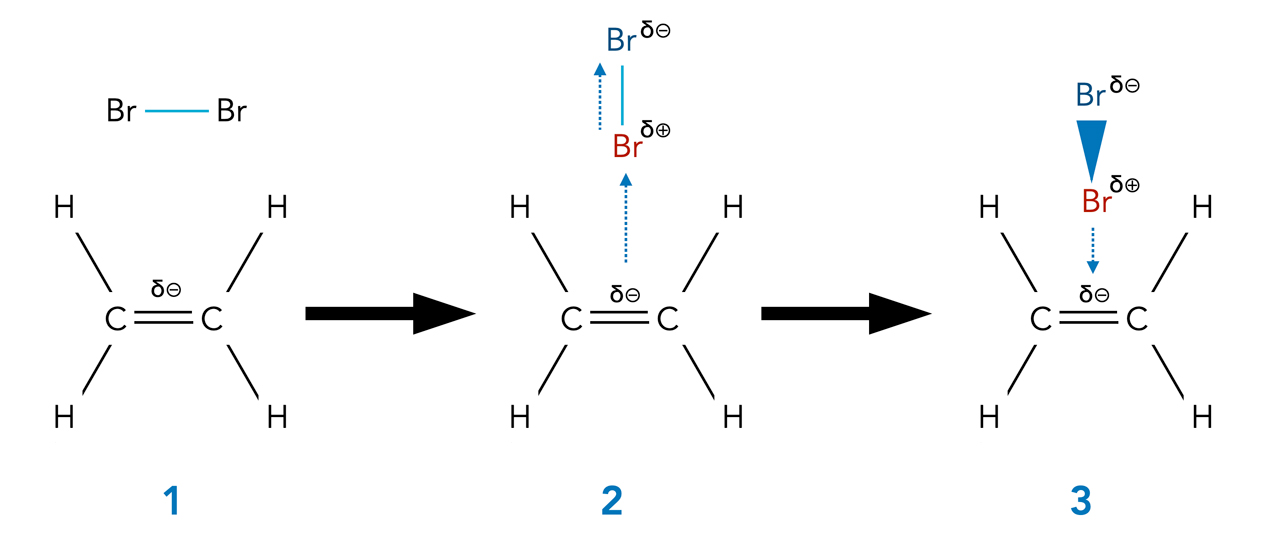
Die ersten Reaktionsschritte der Br2-Addition an Ethen
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Hier sehen wir die ersten Reaktionsschritte der Br2-Addition an Ethen. Bild 2 zeigt, wie die C=C-Doppelbindung einen temporären Dipol in dem Brom-Molekül induziert, und Bild 3 zeigt den pi-Komplex aus dem polarisierten Br2-Molekül und der C=C-Doppelbindung.
Schauen wir uns den nächsten wichtigen Reaktionsschritt näher an:
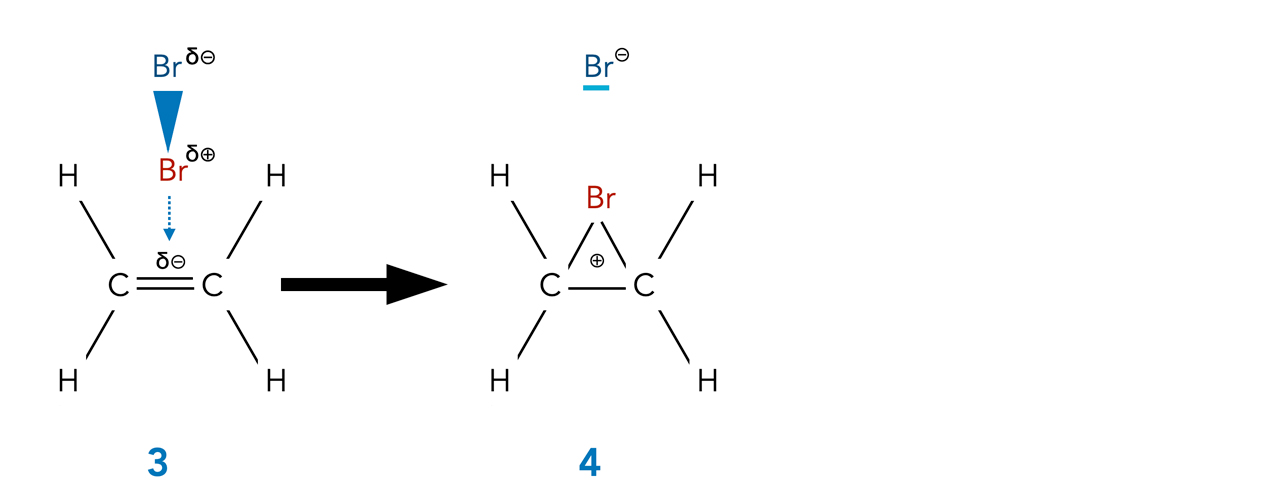
Bildung des Bromonium-Ions
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Hier sehen wir den Übergang vom pi-Komplex zum Bromonium-Ion.
Das positiv polarisierte Brom-Atom wird heterolytisch abgespalten, es hat nur sechs Elektronen, die sich auf vier Orbitale verteilen.
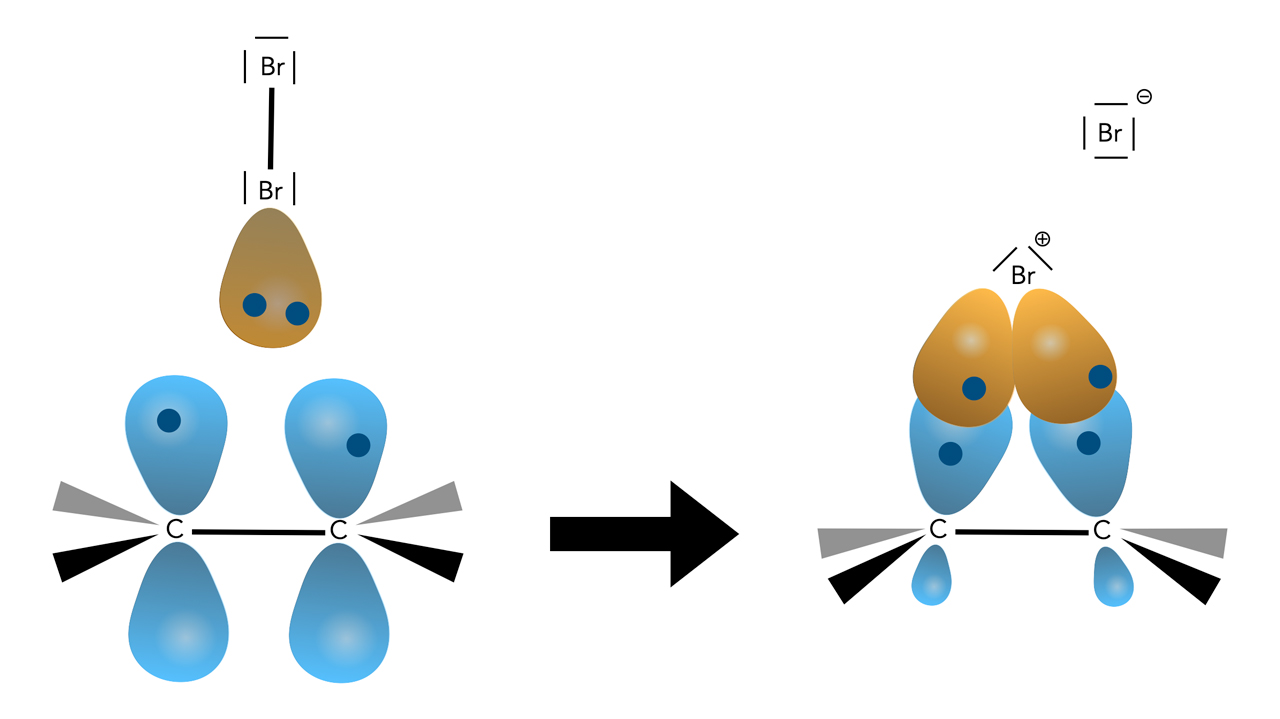
Bildung des Bromonium-Ions
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
Von den vier Orbitalen des Brom-Kations überlappen zwei einfach besetzte mit den beiden einfach besetzten p-Orbitalen der C-Atome. Die positive Ladung ist zunächst beim Brom-Kation, verteilt sich dann aber über den gesamten Dreierring C-Br-C, die Ladung ist also delokalisiert. Allerdings liegt der Schwerpunkt der positiven Ladung beim Brom (Chemgapedia), in vielen Büchern wird die positive Ladung direkt am Brom-Atom eingezeichnet, so wie in der Abbildung hier auch.
Die positive Ladung ist delokalisiert, man kann also nicht sagen, an welchem der drei Atome des Ringes sie sich aufhält, sie ist über alle drei Atome verteilt.
Info: In den meisten Büchern findet man die Information, dass sich die positive Ladung vor allem am Br-Atom aufhält. Für die Erklärung dieser Tatsache muss man aber ziemlich tief in die Molekülorbital-Theorie einsteigen, was wir hier aber nicht machen wollen.
Beweise für die Existenz von Bromonium-Ionen
Wenn man Cyclohexen bromiert, können theoretisch zwei verschiedene Reaktionsprodukte entstehen:
- Durch syn-Addition das cis-1,2-Dibrom-Cyclohexan,
- durch anti-Addition das trans-1,2-Dibrom-Cyclohexan.
Das Produktverhältnis ist recht interessant: Es bildet sich zu ca. 83% das trans-Bromierungsprodukt [2, S. 608]. Diese Tatsache lässt sich gut mit einem Rückseitenangriff des Bromid-Ions erklären. Die Addition von Brom an Cyclohexen ist also vorwiegend eine anti-Addition.
Wer sorgt nun dafür, dass ein solcher Rückseitenangriff stattfindet? Betrachten wir dazu folgende Abbildung, welche zwei Alternativen für das kationische Zwischenprodukt aufzeigt:
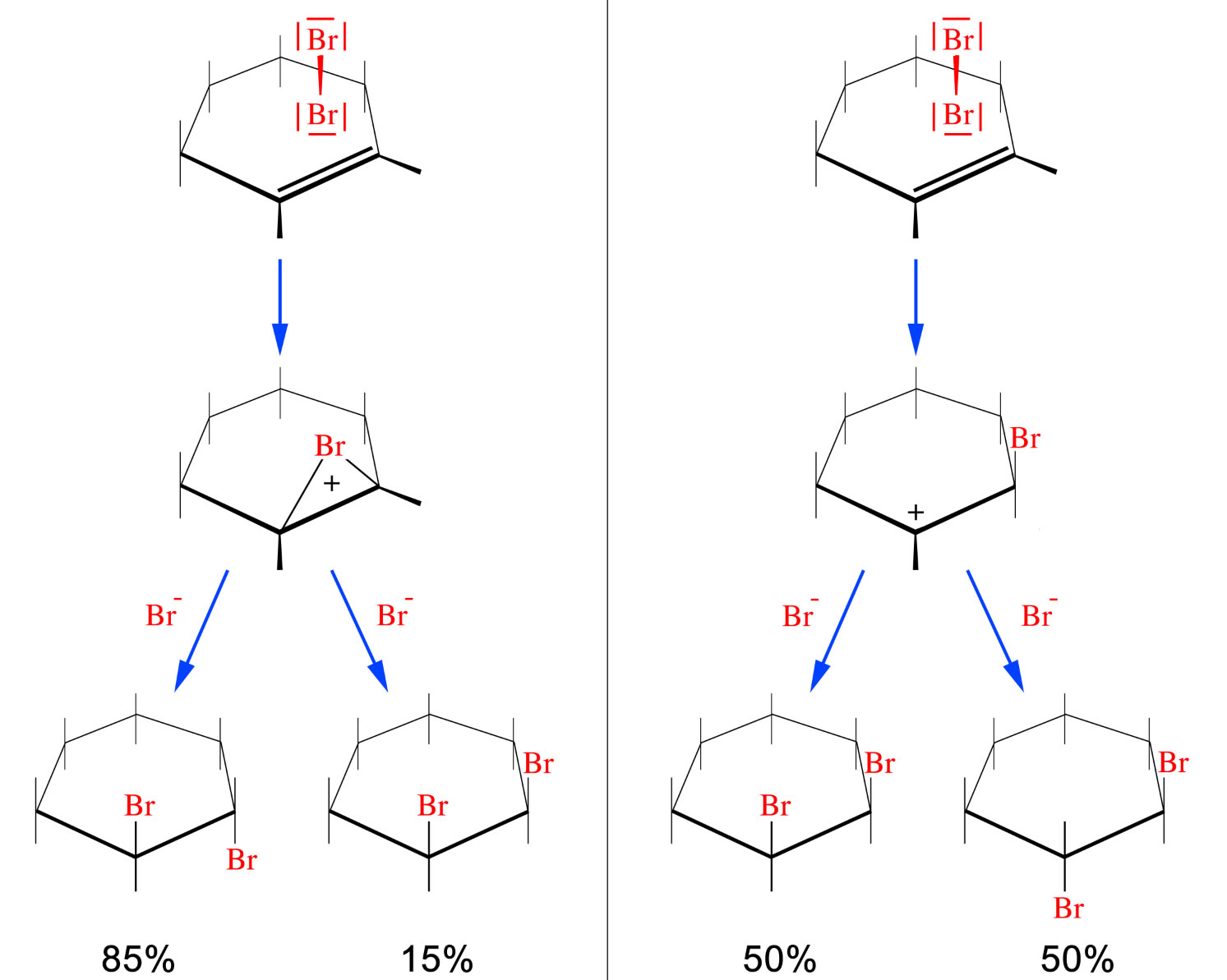
Zwei Alternativen der Cyclohexen-Bromierung
Autor: Ulrich Helmich 2020, Lizenz: siehe Seitenende.
| Links sehen wir den Weg über das Bromonium-Ion. Das große Brom-Atom mit seinen ausladenden freien Elektronenpaaren behindert den Angriff des Nucleophils Br- von der "Vorderseite" (im Bild also von oben). Daher entsteht hauptsächlich das trans-1,2-Dibromcyclohexan. |
Rechts sehen wir einen Reaktionsweg ähnlich wie bei der Hydrobromierung. Zunächst greift ein Brom-Kation die Doppelbindung an, dabei bildet sich ein Carbenium-Ion. |
Bei der Bromierung von Cyclohexen entsteht ein Racemat
Bei der Bildung von trans-Dibromcyclohexan entsteht ein 50:50-Gemisch aus zwei Spiegelbild-Isomeren (Enantiomere) [2, S. 608]. Ein solches Gemisch mit gleichen Anteilen von zwei Enantiomeren wird auch als Racemat bezeichnet. Wenn man die beiden Enantiomere als Modell baut, erkennt man, dass es tatsächlich zwei Formen des trans-Dibromcyclohexans gibt:

Zwei Formen des trans-Dibromcyclohexans
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Wir drehen nun das rechte Modell so, dass sich das nach oben zeigende Br-Atom links befindet, also genau so wie in dem linken Modell:

Drehen der rechten Form bringt keinen Erfolg
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
So erkennt man, dass es sich tatsächlich um zwei verschiedene spiegelbildliche Strukturen handelt, die nicht durch einfaches Drehen ineinander überführt werden können.
Gleichgewicht zwischen Bromonium-Ion und Carbenium-Ion
Laut [8] stehen das Bromonium-Ion und das Carbenium-Ion in einem chemischen Gleichgewicht.
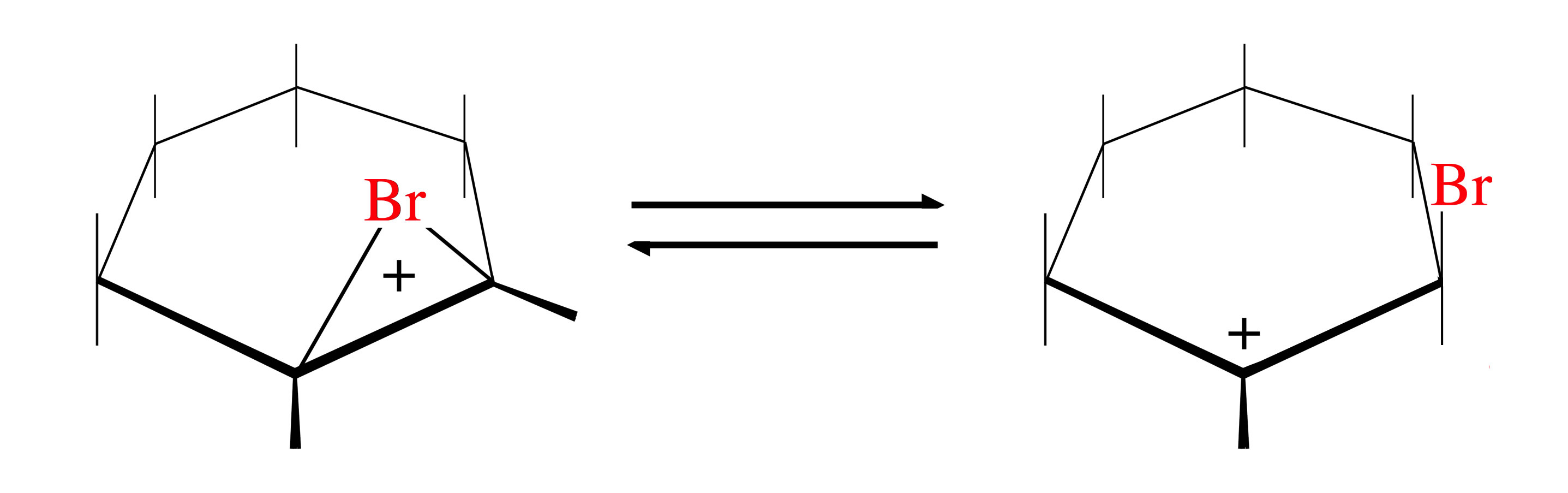
Gleichgewicht zwischen Bromonium-Ion und Carbenium-Ion
Autor: Ulrich Helmich 2020, Lizenz: siehe Seitenende.
Dies würde erklären, warum ein gewisser Anteil an cis-Produkt bei der Bromierung auftritt. Das Gleichgewicht würde dann mehr auf der Seite des Bromonium-Ions liegen und als Hauptprodukt das trans-1,2-Dibromcyclohexan liefern. Das cis-Produkt würde dann auf das Carbenium-Ion zurückgeführt werden können, das ja zu 50% trans- und zu 50% cis-Produkt liefert (theoretisch!).
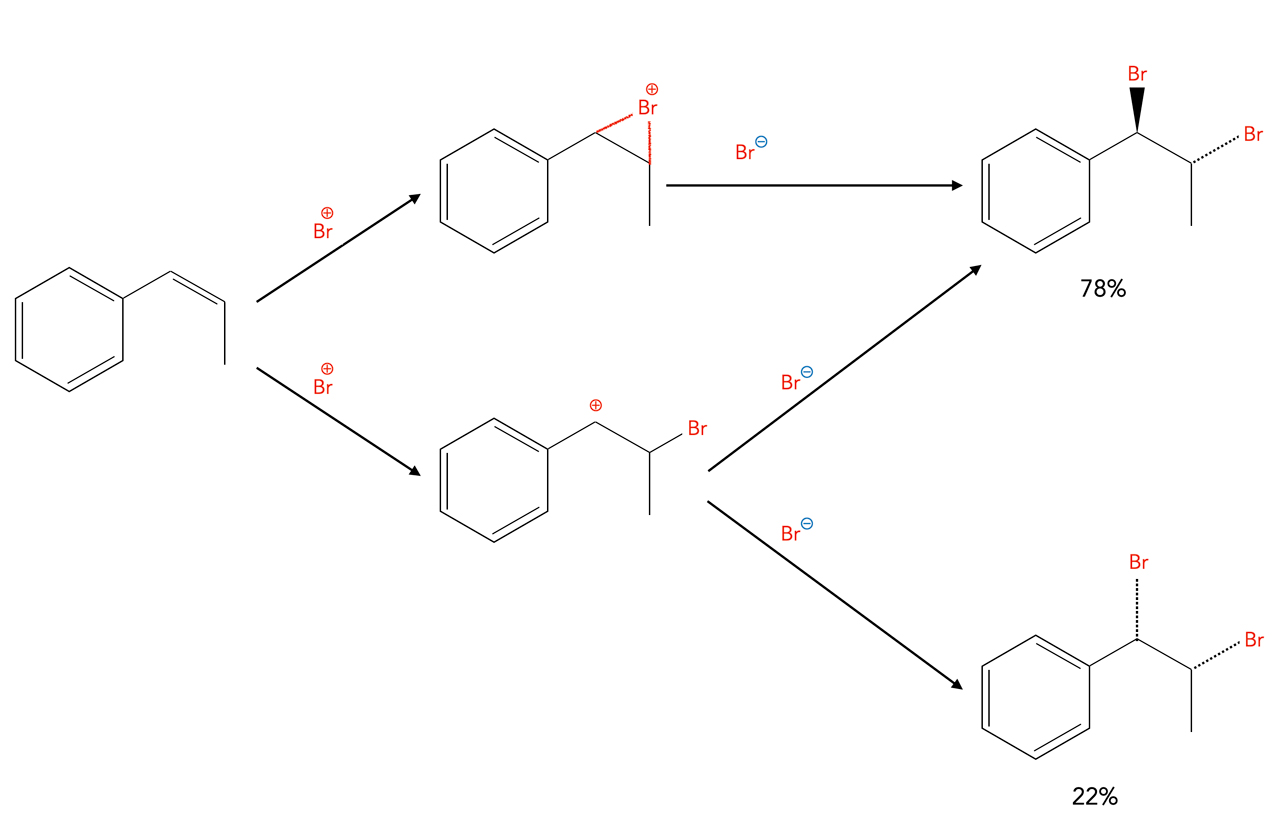
Interessant ist die Bromierung von β-Methylstyrol [9].
Bei dieser Reaktion entstehen durch die Anlagerung des Brom-Kations sowohl Bromonium-Ionen wie auch Carbenium-Ionen.
Bei der erstgenannten Reaktion entsteht ausschließlich das trans-Produkt (anti-Addition durch Rückseiten-Angriff des Bromid-Anions), bei der zweitgenannten Reaktion entsteht ein Racemat aus ca. 50% trans- und 50% cis-Produkt, denn das Bromid-Anion kann hier das Carbenium-Ion von beiden Seiten nahezu gleich gut angreifen (anti- und syn-Addition).
Theoretisch müssten eigentlich 75% trans- und 25% cis-Produkt entstehen, offensichtlich ist bei der Reaktion des Carbenium-Ions der Angriff von einer der beiden Seiten sterisch leicht behindert.
Quellen und weiterführende Bücher und Artikel, die über allgemeines Schulbuchwissen hinausgehen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
- Dyker-Vorlesung "Organische Chemie 1", Folge 32 (auf Tib AV - Portal verfügbar).
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.