Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- was man generell unter einer elektrophilen Addition versteht,
- wie die Addition von HBr an Ethen in Einzelschritten abläuft,
- wie die Addition von Br2 an Ethen in Einzelschritten abläuft.

Elektrophile (und radikalische) Addition
In diesem Video von Ramona Reinhart werden die Mechanismen der beiden Additionsreaktionen anschaulich erklärt.
Grundlegendes
Die C=C-Doppelbindung besteht aus zwei kovalenten Bindungen, enthält also insgesamt vier Bindungselektronen.
Weil die C=C-Doppelbindung nun eine recht hohe Elektronendichte besitzt (vier Bindungselektronen), zieht sie Elektrophile an, also "Elektronen liebende Teilchen".
Das sind vor allem positive Ionen und Moleküle mit einem positiven Pol (zum Beispiel H2O, NH3 , C2H5-OH oder HBr). Solche elektrophilen Teilchen werden von der C=C-Doppelbindung angezogen.
Für Experten:
Die beiden kovalenten Bindungen der C=C-Doppelbindung sind nicht gleich stark. Die sogenannte sigma-Bindung (σ-Bindung) ist eine ganz normale kovalente Bindung, wie sie beispielsweise auch im Ethan-Molekül zwischen den beiden C-Atomen herrscht.
Etwas ganz anderes ist die sogenannte pi-Bindung(π-Bindung). Die beiden C-Atome der C=C-Doppelbindung sind sp2-hybridisiert, und die pz-Orbitale ragen nach oben und unten aus der Bindungsebene heraus. Die beiden pz-Orbitale der benachbarten C-Atome überlappen sich schwach und bilden dann die π-Bindung. Die pi-Bindung ist dadurch wesentlich schwächer als die σ-Bindung, und die π-Bindung ist es, die für die elektrophile Addition verantwortlich ist.
Auf dieser Seite aus der Reihe "Studienvorbereitung Organische Chemie" wird die C=C-Doppelbindung mit Hilfe des Orbitalmodells genauer beschrieben.
Ein schönes und einprägsames Beispiel für eine elektrophile Addition ist die Anlagerung von Bromwasserstoff HBr an Ethen. Schon etwas komplexer ist die Addition von Brom Br2 an Ethen, die als unser zweites Beispiel für eine elektrophile Addition dient.
Addition von HBr an Ethen
Im folgenden Bild sehen wir den ersten Reaktionsschritt der Hydrobromierung von Ethen. Hydrobromierung nennt man die Addition von Bromwasserstoff HBr.
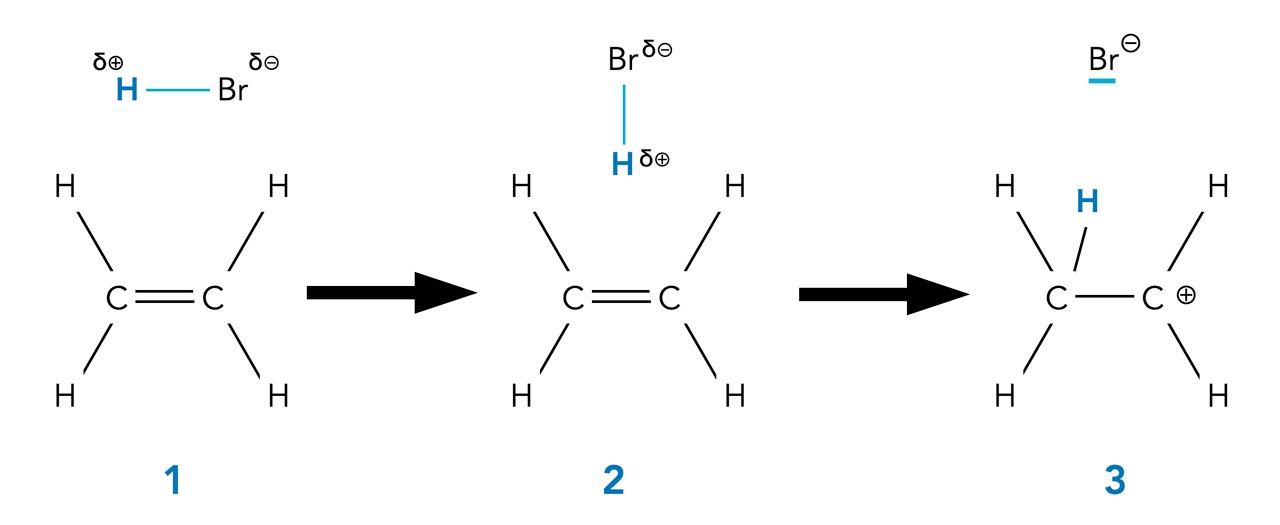
Der erste Reaktionsschritt der Hydrobromierung von Ethen
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Aufgabe 1
Erläutern Sie die Stadien 1, 2 und 3 des ersten Reaktionsschritts der Hydrobromierung von Ethen unter Verwendung der Fachbegriffe* polare Bindung, Elektronegativität, Elektrophil, heterolytisch und Carbenium-Ion.
*Bei Klausur- oder Abituraufgaben werden Ihnen die zu verwendenden Fachbegriffe natürlich nicht vorgegeben.
Wir wollen diese Aufgabe gemeinsam lösen.
- Ein Bromwasserstoff-Molekül HBr nähert sich einem Ethen-Molekül. Die H-Br-Bindung ist aufgrund der unterschiedlichen Elektronegativitäten von Brom und Wasserstoff eine polare Bindung, wobei der Wasserstoff den positiven Pol des Moleküls bildet und Brom den negativen Pol. HBr ist also mit seinem positiv polarisierten H-Atom ein klassisches Elektrophil.
- Der HBr-Dipol wird mit dem positiv polarisierten H-Atom voran von der elektronenreichen C=C-Doppelbindung angezogen.
- Das HBr-Molekül wird heterolytisch gespalten, nämlich in ein Bromid-Ion und ein Proton. Das Proton setzt sich an eines der beiden C-Atome der Doppelbindung. Die positive Ladung wird dann von dem anderen C-Atom übernommen, wobei ein sogenanntes Carbenium-Ion (mit positiv geladenem C-Atom) entsteht.
Aufgabe 2
Begründen sie, welches der zweite Schritt dieser Hydrobromierung sein könnte.
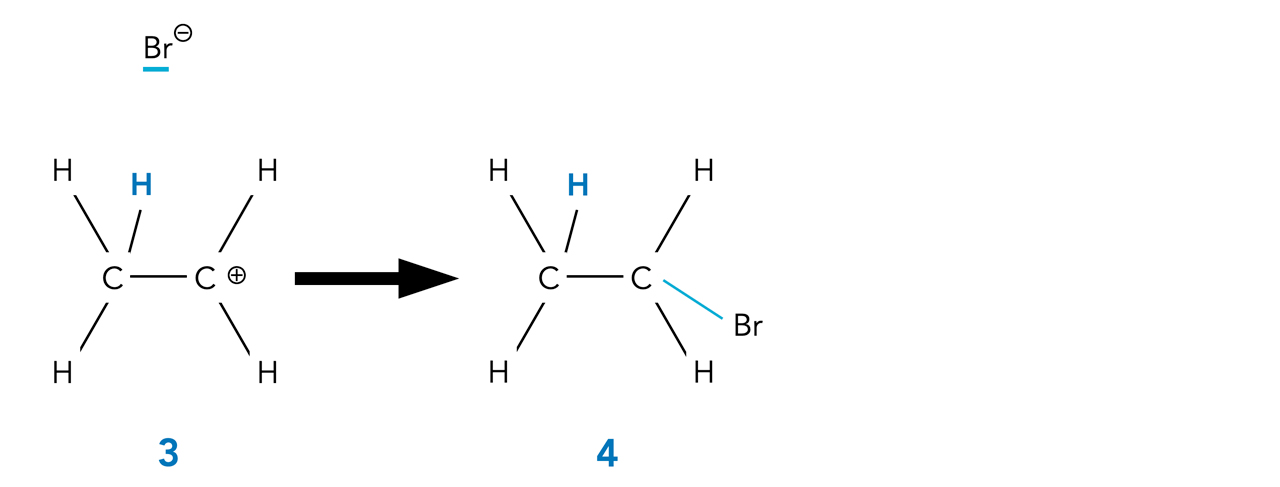
Der zweite Reaktionsschritt der elektrophilen Addition
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das nach der heterolytischen HBr-Spaltung "übrig" gebliebene Bromid-Ion setzt sich nun als Nucleophil an das Carbenium-Ion, es entsteht das Endprodukt Brom-ethan.
Auf dieser Spezialseite für die Q1/Q2 finden Sie eine ausführlichere Darstellung dieser Reaktion. Kenntnisse des Orbitalmodells wären dabei hilfreich.
Diese Spezialseite habe ich für Schüler(innen) geschrieben, die vorhaben, Chemie oder eine verwandte Naturwissenschaft zu studieren. Aber auch Erst- und Zweitsemester könnten von dieser Seite profitieren, die ich für die Abteilung "Studienvorbereitung Organische Chemie" geschrieben habe.
Addition von Br2 an Ethen
Ein weiteres bekanntes Beispiel für eine elektrophile Addition ist die Addition von Brom an Ethen:
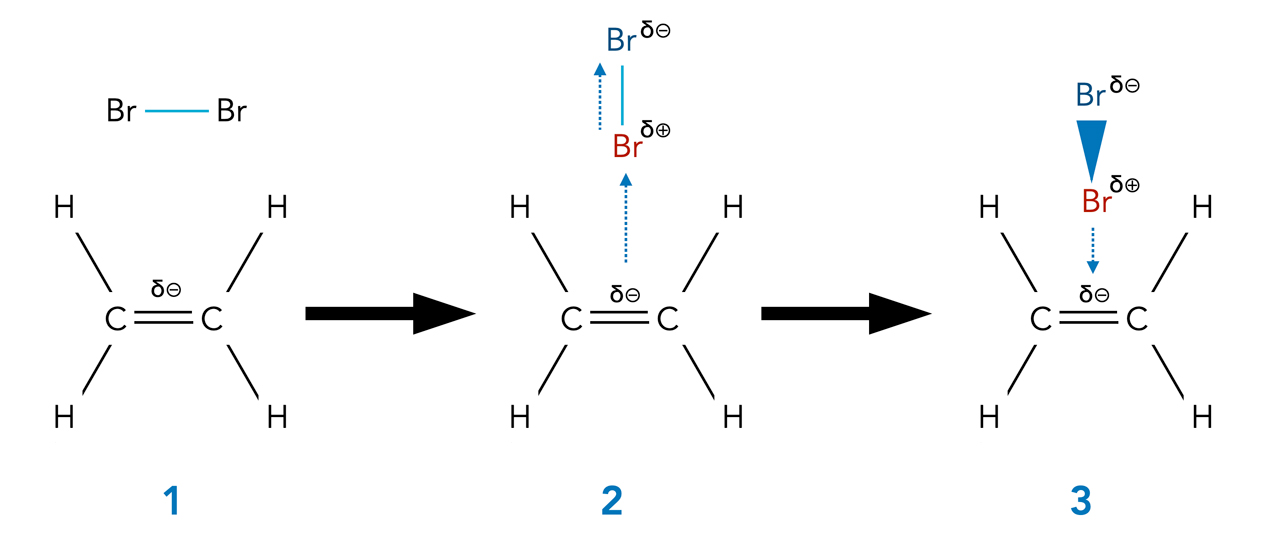
Die ersten Phasen der Br2-Addition an Ethen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Aufgabe 3
Beschreiben Sie die beiden in der Abbildung gezeigten Phasen der Brom-Addition an ein Ethen-Molekül.
- Ein Brom-Molekül gelangt zufällig in die Nähe der elektronenreichen Doppelbindung.
- Die hohe Elektronendichte der C=C-Doppelbindung induziert in dem Brom-Molekül einen temporären Dipol (die Bindungselektronen werden in Richtung auf das von der Doppelbindung abgewandte Brom-Atom verschoben).
- Die elektronenreichen Doppelbindung zieht den induzierten Br2-Dipol an.
Schauen wir uns den nächsten wichtigen Reaktionsschritt näher an:
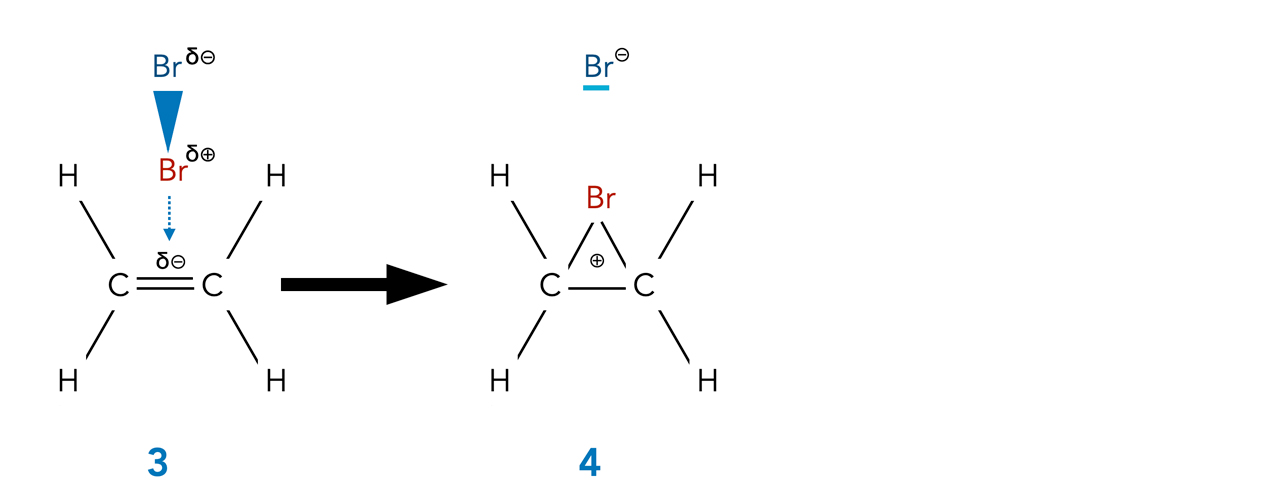
Bildung des Bromonium-Ions
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Aufgabe 4
Beschreiben Sie diesen Reaktionsschritt!
- Das Brom-Molekül wird heterolytisch gespalten, das Bromid-Ion bleibt im Lösemittel, das Brom-Kation wird von den beiden C-Atomen kovalent gebunden, die positive Ladung ist über den Ring aus drei Atomen verteilt.
Das auf diese Weise entstandene organische Kation wird als Bromonium-Ion bezeichnet. Die positive Ladung ist delokalisiert, man kann also nicht sagen, an welchem der drei Atome des Ringes sie sich aufhält, sie ist über alle drei Atome verteilt, befindet sich schwerpunktmäßig aber am Brom-Atom*.
*In den meisten Büchern findet man die Information, dass sich die positive Ladung vor allem am Br-Atom aufhält. Für die Erklärung dieser Tatsache muss man aber ziemlich tief in die Molekülorbital-Theorie einsteigen, was wir hier aber nicht machen wollen.
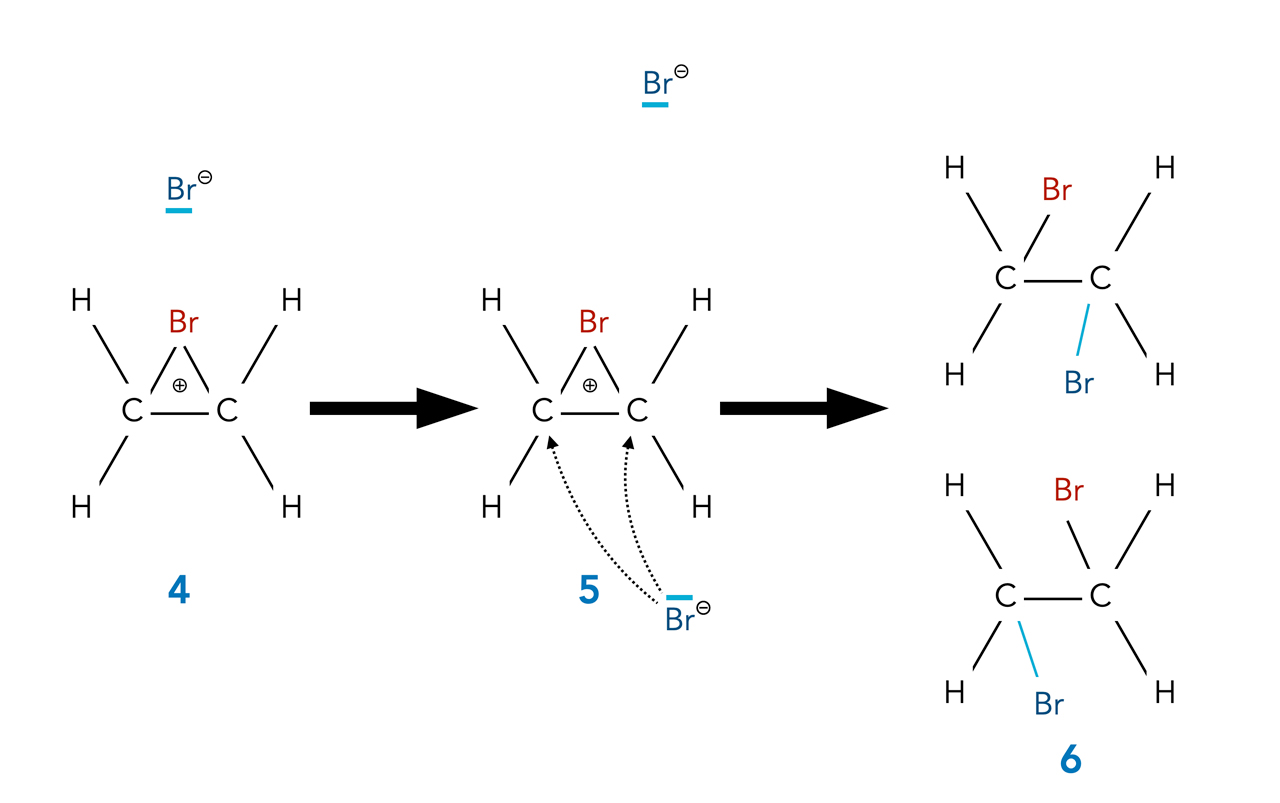
Beschreibung
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Aufgabe 5
Beschreiben Sie diese Reaktionsphasen!
- Der C-Br-C-Ring mit der delokalisierten positiven Ladung ist ein Angriffsziel von nucleophilen Teilchen wie zum Beispiel Bromid-Ionen. Ein Bromid-Ion nähert sich dem Bromonium-Ion nun von der Rückseite (Rückseitenangriff) und
- bildet mit einem der beiden gleichwertigen C-Atome eine kovalente C-Br-Bindung aus.
Beim Ethen-Molekül spielt es keine Rolle, welches der beiden C-Atome bei dem Rückseitenangriff eine Bindung mit dem Brom-Atom bildet. Beide C-Atome sind absolut gleichwertig. Bei nicht so symmetrisch aufgebauten Alkenen wirkt aber die so genannte Markownikoff-Regel, die besagt, dass sich bei solchen Reaktionen stets das stabilste Carbenium-Ion bildet. Aber dazu kommen wir erst später.
Zu diesem Thema gibt es auch eine Präsentation "Bromierung", die Sie kostenlos hier herunter laden können. Wenn Sie wollen, können Sie sich ja mit einer kleinen Spende bei mir revanchieren.
Und auf dieser Seite habe ich den Mechanismus der Br-Br-Addition detailliert erläutert.
Quellen und weiterführende Bücher und Artikel, die über allgemeines Schulbuchwissen hinausgehen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.