6.1 Rekapitulation Schulwissen
6.1.1 Eliminierung
Im Schulunterricht wurde Ihnen vielleicht schon einmal der Versuch gezeigt, in dem man aus Ethanol Ethen herstellt und das gasförmige Reaktionsprodukt mit Bromwasser nachweist. Damit hat man Ihnen eine grundlegende Reaktion der Alkohole präsentiert, die Dehydratisierung, eine Eliminierung, bei der die OH-Gruppe und ein H-Atom als Wasser-Molekül abgegeben werden.
6.1.2 Nucleophile Substitution
Im Rahmen des Themas Nucleophile Substitution haben Sie bestimmt gelernt, dass man die OH-Gruppe eines Alkohols leicht abspalten und durch ein Halogen-Atom oder ein anderes Nucleophil ersetzen kann. Meistens verläuft die Reaktion nach einem säurekatalysierten SN1-Mechanismus, bei dem die OH-Gruppe zunächst protoniert und dann als Wasser-Molekül abgespalten wird. In einem zweiten Schritt lagert sich dann ein Nucleophil an das Carbenium-Ion an, das durch die H2O-Abspaltung entstanden ist.
6.1.3 Oxidation
Und Sie haben wahrscheinlich einen Schülerversuch durchgeführt, bei dem Sie ausgeglühtes Kupferblech in einen primären, einen sekundären und einen tertiären Alkohol gehalten haben. Nur im primären und im sekundären Alkohol wurde das schwarze Kupferblech wieder blank, im tertiären Alkohol zeigte sich dagegen keine Reaktion. Anschließend haben Sie dann über die Oxidation von Alkoholen gesprochen und gelernt, dass aus primären Alkoholen Aldehyde werden, aus sekundären Ketone und aus tertiären - gar nichts, denn die können nicht auf diese Weise oxidiert werden.
6.1.4 Veresterung
Eine weitere Reaktion der Alkohole haben Sie bestimmt auch schon kennen gelernt, nämlich die Bildung von Carbonsäure-Estern. Normalerweise lässt man im Unterricht verschiedene Alkohole mit unterschiedlichen Carbonsäuren reagieren, und die Schüler(innen) stellen dann fest, dass dabei sehr interessante Gerüche nach Klebstoff, Ananas, Erdbeeren etc. auftreten.
6.2 Studienvorbereitung
6.2.1 Eliminierung
Das Thema "Eliminierung" hatten wir bereits bei der Besprechung der Halogenalkane ausführlich behandelt, daher wollen wir uns auf dieser Seite recht kurz fassen.
Lesen Sie die Einzelheiten auf dieser Seite im Abschnitt "Halogenalkane" nach.
Schauen wir uns mal eine typische Dehydratisierung an:
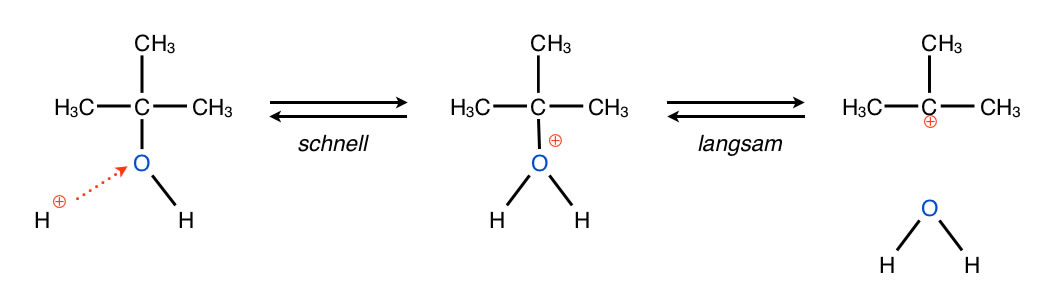
Bildung eines Carbenium-Ions
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Die Dehydratisierung erfolgt säurekatalysiert. Die OH-Gruppe ist eine schlechte Abgangsgruppe, durch Protonierung wird sie aber zu einer sehr guten Abgangsgruppe. Die protonierte OH-Gruppe wird dann als Wasser-Molekül abgegeben, zurück bleibt ein Carbenium-Ion.
In einem zweiten Reaktionsschritt wird dann ein Proton abstrahiert, und es bildet sich ein Alken. Alternativ kann natürlich auch ein negativ geladenes Nucleophil angelagert werden, und es bildet sich dann in einer SN1-Reaktion ein (unerwünschtes) Nebenprodukt.
6.2.2 Nucleophile Substitution
Wir haben es eben schon erwähnt: Bei der Abspaltung der protonierten OH-Gruppe entsteht ein Carbenium-Ion, das im nächsten Schritt ein Nucleophil anlagern kann. Im Schulunterricht haben Sie dazu vielleicht den Versuch mit Ethanol und Kaliumbromid gesehen. Dabei bildet sich Bromethan, das leicht aus dem Reaktionsgemisch abdestilliert werden kann. Hierbei handelt es sich um eine säurekatalysierte SN1-Reaktion.
Auch diesen Reaktionstyp haben wir bereits bei der Behandlung der Halogenalkane ausführlich kennen gelernt.
6.2.3 Oxidation
Aus dem Schulunterricht wissen Sie, dass man aus primären Alkoholen Aldehyde, aus sekundären Alkoholen Ketone herstellen kann. Auch tertiäre Alkohole können oxidiert werden, allerdings entsteht dabei kein organisches Produkt, sondern der Alkohol wird komplett oxidiert, und zwar zu Kohlendioxid und Wasser.
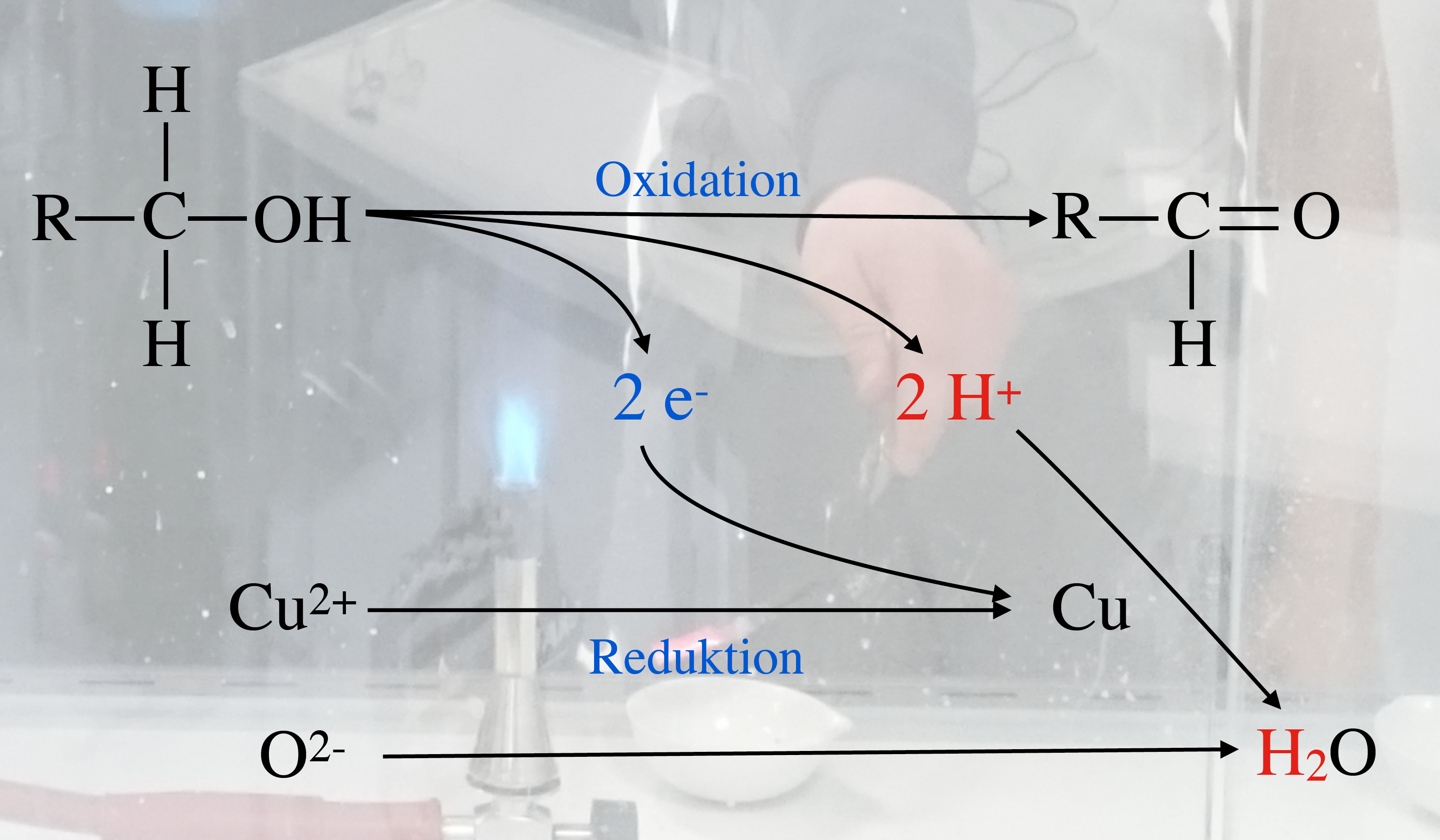
Oxidation eines primären Alkohols mit CuO
Autor: Ulrich Helmich 2018, Lizenz: Public domain
Hier sehen wir das typische Schul-Beispiel: Oxidation eines primären Alkohols (zum Beispiel Butan-1-ol) mit einem ausgeglühten Kupferblech.
Der Alkohol gibt in dieser Reaktion zwei Reduktionsäquivalente ab, also zwei Protonen und zwei Elektronen. Die beiden Elektronen werden von den Cu2+-Ionen des Kupferoxids aufgenommen, das bei der Erhitzung des Kupferblechs entstanden ist. Die beiden Protonen vereinigen sich mit dem Oxid-Anion des Kupferoxids zu Wasser.
Ein anderes Oxidationsmittel für Alkohole ist die Chromsäure H2CrO4, die man erhält, wenn man Natriumdichromat Na2Cr2O7 mit Schwefelsäure versetzt. Allerdings ist dieses Oxidationsmittel so stark, dass oft nicht nur der Aldehyd entsteht, sondern auch gleich die entsprechende Carbonsäure, also das Oxidationsprodukt des Aldehyds. Allerdings kann man die Weiteroxidation des Aldehyds eventuell verhindern, indem man diesen schnell abdestilliert, bevor er weiter zur Carbonsäure oxidiert werden kann.
Zum Mechanismus dieser Oxidation mit Chromsalzen findet man in der Fachliteratur nicht besonders viel. Im alten Morrison/Boyd von 1974 ist aber ein recht komplexes Reaktionsschema abgedruckt, das ich Ihnen hier einmal kurz zeigen möchte:
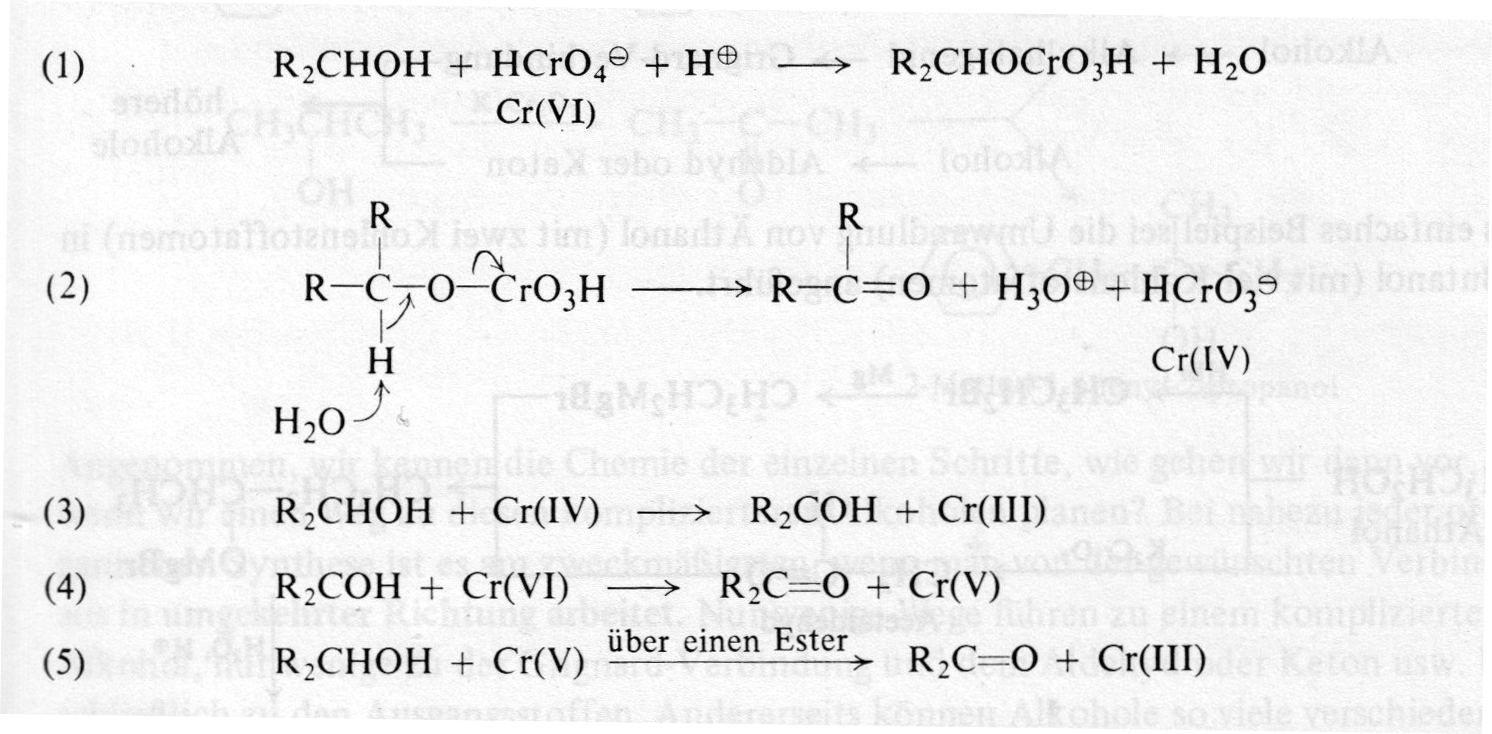
Oxidation eines Alkohols mit H2CrO4
Autor: Morrison/Boyd 1974, Lizenz: Verlag Chemie
Die Schritte (1) und (2) sind eigentlich die entscheidenden, weil hier zunächst ein Chromsäure-Ester gebildet wird, der dann in den Aldehyd / Keton und eine Chrom(IV)-Verbindung gespalten wird. Im Morrison/Boyd lesen wir dann zu den Schritten (3) bis (5):
"Weiterer Alkohol wird dann anscheinend in der Reaktionsfolge (3) - (5) oxidiert, wobei das Chrom schließlich die Cr(III)-Stufe erreicht".
Auch in der Folge 27 der Dyker-Vorlesung "Organische Chemie I" wird ein ähnliches Schema an die Tafel gezeichnet:
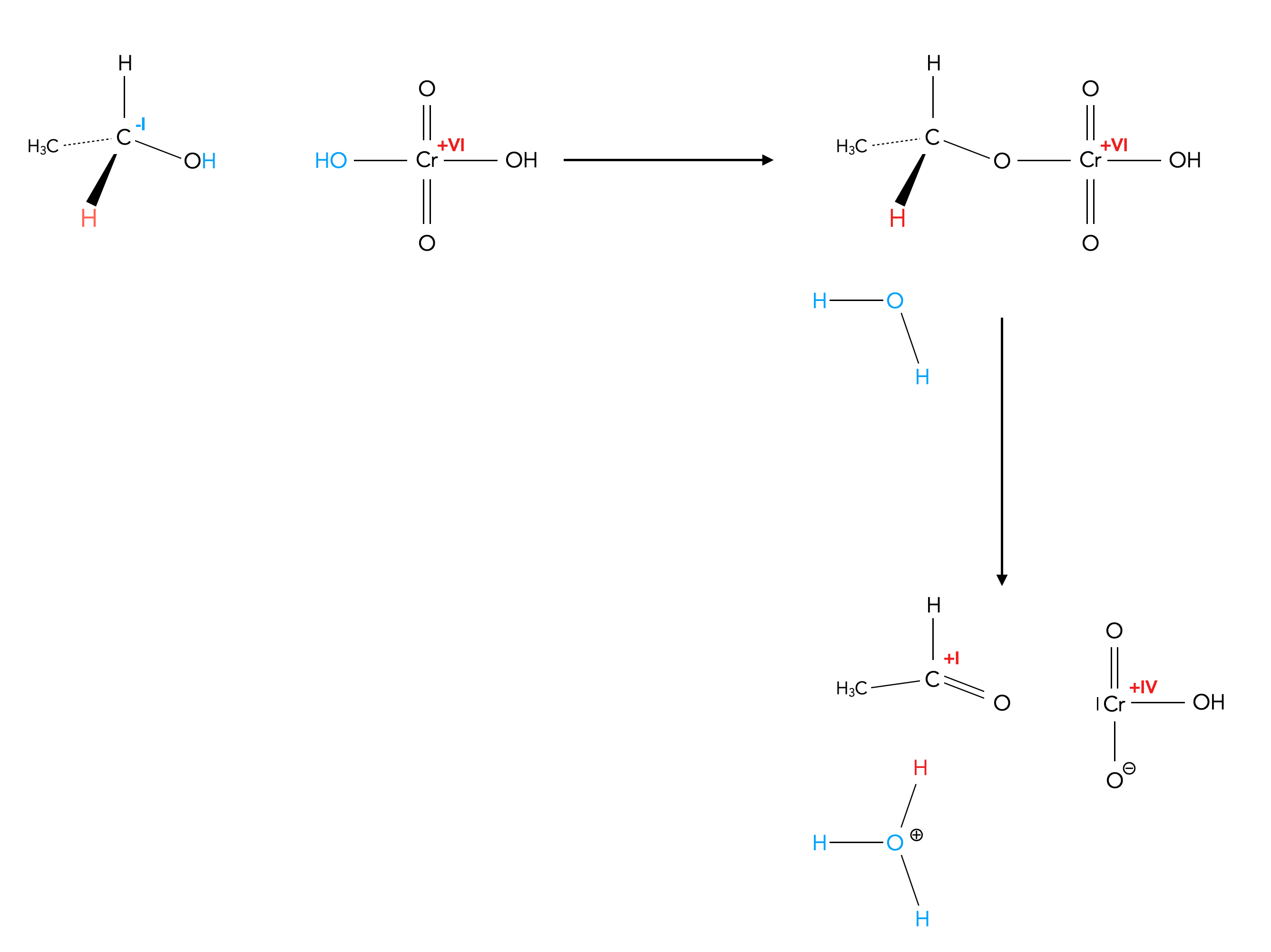
Oxidation eines Alkohols mit Chromsäure
Autor: Ulrich Helmich, Lizenz: Public domain
Auf die Regeneration der eingesetzten Chromsäure geht Dyker dann aber nur kurz ein, er spricht hier von einer Disproportionierung des Chrom(IV)-Ions in ein Chrom(III)- und ein Chrom(V)-Ion. Den Zuhörern der Vorlesung wird dann aber vorenthalten, wie sich aus dem Chrom(V)-Ion dann wieder die Chrom(VI)säure bildet.
Dyker sagt dann weiter, dass diese Alkohol-Oxidation heute weder im Labor noch in der Industrie eine wichtige Rolle spielt, weil bei diesem Verfahren sehr viele Schwermetall-Abfälle entstehen. Der Vorteil des Verfahrens ist allerdings, dass man die Oxidation auf der Stufe des Aldehyds stoppen kann.
Ein Anwendungsgebiet dieser Oxidation gibt es jedoch. In den Alkoholtest-Röhrchen der Polizei läuft nämlich nämlich eine ähnliche Reaktion wie die eben beschriebene ab (Einzelheiten siehe Wikipedia). Die Chromsäure bzw. das Chrom(VI)-Salz ist orangerot gefärbt, das in Anwesenheit von Ethanol gebildete Chrom(IV)- oder Chrom(III)-Salz dagegen auffällig grün.
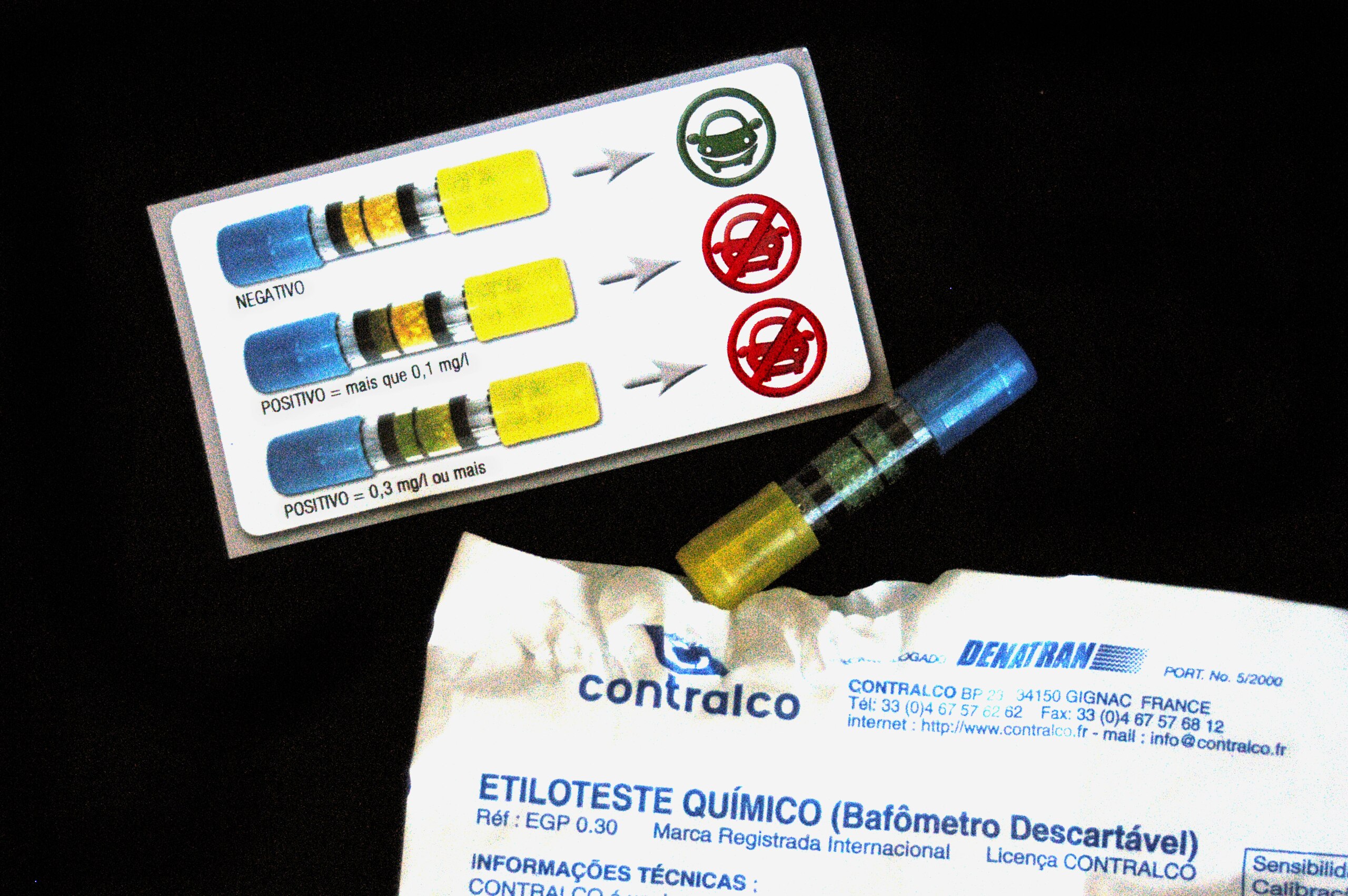
Blasröhrchen zur Atemalkoholkontrolle für den privaten Gebrauch
CostaPPPR, CC BY-SA 3.0, via Wikimedia Commons
Moderne Verfahren zur Alkohol-Oxidation setzen meistens mildere Oxidationsmittel ein, zum Beispiel Pyridiniumchlorochromat (PCC). Mit solchen Oxidationsmitteln kann man auch sehr komplizierte Oxidationen durchführen, die mit einem "Hammer" wie Chromsäure, Kaliumpermanganat oder Kupferoxid gar nicht durchzuführen wären.
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Schmuck, Basisbuch Organische Chemie, 2. Auflage, Pearson-Verlag 2018.
- Klein, Wiley-Schnellkurs Organische Chemie, Teil II, Weinheim 2021.
- Dyker-Vorlesung "Organische Chemie I, Folge 27".
Seitenanfang -
Weiter mit der Stoffklasse der Aldehyde...