5.1 Rekapitulation Schulwissen
Im Schulunterricht haben Sie mit Sicherheit die Addition von Wasser an ein Alken kennengelernt. Mit dieser Reaktion kann man einen Alkohol herstellen.
Auch den Austausch eines Halogen-Atoms gegen eine OH-Gruppe werden Sie im Rahmen der Nucleophilen Substitution kennengelernt haben.
Schließlich wird auch irgendwann das Thema "Reduktion von Aldehyden und Ketonen" aufgekommen sein, wenn es um die Synthese von Alkoholen ging.
5.2 Studienvorbereitung
Die Synthese von Alkoholen kann allgemein durch die folgenden Reaktionen erfolgen:
- Nucleophile Substitution: Halogenalkane können ihr Halogen-Atom gegen eine Hydroxid-Gruppe austauschen (Nucleophile Substitution). Auch aus anderen Verbindungen können Alkohole durch eine SN1- oder SN2-Reaktion hergestellt werden.
- Elektrophile Addition: Alkenen können durch Addition von Wasser zu Alkoholen umgewandelt werden. Die Reaktion ist säurekatalysiert.
- Reduktion von Carbonylverbindungen: Aldehyde und Ketone können durch Reduktion zu Alkoholen reduziert werden. Die Reduktion kann mit verschiedenen Reduktionsmitteln erfolgen, bevorzugt werden Metallhydride dazu eingesetzt.
- Reaktion von Carbonylverbindungen mit Grignard-Reagenzien. Die Nucleophile Addition eines Carbanions ist eine gute Möglichkeit, einen komplexeren Alkohol zu synthetisieren.
5.2.1 Nucleophile Substitution
Bei der Behandlung der Halogenalkane haben wir bereits ausführlich über die beiden Typen der Nucleophilen Substitution gesprochen, die monomolekulare SN1-Reaktion mit einem Carbenium-Ion als Zwischenprodukt und die bimolekulare SN2-Reaktion, bei der das Nucleophil das Nucleofug in einem Reaktionsschritt aus dem Substrat verdrängt.
Lesen Sie die Einzelheiten auf dieser Seite im Abschnitt "Halogenalkane" nach.
Diese Methode wird allerdings in der großindustriellen Alkohol-Synthese nur sehr selten angewendet, weil es zu viele Nebenreaktionen gibt und weil die benötigten Halogenalkane oft erst aus Alkoholen hergestellt werden müssen [1]. Dann wieder einen Alkohol aus einem Halogenalkan zu synthetisieren, wäre reichlich unökonomisch.
Primäre Alkylbromide lassen sich noch recht leicht in primäre Alkohole umwandeln. In [1] wird hier die Umsetzung von 1-Bromoctan zu 1-Octanol mit OH- als Nucleophil als Beispiel aufgeführt. Als aprotisches Lösemittel wird dazu HMPA (Hexamethylphosphoramid) eingesetzt. In einem aprotischen Lösemittel werden die Hydroxid-Ionen nicht solvatisiert, sondern liegen "nackt" vor und können daher das Halogenalkan besser angreifen. Die Ausbeute liegt hier bei 92%; Nebenprodukte werden allerdings nicht aufgeführt, also kann man davon ausgehen, dass eine Gleichgewichtsreaktion vorliegt, die zu 92% auf der Seite des Alkohols und zu 8% auf der Seite des Halogenalkans liegt. Alkene scheinen hier nicht als Nebenprodukt zu entstehen, weil ja keine SN1-Reaktion vorliegt, sondern eine SN2-Reaktion.
Als Beispiel für eine SN1-Reaktion findet sich in dem Buch die Umsetzung von 2-Brombutan mit Wasser als Nucleophil. Die Ausbeute an 2-Butanol beträgt 90%, als unerwünschte Nebenprodukte entstehen durch eine E1-Reaktion die Butene 1-Buten und 2-Buten (bzw. But-1-en und But-2-en).
Als Möglichkeit zur Verhinderung von Nebenreaktionen wird hier die Reaktion von Halogenalkanen mit Acetat CH3COO- als Nucleophil vorgestellt. Das Produkt dieser nucleophilen Substitution wird dann hydrolysiert, und man erhält einen Alkohol. Diese Reaktion wollen wir uns hier an einem Beispiel näher ansehen.
$CH_3COO^{-} + Br{-}R \to CH_3COO{-}R + Br^{-}$
Das Acetat-Ion ist ein gutes Nucleophil, mit seinem negativ geladenen O-Atom greift es das Bromalkan R-Br an und ersetzt das Brom-Atom, das dann als Bromid-Ion freigesetzt wird.
Im zweiten Reaktionsschritt findet nun mit Hilfe von Natronlauge die Hydrolyse des Alkylacetats statt:
$CH_3COO{-}R + NaOH \to HO{-}R + CH_3COO^{-} Na^{-+}$
In der Laborchemie ist die Synthese von Alkoholen aus Halogenalkanen mittels Nucleophiler Substitution sicherlich eine gute Möglichkeit, auch komplexere Alkohole herzustellen. Wie die dabei verwendeten Halogenalkane ursprünglich hergestellt wurden, ist für den Laborchemiker dann relativ unerheblich.
5.2.2 Elektrophile Addition
Die Hydratisierung von Alkenen ist eine weitere wichtige Methode zur Synthese von Alkoholen. Alkenen können durch Hydratisierung, also durch die Addition von Wasser, zu Alkoholen umgewandelt werden. Die Reaktion ist säurekatalysiert.
Auf dieser Seite können Sie alles über diesen Reaktionsmechanismus der Alkene nachlesen.
Eine industriell besonders wichtige Reaktion ist die Hydratisierung von 2-Methylpropen zu 2-Methyl-2-propanol.

Säurekatalysierte Hydratisierung von 2-Methylpropen.
Autor: Ulrich Helmich 08/2023, Lizenz: Public domain
2-Methylpropen spielt auch eine wichtige Rolle bei der industriellen Synthese von Isooctan. Allerdings wird hier nicht Wasser an die Doppelbindung addiert, sondern ein weiteres 2-Methylpropen-Molekül.
Solche Hydratisierungen unterliegen der Markownikoff-Regel. Bei der Addition des Protons im ersten Schritt der Reaktion wird stets das stabilste Carbenium-Ion gebildet. Bei der Reaktion im Bild oben bildet sich beispielsweise ein tertiäres Carbenium-Ion. Hätte sich das Proton an das andere C-Atom der Doppelbindung gesetzt, wäre ein primäres, recht instabiles Carbenium-Ion entstanden.
Die Hydratisierung eines Alkens ist stets eine Gleichgewichtsreaktion. Da alle drei Reaktionsschritt der Hydratisierung von 1-Methylpropen Gleichgewichtsreaktionen sind, kann die gesamte Reaktion auch in umgekehrter Richtung verlaufen, was die Ausbeute an Reaktionsprodukt (Alkohol) dann aber vermindert.
Mit Hilfe des Prinzip des kleinsten Zwangs (LeChateliersches Prinzip) kann man das Gleichgewicht jedoch auf die Seite des Alkohols verlagern. Dazu muss man lediglich einen Überschuss an Wasser (Edukt) verwenden, dann verschiebt sich das Gleichgewicht nämlich auf die Seite des Alkohols (Produkt).
Aber auch der Entropiefaktor spielt hier eine Rolle. Aus zwei Teilchen (Alken + Wasser) entsteht ein Teilchen (der Alkohol), die Entropie verringert sich also während der Reaktion. Das ist jedoch nicht günstig für den Ablauf der Reaktion. Reaktionen laufen besonders gut ab, wenn sich die Entropie erhöht. Das kann man gut mit der Gibbs-Helmholtz-Gleichung erklären.
Exkurs: Die Gibbs-Helmholtz-Gleichung
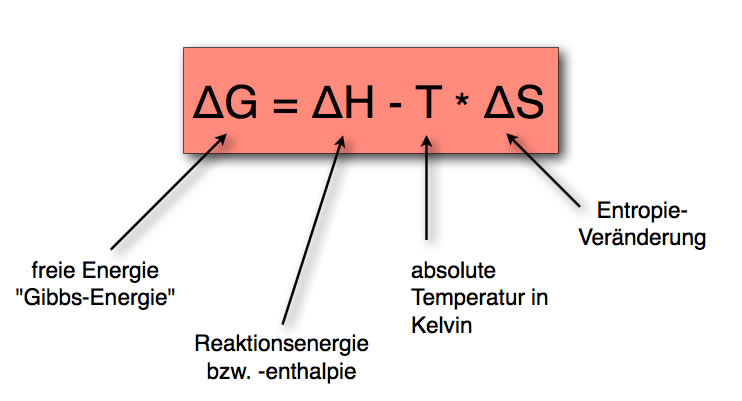
Die GIBBS-HELMHOLTZ-Gleichung
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Die freie Energie oder Gibbs-Energie ΔG einer chemischen Reaktion setzt sich aus zwei Komponeten zusammen. Einmal aus der Reaktionsenthalpie ΔH (der "Reaktionswärme"), und dann aus dem Entropiefaktor T * ΔS.
Daher können auch endotherme Reaktionen, bei denen ΔH > 0 ist, spontan ablaufen, wenn die Entropie bei der Reaktion zunimmt. Der Faktor T * ΔS kann ΔG dann in den negativen Bereich "ziehen", wenn die Temperatur hoch und ΔS einigermaßen groß ist.
Bei der Hydratisierung eines Alkens ist ΔS negativ, weil die Entropie abnimmt. Eine hohe Temperatur würde den Entropiefaktor T * ΔS also stark negativ machen, und da der negative Entropiefaktor von ΔH substrahiert wird, würde ΔG positiver werden (minus -5 ist gleich +5). Aus diesem Grund wird das Gleichgewicht der Hydratisierung durch niedrige Temperaturen auf die Alkoholseite verlagert, durch hohe Temperaturen auf die Alkenseite.
Auf dieser Seite in der Biologie-Abteilung meiner Homepage (Stoffwechselbiologie) können Sie mehr über diese wichtige Gleichung und den Einfluss der Entropie nachlesen.
5.2.3 Reduktion von Carbonylverbindungen
Die Reduktion von Carbonylverbindungen ist eine der wichtigsten Methoden zur Synthese von Alkoholen. Aldehyde und Ketone können durch Reduktion zu primären bzw. sekundären Alkoholen reduziert werden.
Reduktionsmittel
Diese Reaktionen können mit verschiedenen Reduktionsmitteln erfolgen. Häufig verwendet werden bestimmte Metallhydride.
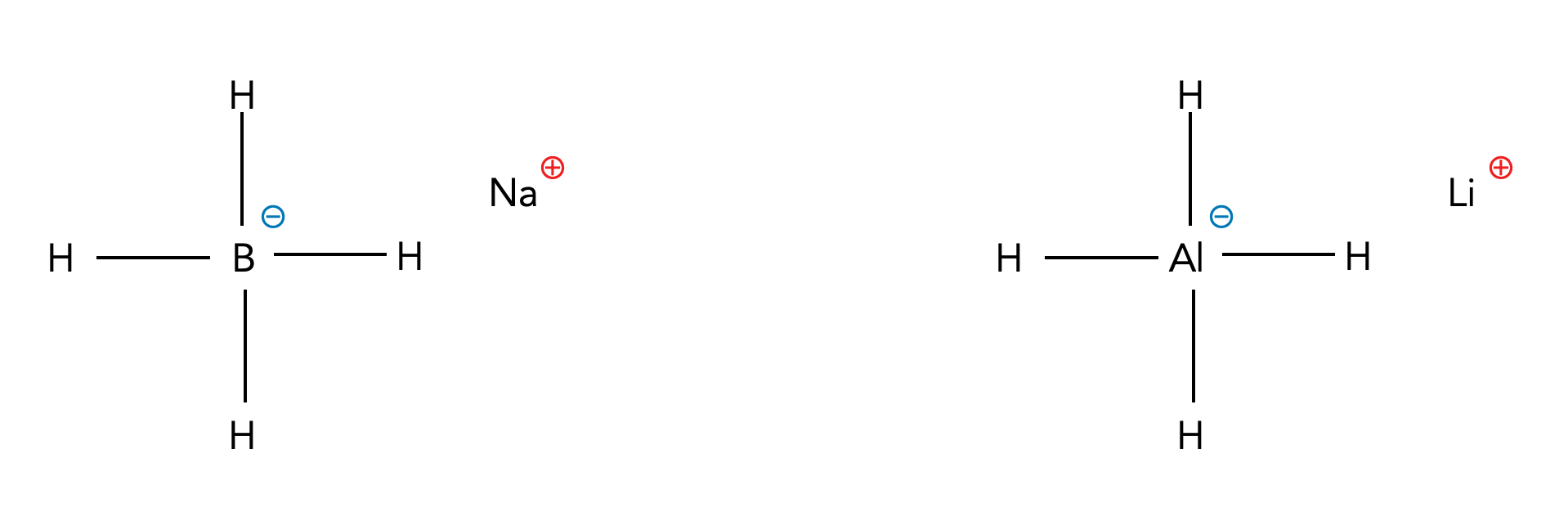
Natriumborhydrid und Lithiumaluminiumhydrid
Bor und Aluminium sind Elemente der dritten Hauptgruppe des Periodensystems, haben also drei Außenelektronen. Von den vier sp3-Hybridorbitalen sind nur drei mit je einem Elektron besetzt, das vierte ist leer und kann leicht ein Hydrid-Anion :H- aufnehmen. So bilden sich die Salze Natriumborhydrid und Lithiumaluminiumhydrid. Beide Salze sind häufig eingesetzte Reduktionsmittel für Aldehyde und Ketone.
Allerdings ist LiAlH4 wesentlich reaktiver als NaBH4 [6]. Das liegt an der Größe des Aluminium-Atoms. Das Al-Atom hat eine Elektronenschale mehr als das Bor-Atom und ist somit leichter polarisierbar (die Elektronen sitzen sozusagen "lockerer" als beim Bor).
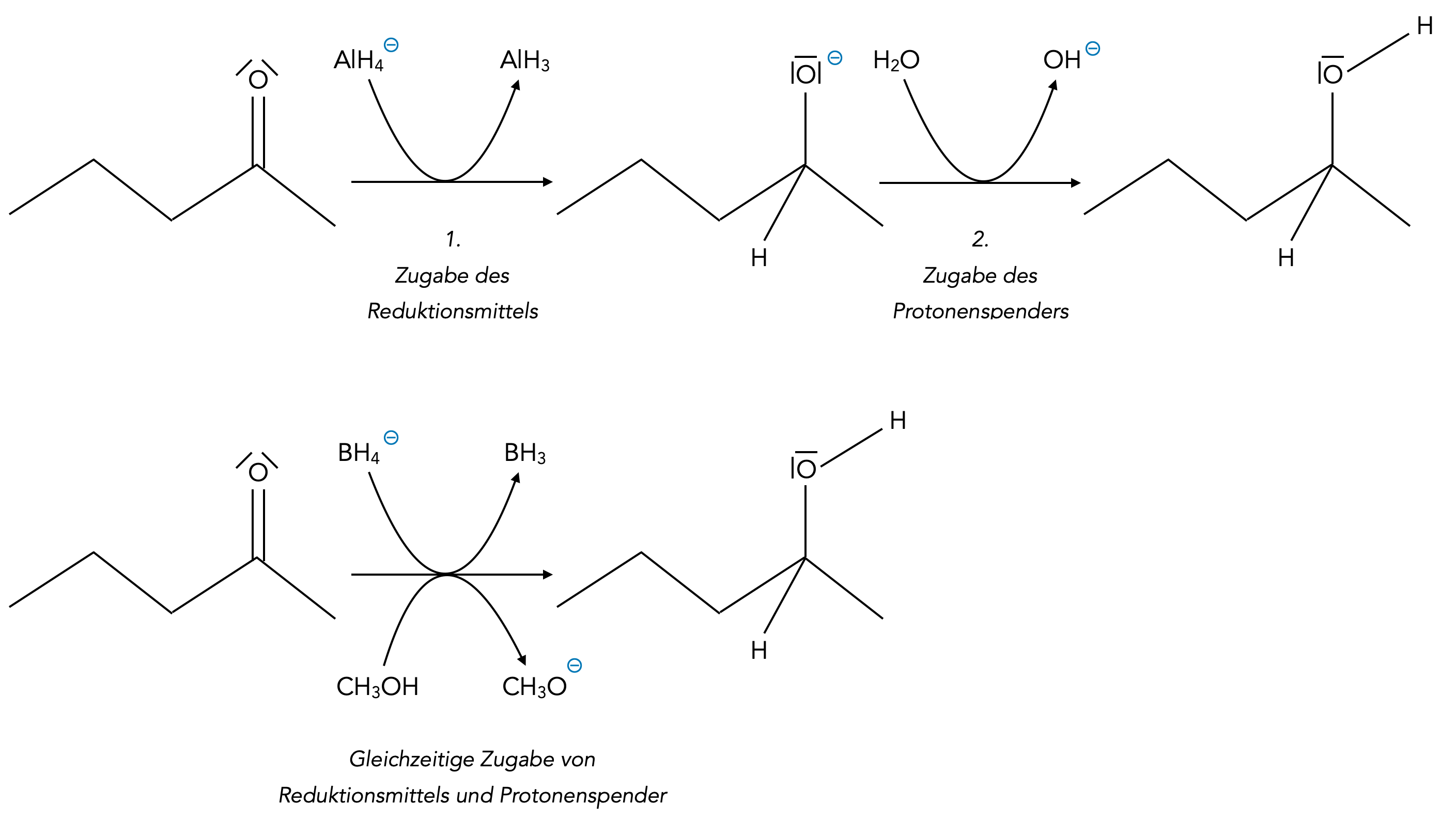
Natriumborhydrid und Lithiumaluminiumhydrid
Weil das AlH4--Ion so stark reaktiv ist, kann man es nicht gleichzeitig mit dem Protonenspender verwenden [6]. Das vom AlH4--Ion freigesetzte Hydrid-Ion würde mit dem vom Protonenspender abgegebene Proton sofort zu Wasserstoff reagieren. Mit Methanol würde beispielsweise folgende Reaktion ablaufen [1]:
$LiAlH_4 + 4 \ \ CH_3OH \to LiAl(OCH_3)_4 + 4 \ \ H_2$
Das BH4--Ion ist nicht so reaktiv, es ist zu träge, um mit dem Protonenspender zu reagieren. Daher kann man das BH4- und einen Protonenspender gleichzeitig mit dem Aldehyd oder Keton reagieren lassen.
Eine direkte Reduktion durch Zugabe von Wasserstoff H2 ist theoretisch ebenfalls möglich, in der Praxis aber nur schwer umsetzbar. Mit hohen Drücken und speziellen Katalysatoren gelingt diese Reduktion im Einzelfall, aber insgesamt sind Hydridspender wie AlH4- oder BH4- praktischer und unter milderen Bedingungen einzusetzen.
Oft wird in Lehrbüchern und Vorlesungen auch die Frage gestellt, warum nicht die einfachen Hydride LiH oder NaH verwendet werden. Die Antwort auf diese Frage ist dann stets die folgende: Das "nackte" Hydrid-Ion H- ist eine sehr starke Base, die von protischen Lösemitteln sofort protoniert würde und somit nicht mehr für die eigentliche Reduktion der Carbonylverbindung verfügbar wäre. Außerdem sind LiAlH4 und NaBH4 in organischen Lösemitteln leichter lösbar als LiH und NaH.
5.2.4 Herstellung mit Hilfe von Grignard-Verbindungen
Im Chemieunterricht haben Sie mit hoher Wahrscheinlichkeit auch das Thema "Nucleophile Substitution" behandelt, als sie die Stoffgruppen der Aldehyde, Ketone und Carbonsäuren besprochen haben. Die C=O-Doppelbindung wird dabei von einem Nucleophil am positiv polarisierten C-Atom angegriffen, das O-Atom der C=O-Gruppe wird dadurch negativ geladen und kann dann von einem Elektrophil wie H+ angegriffen werden.
Im Abschnitt über Halogenalkane haben wir auch Grignard-Verbindungen kennengelernt. Das sind quasi Halogenalkane R-X, bei denen sich ein Magnesium-Atom zwischen den Alkylrest und das Halogen-Atom geschoben hat: R-Mg-X. Das Magnesium-Atom spaltet sich dann recht leicht wieder ab und nimmt dabei das Halogen-Atom mit, zurück bleibt ein negativ geladenes Carbanion :R-. Dieses Carbanion ist dann ein sehr starkes Nucleophil und kann zum Beispiel die C=O-Gruppe eines Aldehyds oder Ketons angreifen:
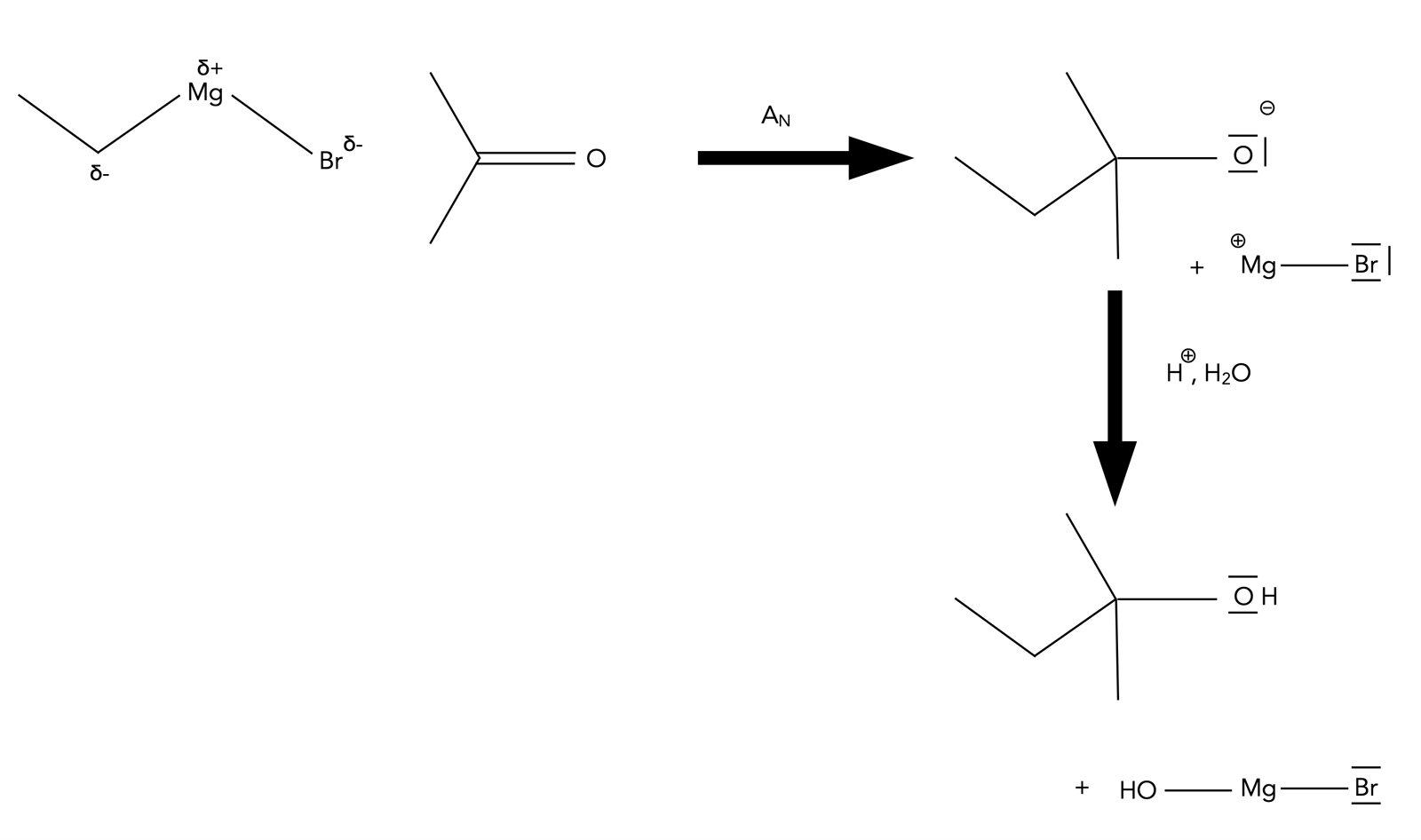
Bildung eines Alkohols aus einer Carbonylverbindung (Aldehyd oder Keton)
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Im Falle eines Aldehyds entsteht ein sekundärer Alkohol, im Falle eines Ketons ein tertiärer. Verwendet man Formaldehyd (Ethanal) als Carbonylverbindnug, erhält man einen primären Alkohol [1].
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Schmuck, Basisbuch Organische Chemie, 2. Auflage, Pearson-Verlag 2018.
- Klein, Wiley-Schnellkurs Organische Chemie, Teil II, Weinheim 2021.
Seitenanfang -
Weiter mit den Reaktionen der Alkohole...