Halbacetale
Wenn Ihnen die folgende Seite zu lang oder komplex erscheint, gehen Sie doch einfach auf diese Seite, die für Schüler(innen) der gymnasialen Oberstufe bestimmt sind. Hier konzentrieren wir uns auf das Wesentliche und verzichten auf komplexere Darstellungen. Fürs Chemie-Abitur sollte das auf jeden Fall reichen. Wenn Sie allerdings vorhaben, Chemie, Biologie oder Medizin zu studieren oder bereits studieren, sollten Sie auf dieser Seite hier bleiben...
Im Prinzip verläuft die Addition eines Alkohols an die Carbonylgruppe eines Aldehyds oder Ketons ähnlich ab wie die Addition von Wasser. Daher müssen wir diese Reaktion jetzt nicht noch einmal in allen Einzelheiten besprechen.
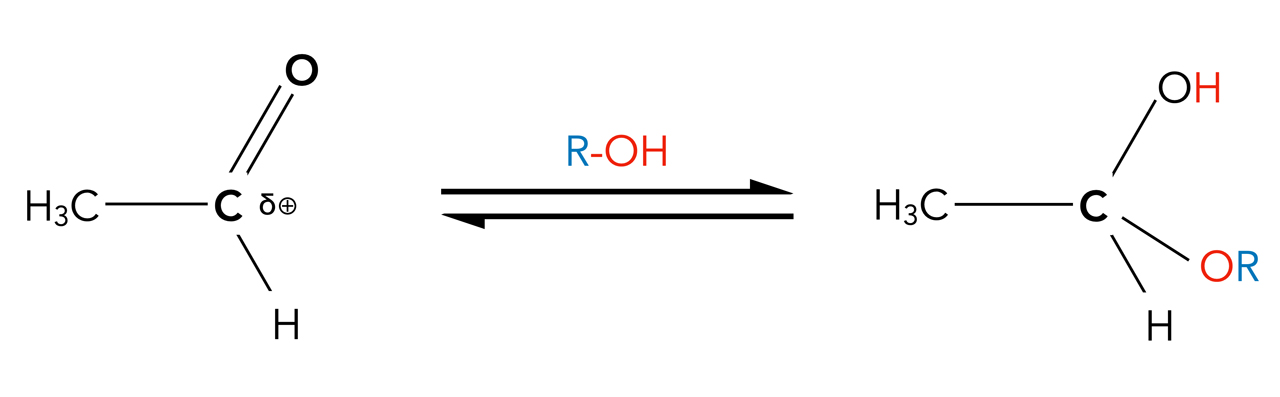
Grundschema der Addition eines Alkohols
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Als Endprodukte bilden sich jedoch nicht Hydrate, sondern Halbacetale R1-C(OH)OR2 mit R2 <> H (mit R2 = H hätten wir wieder ein Hydrat und kein Halbacetal).
Genau wie bei der Addition von Wasser kann man auch bei der Addition von Alkoholen zwischen einer Säurekatalyse und einer Basenkatalyse unterscheiden. Im neutralen Milieu läuft die Halbacetalbildung dagegen so gut wie nicht ab.
Die Gleichgewichtslage der reversiblen Reaktion hängt bei der Halbacetalbildung nicht nur von dem Aldehyd oder Keton ab, sondern auch von dem Alkylrest des Alkohols. Je größer dieser ist, desto schwieriger wird die Reaktion.
Halbacetale und Acetale
Wenn es "Halb"-Acetale gibt, wird es wohl auch "Ganz"-Acetale oder einfach Acetale geben:
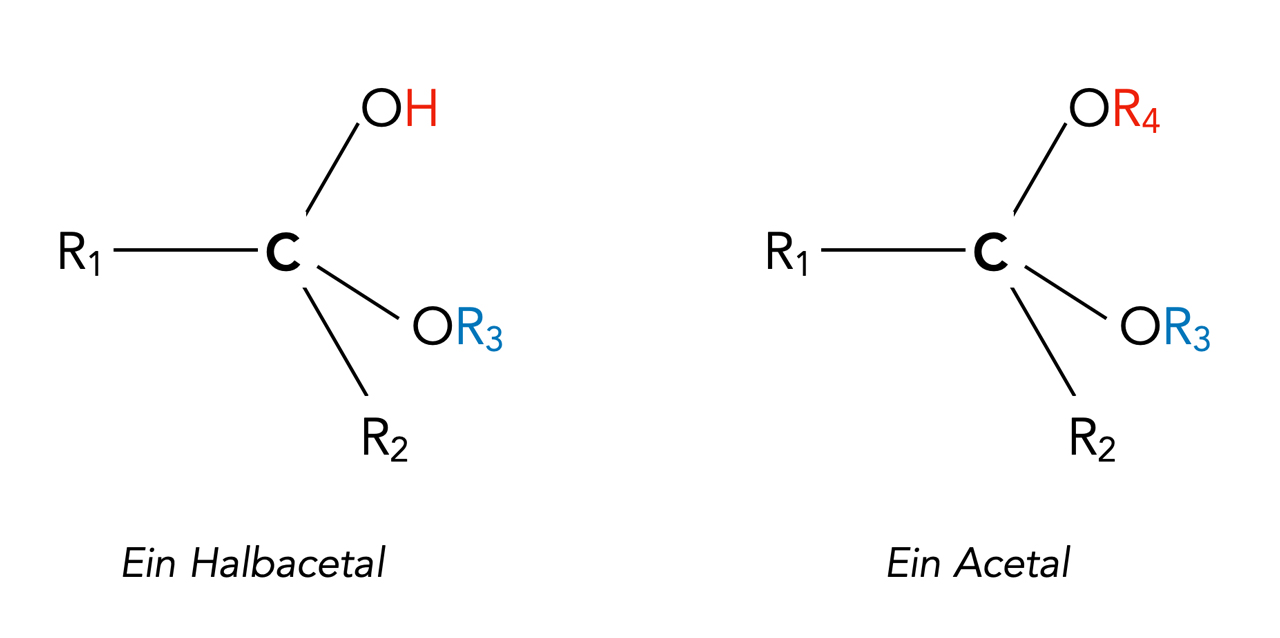
Ein Halbacetal und ein Acetal, allgemeine Strukturformeln
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Diese beiden Strukturen leiten sich von einem Keton R1-CO-R2 ab.
Cyclische Halbacetale
Ähnlich wie die Hydrate sind auch die Halbacetale meistens nicht so stabil, dass sie in Reinform isoliert werden können. Aber es gibt natürlich auch Ausnahmen, einige dieser stabilen Halbacetale nehmen wir sogar täglich mit der Nahrung zu uns: Die ringförmigen Strukturen der Monosaccharide wie Glucose oder Fructose sind nämlich nichts anderes als cyclische Halbacetale.
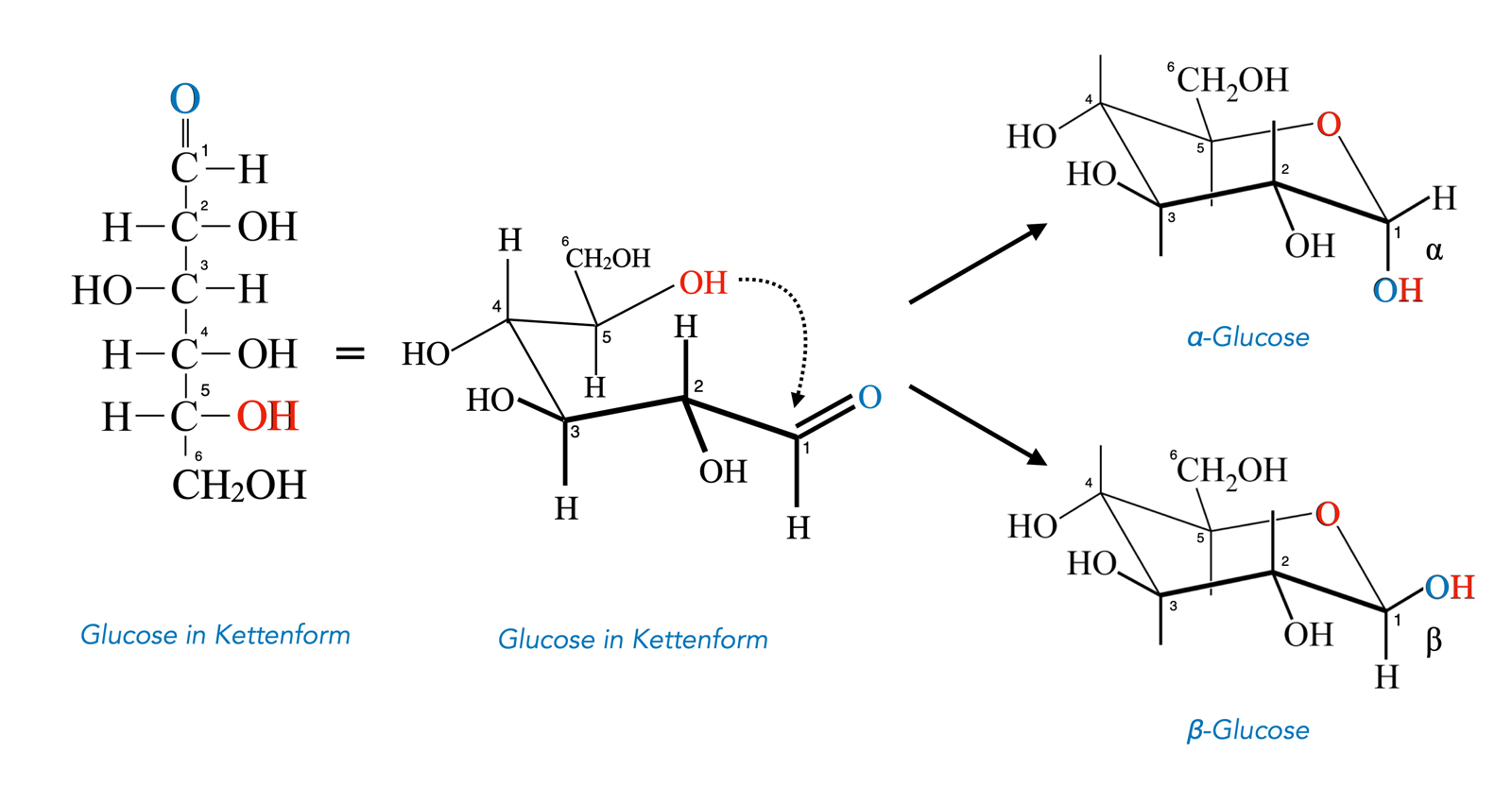
Glucose als Halbacetal
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Auf diesem Bild sehen wir die reversible Umwandlung des Glucose-Moleküls von der Kettenform (links) in die Ringform (rechts).
Die rot gekennzeichnete OH-Gruppe am 5. C-Atom der Glucose-Kette reagiert bei der Ringbildung mit der C=O-Gruppe am 1. C-Atom. Bei dieser Reaktion handelt es sich um nichts anderes als um die nucleophile Addition eines Alkohols an ein Aldehyd.
Je nachdem, von welcher Seite die OH-Gruppe die C=O-Gruppe angreift, erhalten wir die alpha-Glucose oder die beta-Glucose. Die OH-Gruppe am C-Atom 1 des Glucose-Ringes ist bei der α-Glucose nach "unten" gerichtet, bei der β-Glucose nach "oben", wenn man das Molekül so darstellt wie auf der Abbildung.
Der Unterschied mag auf den ersten Blick nicht nennenswert erscheinen. Letzten Endes ist der Unterschied zwischen α- und β-Glucose aber gravierend, denn alle für den Menschen verdaubaren Kohlenhydrate wie Saccharose oder Stärke bestehen aus α-Glucose-Einheiten, während die unverdauliche Cellulose aus β-Glucose besteht.
Wenn Sie sich für die chemischen Aspekte der Glucose interessieren, sollten Sie diese Lexikonseite anklicken.
Auch das Fructose-Molekül liegt in Kettenform vor, aus der sich ein Ring bilden kann. Die Ketogruppe der Fructose befindet sich am zweiten C-Atom, wenn die OH-Gruppe des fünften C-Atoms diese C=O-Gruppe angreift, bildet sich ein Ring, der aus nur fünf Atomen besteht. Ähnlich wie bei der Glucose gibt es dann auch eine α- und eine β-Fructose.
Wenn Sie sich für die chemischen Aspekte der Fructose interessieren, sollten Sie diese Lexikonseite anklicken. Hier finden Sie auch ein Bild zur Ringbildung der Fructose.
Acetale
Bereits am Anfang dieses Textes hatten wir gesehen, dass es neben den Halbacetalen auch "Ganzacetale" gibt, die dann aber einfach "Acetale" genannt werden.
Wie entsteht ein solches Acetal?
Im Grunde handelt es sich um eine ganz simple Nucleophile Substitution: Die OH-Gruppe des Halbacetals wird gegen eine Alkoholat-Gruppe ausgetauscht.
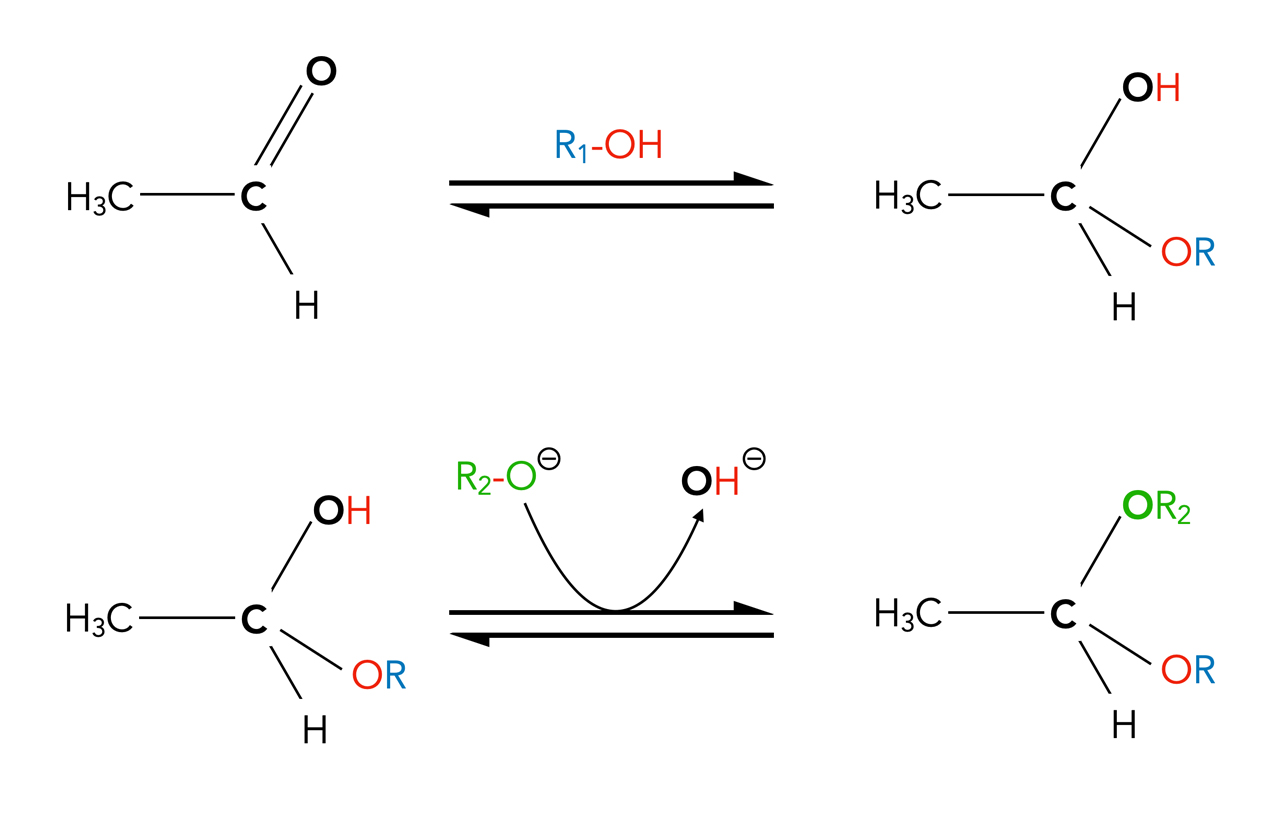
Bildung eines Acetals
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Technisch wird es natürlich nicht so ganz einfach sein, einen Aldehyd oder ein Keton zunächst mit dem einen Alkohol zu einem Halbacetal umzusetzen und anschließend das Halbacetal mit einem zweiten Alkohol zu einem Acetal reagieren zu lassen. Praktischer ist es, für beide Schritte den gleichen Alkohol einzusetzen, im Grunde also die Reaktion nach Bildung des Halbacetals einfach weiter laufen zu lassen. In diesem Fall wäre also R2 = R1.
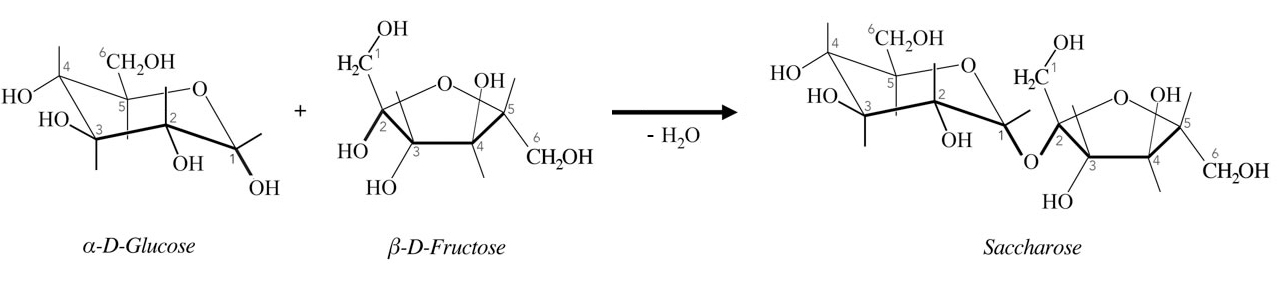
Die Bildung von Saccharose
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das Bild zeigt die Bildung von Saccharose aus alpha-D-Glucose und beta-D-Fructose.
Lassen Sie sich nicht von den leeren Bindungsstrichen verwirren, die nach oben und unten zeigen. Auf diese Weise wird nur die räumliche Lage der H-Atome angedeutet.
Das Fructose-Molekül tritt hier als Nucleophil auf. Die Fructose greift mit der C2-OH-Gruppe das positiv polarisierte C1-Atom der Glucose an und verdrängt dabei die C1-OH-Gruppe der Glucose. Diese OH-Gruppe vereinigt sich mit dem H-Atom der Fructose-C2-OH-Gruppe zu einem H2O-Molekül.
Betrachten wir nun das C1-Atom der Glucose nach erfolgter Saccharose-Bildung näher. Dieses C1-Atom ist mit zwei O-Atomen verbunden, die ihrerseits mit organischen Resten verknüpft sind und nicht einfach nur mit H-Atomen.
Saccharose (und die anderen Disaccharide sowie alle Polysaccharide) sind also - chemisch gesehen - Acetale bzw. Polyacetale.
Acetale als Schutzgruppen
Eine Verbindung, die sowohl eine Keto- wie auch eine Aldehydgruppe enthält, soll mit Natriumborhydrid NaBH4 reduziert werden. Allerdings soll nur die Ketogruppe reduziert werden, nicht aber die Aldehydgruppe.
Natriumborhydrid
Natriumborhydrid ist eine gute "Quelle" für Hydrid-Ionen H-. Das Borhydrid-Anion BH4- zerfällt dabei in Borwasserstoff BH3 und ein Hydrid-Ion H-. Das Hydrid-Ion greift dann das C-Atom der C=O-Doppelbindung in einer nucleophilen Addition an. In saurer Lösung setzt sich anschließend ein Proton an das Sauerstoff-Atom der C=O-Doppelbindung.
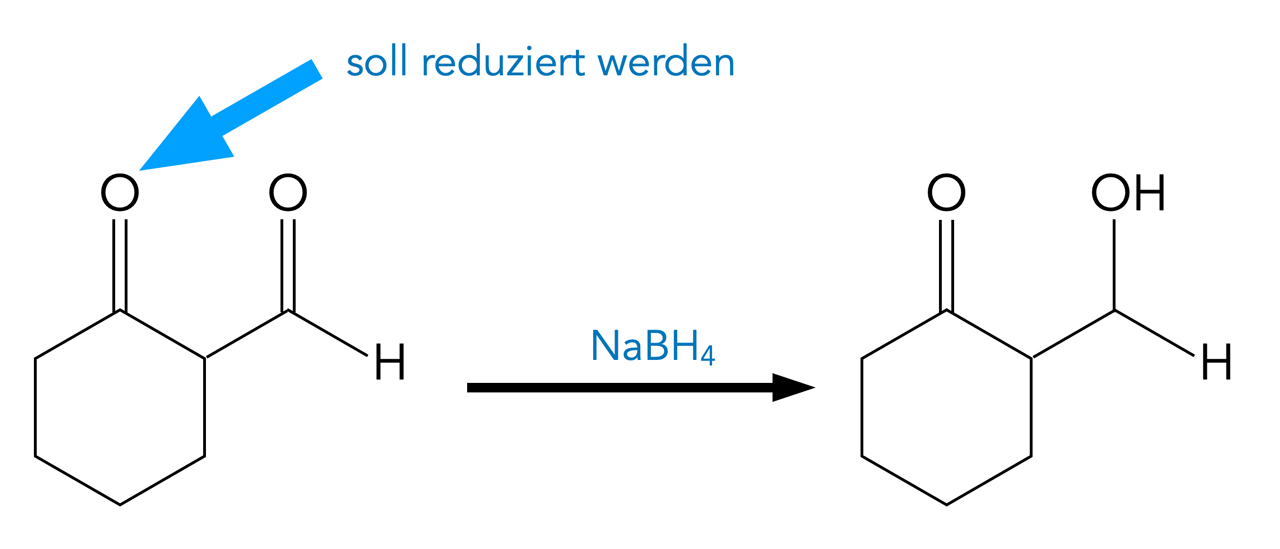
Reduktion einer Ketogruppe mit Natriumborhydrid
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Aufgabe
Erläutern Sie, welches Problem bei der Reduktion der Verbindung aus Abbildung 1 auftritt.
Lösungsvorschlag:
Nicht die Ketogruppe am Cyclohexanring wird reduziert, sondern die Aldehydgruppe der Seitenkette, da diese reaktiver gegenüber Nucleophilen wie H- ist.
Das Carbonyl-C-Atom einer Aldehydgruppe ist stärker positiv polarisiert, weil nur eine Alkylgruppe einen +I-Effekt auf das Carbonyl-C-Atom ausübt. Bei einem Keton wird die Elektronendichte an diesem C-Atom durch den +I-Effekt von zwei Alkylgruppen erhöht, daher ist ein Keto-Carbonyl-C-Atom schwächer positiv polarisiert und somit auch nicht so reaktiv.
Acetal als Schutzgruppe
Schauen wir uns nun an, wie man durch geschickte Versuchsplanung dennoch die Ketogruppe reduzieren kann, aber so, dass die Aldehydgruppe bestehen bleibt.
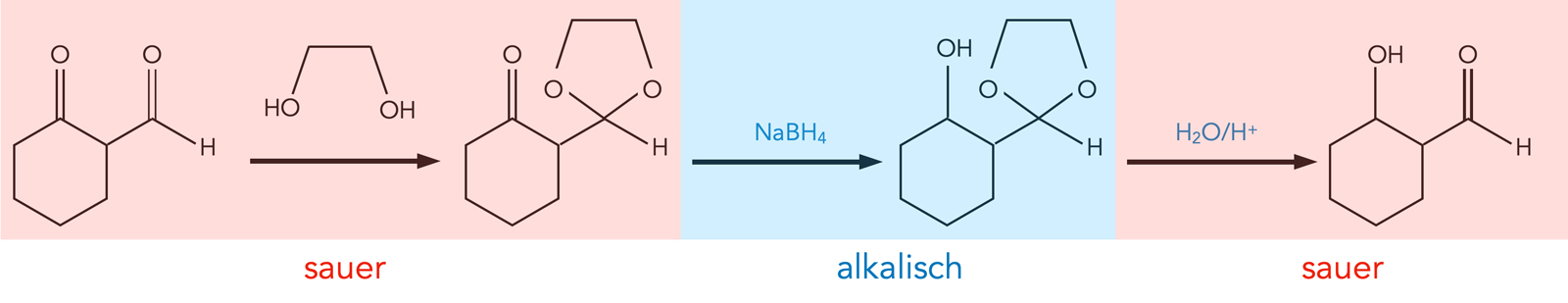
Acetalbildung zum Schutz einer Aldehydgruppe
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die zu reduzierende Verbindung wird zunächst mit Ethylenglycol umgesetzt. Ethylenglycol bzw. Ethan-1,2-diol hat zwei OH-Gruppen. Die erste OH-Gruppe reagiert unter sauren Bedingungen mit der reaktiveren Aldehydgruppe unter Bildung eines Halbacetals, die zweite OH-Gruppe reagiert unter sauren Bedingungen mit dem Halbacetal unter Bildung eines Acetals. Dabei entsteht eine ringförmige Struktur.
In basischer Umgebung sind Acetale, vor allem cyclische Acetale, recht stabile Gebilde, die Rückreaktion ist unter den alkalischen Bedingungen stark erschwert. Daher sorgt man jetzt dafür, dass das Reaktionsmedium alkalisch wird.
Setzt man nun unter alkalischen Bedingungen das Reduktionsmittel ein, so ist die Aldehydgruppe geschützt, sie kann nicht reduziert werden. Für die Ketogruppe gilt das aber nicht, diese wird nun reduziert.
Wenn diese Reaktion abgeschlossen ist, muss nur noch die Schutzgruppe wieder entfernt werden. Dazu ändert man den pH-Wert der Lösung abermals zu sauer. Unter sauren Bedingungen kann ein Acetal wieder in ein Aldehyd umgewandelt werden.
Seitenanfang -
Weiter mit der Addition von NH3 und Aminen ...