Struktur von Propan
Mit Methan und Ethan haben wir bereits die beiden einfachsten Vertreter der homologen Reihe der Alkane kennen gelernt. Schauen wir uns nun das nächste Glied dieser Reihe an, das Propan:

Das Propan-Molekül, gebaut mit einem Molekülbaukasten.
Autor: Ulrich Helmich 2015, Lizenz: siehe Seitenende.
Hier sehen wir das Kugel-Stab-Modell eines Propan-Moleküls. Bei diesem Molekül können wir zwei verschiedene Typen von Kohlenstoff-Atomen unterscheiden:
Zwei C-Atome sitzen an den Enden des Moleküls und sind mit jeweils drei H-Atomen verknüpft. Diese C-Atome haben nur ein weiteres C-Atom als Nachbarn und werden deshalb als primäre C-Atome bezeichnet.
Ein C-Atom sitzt in der Mitte des Moleküls und ist mit zwei anderen C-Atomen verbunden. Ein solches C-Atom nennt man sekundäres C-Atom. Ein sekundäres C-Atom besitzt zwei H-Atome.
Exkurs: Alkan-Moleküle graphisch darstellen
Wie kann man nun ein Alkan-Molekül graphisch darstellen, also mit Bleistift und Papier oder auf einem Tablet-Computer zeichnen?
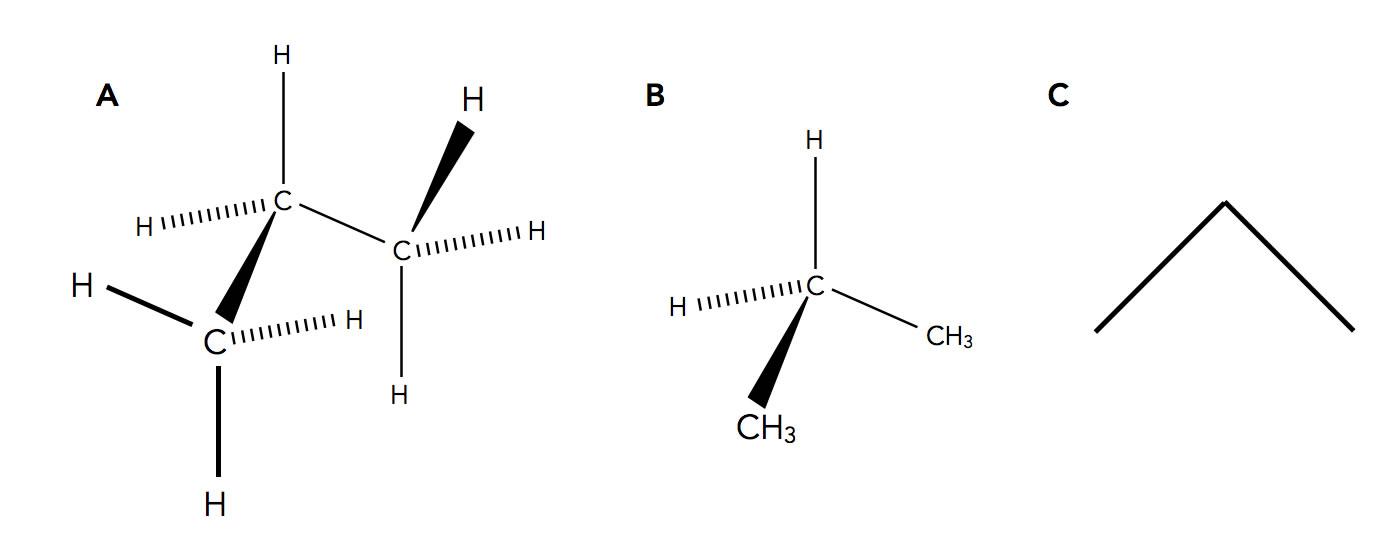
Drei Möglichkeiten, die Propan-Struktur räumlich darzustellen.
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Bei A) sehen wie die aufwendigste Art und Weise, die Raumstruktur des Propan-Moleküls darzustellen. Die Keile zeigen immer Bindungen an, die nach vorne aus dem Bild herausgehen, während die gestrichelten Bindungen hinten aus dem Bild hinausgehen. Bei A) ist jedes einzelne Atom des Propans gezeichnet worden.
Bei B) sehen wir eine Vereinfachung der Darstellung von A). Es ist nur noch das zentrale C-Atom gezeichnet, und die beiden anderen C-Atome mit ihren H-Atomen sind in kompakter Schreibweise als CH3 gezeichnet. Dies ist ein übliches Verfahren in der Chemie, das Platz und Zeit spart.
Bei C) sehen wir die sogenannte Skelettformel des Propans. Die Bindungswinkel werden hier nicht mehr so gut wiedergegeben wie bei A) oder B), aber die Struktur lässt sich sehr schnell, übersichtlich und platzsparend erstellen. Auf meiner Homepage verwende ich selbst auch meistens diese Skelettformeln.
Studienvorbereitung Chemie:
Falls Sie vorhaben, Chemie, Biologie oder Medizin zu studieren, sollten Sie sich an den Gebrauch solcher Skelettformeln gewöhnen, in den meisten Vorlestungen und auch in den Hochschul-Lehrbüchern werden komplexere Strukturen fast ausschließlich durch Skelettformeln dargestellt.
Höhere Alkane
Das Butan mit der Summenformel C4H10 besitzt an den Enden zwei primäre C-Atome und in der Mitte zwei sekundäre C-Atome. Butangas kennen Sie vielleicht aus dem Alltag, es wird auch als Campinggas bezeichnet und wird in kleinen blauen Gaskartuschen geliefert.
Ab dem Pentan haben die höheren Alkane systematische Namen, die sich an lateinischen oder griechischen Zahlwörtern orientieren. "Pent" heißt so viel wie "fünf", "Hex" = 6, "Hept" = 7, "Oct" = 8, "Non" = 9 und "Dec" = 10. Ein Alkan mit acht C-Atomen heißt also Octan, eins mit zehn C-Atomen Decan und so weiter.
Vorkommen
Die einfachsten vier Alkane, also Methan, Ethan, Propan und Butan, sind Bestandteil des Erdgases, kommen aber auch im Erdöl vor, und die höheren, bei Zimmertemperatur flüssigen Alkane ab Pentankommen im Erdöl vor. Methan und Ethan werden außerdem von Mikroorganismen bei Fäulnisprozessen gebildet, so zum Beispiel beim Sumpfgas oder beim Biogas.
Gewinnung
Die meisten Alkane werden direkt aus dem Erdöl oder dem Erdgas gewonnen, vor allem durch fraktionierte Destillation. Die so erzeugten Komponenten können durch verschiedene Crack- und Reforming-Verfahren noch gezielt verändert werden. Komplexere Alkane können aber auch gezielt synthetisiert werden.
Weitere Einzelheiten zu diesem Thema finden Sie auf dieser Seite des Oberstufen-Kurses über Alkane.
Physikalische Eigenschaften
Im Vergleich zu anderen organischen Verbindungen haben Alkane sehr niedrige Schmelz- und Siedetemperaturen, auch ist die Dichte von Alkanen sehr gering. Alle drei Eigenschaften sind auf die extrem geringe Polarität der C-H-Bindungen zurückzuführen. Alkan-Moleküle werden untereinander nur durch van-der-Waals-Kräfte zusammengehalten, nicht durch Dipol-Dipol-Wechselwirkungen oder gar Wasserstoffbrücken-Bindungen.
Die Wasserlöslichkeit von Alkanen ist sehr gering, was daran liegt, dass Alkan-Moleküle keine H-Brücken mit Wasser-Molekülen bilden können und noch nicht mal Dipol-Eigenschaften besitzen.
Weitere Einzelheiten zu diesem Thema finden Sie auf dieser Seite des Oberstufen-Kurses über Alkane.
Chemische Eigenschaften
Alkane können vornehmlich zwei Reaktionen eingehen, nämlich einmal die Oxidation (Verbrennung an der Luft; wirtschaftlich sehr bedeutsam), und dann die Halogenierung (vor allem die Reaktion mit Chlor zu Chloralkanen). Von Säuren oder Laugen werden Alkane normalerweise nicht angegriffen, daher hat man die Alkane früher auch als Paraffine bezeichnet, was so viel bedeutet wie "wenig reaktionsfähig".
Weitere Einzelheiten zu diesem Thema finden Sie auf dieser Seite des Oberstufen-Kurses über Alkane.
Seitenanfang -
Methan -
Ethan -
höhere Alkane -
Nomenklatur -
Isomerie -
physik. Eigensch. -
Gewinnung -
Reaktionen -
Abitur NRW