Versuch zum Lösungsverhalten der Alkohole
Versuch
Löslichkeit von Alkanolen in Wasser und Hexan
Geräte (pro Gruppe):
1 Messzylinder (100 ml), 3 Vollpipetten (20 ml), 1 Stopfen (zum Messzylinder passend)
Chemikalien (pro Gruppe):
Wasser, Hexan, ein Alkanol
Durchführung:
- Man gibt in den Messzylinder genau 20 ml Wasser und 20 ml Hexan.
- Danach gibt man 20 ml des Alkohols dazu. Verwenden Sie jedes Mal eine neue Vollpipette, damit die Chemikalien in den Flaschen nicht kontaminiert werden.
- Anschließend verschließt man den Messzylinder mit dem Stopfen und schüttelt den Inhalt gut durch.
- Nun lässt man den Messzylinder für ca. 5 Minuten stehen.
- Jetzt schaut man, wo die Phasengrenze zwischen der wässrigen Phase (unten) und der organischen Phase (oben) verläuft und notiert den Wert. Wegen der einsetzenden Volumenkontraktion beim Mischen von Wasser und Alkoholen muss auch das Gesamtvolumen des Zylinderinhaltes abgelesen und notiert werden.
Beobachtungen / Messergebnisse:
Die folgende Tabelle zeigt die Messergebnisse:
| Alkohol | V(Wasserphase) in ml | V(Gesamtvolumen) in ml |
| Methanol | 39,5 | 59,0 |
| Ethanol | 38,0 | 58,0 |
| Propan-1-ol | 24,0 | 58,0 |
| Butan-1-ol | 21,5 | 58,5 |
| Pentan-1-ol | 18,5 | 57,8 |
Auswertung:
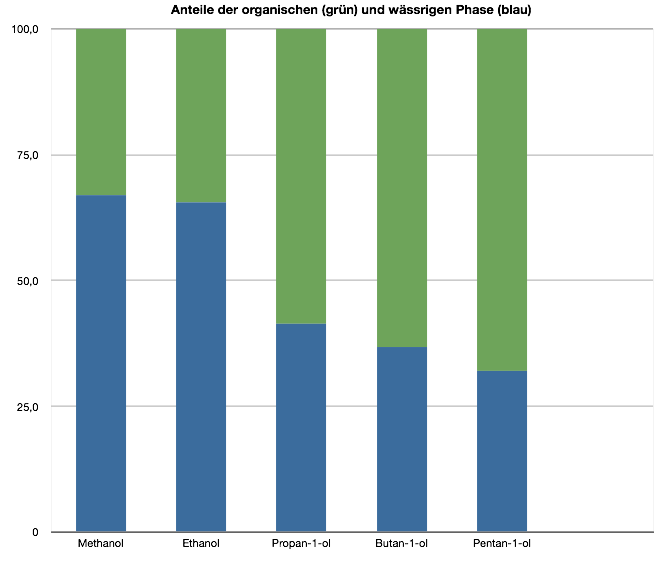
Methanol löst sich sehr gut in Wasser. Das Gesamtvolumen beträgt 59,0 ml, die wässrige Phase hat ein Volumen von 39,5 ml. Das heißt, die organische Phase hat ein Volumen von 19,5 ml. In Prozenten ausgedrückt: Wasserphase = 67%, organische Phase = 33%. Theoretischer Wert ohne Volumenkontraktion: wässrige Phase 40 ml = 67%, organische Phase 20 ml = 33%. Man kann also sagen, dass sich Methanol zu 100% in dem Wasser, aber zu 0% in dem Hexan gelöst hat.
Ethanol löst sich ebenfalls sehr gut in Wasser. Gesamtvolumen 58,0 ml, wässrige Phase 38,0 ml = 65,5%, organische Phase 20 ml = 34,5%. Ein kleiner Teil des Ethanols hat sich also im Hexan gelöst; die organische Phase macht 34,5% aus. Hätte sich Ethanol überhaupt nicht in Hexan gelöst, müsste die organische Phase 33,33% ausmachen.
Propan-1-ol löst sich zwar in Wasser, aber nicht mehr so gut wie Methanol und Ethanol. Die wässrige Phase macht hier nur noch 41,4% aus, die organische Phase dagegen 58,6%.
Butan-1-ol löst sich noch besser in der organischen Phase, nämlich zu 63,2%. Die wässrige Phase macht nur noch 36,8% aus.
Pentan-1-ol löst sich teils immer noch im Wasser (32%), aber zum größten Teil in der organischen Phase (68%).
Stellt man diese Ergebnisse graphisch dar, so erhält man folgendes Diagramm:
Kritische Auswertung der Ergebnisse
Wir wollen die erhaltenen Daten einmal mit den Literaturwerten vergleichen.
Methanol ist unbegrenzt in Wasser löslich, aber auch löslich in Hexan. Stellt man dem Alkohol beide Lösungsmittel "zur Verfügung", kann man also nicht davon ausgehen, dass sich der Alkohol zu 100% in dem Wasser und zu 0% in dem Hexan löst.
Auch Ethanol und Propanol gelten als unbegrenzt in Wasser löslich, aber auch gut löslich in Hexan.
Beim Butan-1-ol findet man in der Literatur eine Wasserlöslichkeit von nur 7,9 g auf 100g Wasser. In 20g Wasser sollten sich also nur 1,6 g Butan-1-ol lösen, das wären ca. 2,0 ml (Dichte = 0,81 g/ml). Das Wasser-Volumen in unserem Versuch hätte also von 20 auf 22 ml zunehmen müssen. In unserem Versuch hat das Volumen der wässrigen Phase von 20,0 auf 21,5 ml zugenommen. Berücksichtigt man allerdings die Volumenkontraktion und rechnet diese aus den Daten heraus, so kommt man auf ein Volumen von 22,1 ml für die wässrige Phase, was ziemlich gut dem erwarteten Ergebnis entspricht.
Pentan-1-ol hat eine Wasserlöslichkeit von 2,2 g auf 100 ml, das sind ca. 2,7 ml auf 100 ml oder 0,54 ml auf 20 ml. Bei unserem Versuch hätte man also erwarten sollen, dass das Volumen der wässrigen Phase auf 20,5 ml zunimmt. Das war jetzt nicht der Fall, im Gegenteil ist das Volumen sogar leicht gesunken, auf 19,2 ml, wenn man die Volumenkontraktion herausrechnet. Logischerweise müsste man hier annehmen, dass sich 0,8 ml des Wassers in dem Hexan gelöst haben, was ja aber doch recht unwahrscheinlich ist. Wahrscheinlich liegt hier ein Verfahrensfehler der Schülergruppe vor.