Versuch mit Bromalkanen
Erinnern Sie sich an den Versuch, den wir auf der ersten Seite mit den drei verschiedenen Brombutanen gemacht haben? Als Reaktionsprodukt hatten wir einen Ether hergestellt.
Ether = Organische Verbindung mit der allgemeinen Struktur R1-O-R2, wobei R1 und R2 gleiche oder verschiedene Alkyl- oder Aryl-Reste sind. Der einfachste Ether ist demnach der Dimethylether mit R1 = R2= CH3.
Es gibt zwei wichtige Verfahren zur Synthese von Ethern.
- Einmal kann man einen Alkohol mit konz. Schwefelsäure oder Aluminiumoxid reagieren lassen. Unter Wasseraustritt bildet sich dann ein symmetrischer Ether R-O-R.
- Zum andern kann man ein Halogenalkan R-X mit einem Alkoholat-Anion R-O- reagieren lassen. Wir haben dann eine klassische nucleophile Substitution, die je nach Reaktionsbedingungen als SN1- oder SN2-Reaktion ablaufen kann. Das Alkoholat-Ion tritt hier als recht starkes Nucleophil auf, das das Halogen aus dem Halogenalkan verdrängt (SN2) bzw. sich an das als Zwischenprodukt entstandene Carbenium-Ion setzt (SN1).
Das zweite Verfahren ist das wichtigste Verfahren zur Synthese von unsymmetrischen Ethern. Es wird auch als Williamsonsche Ether-Synthese bezeichnet.
Die Williamsonsche Ether-Synthese verläuft als SN2-Reaktion bevorzugt mit primären Halogenalkanen. Versucht man die Reaktion mit einem tertiären Halogenalkan, so führt das meistens nicht zu einer Substitution mit Ether-Bildung, sondern zu einer Eliminierung unter Bildung eines Alkens.
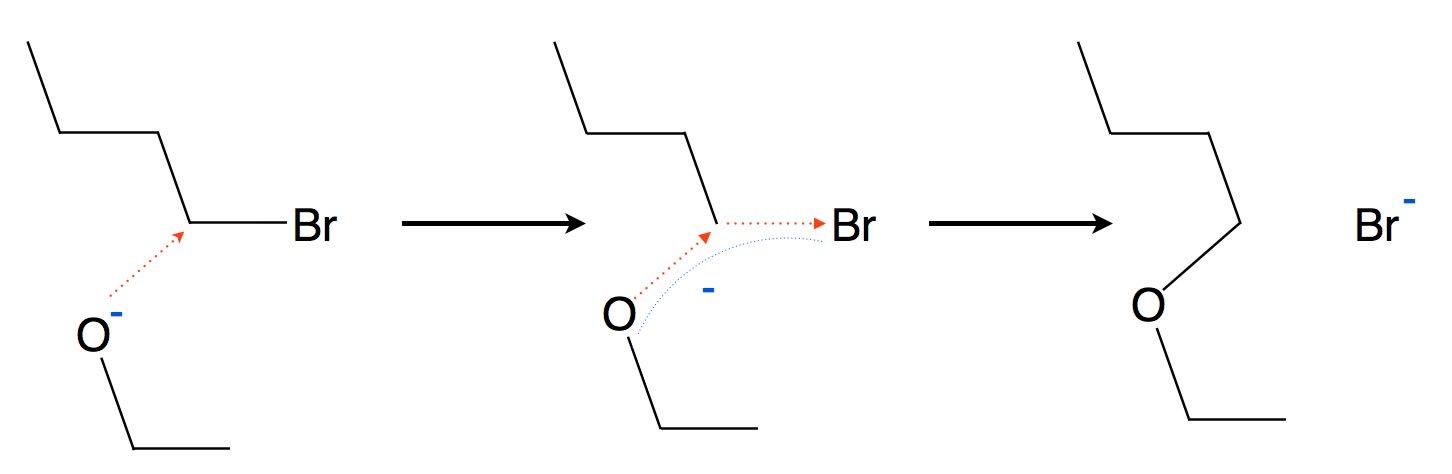
Williamsonsche Ethersynthese am Beispiel der SN2 von 1-Brombutan mit Ethanolat
Die technische Umsetzung der Williamsonsche Ether-Synthese ist ein zweistufiger Prozess. Zunächst einmal muss nämlich das Alkoholat-Anion erzeugt werden. Dies geschieht im einfachsten Fall durch Umsetzung des Alkohols mit elementarem Natrium oder Kalium. Dabei findet eine ähnliche Reaktion statt wie die aus dem Schulunterricht bekannte Umsetzung von Natrium mit Wasser, nur dass sich nicht OH--Ionen und Wasserstoff bilden, sondern OR--Ionen und Wasserstoff.
Der zweite Schritt ist dann die bereits besprochene nucleophile Substitution nach dem SN2-Mechanismus. Als Edukte bzw. Substrat für die Synthese werden bevorzugt Alkylhalogenide R-X mit X = Chlor, Brom oder Iod eingesetzt, aber auch Sulfonsäureester sind gebräuchlich.
Die Ausbeute an Ethern kann leicht erhöht werden, wenn man den leichtflüchtigen Ether durch Abdampfen aus dem Reaktionsgemisch entfernt. Hier kommt wieder einmal das Prinzip des kleinsten Zwangs zur Anwendung.