Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- dass nucleophile Substitutionen monomolekular oder bimolekular ablaufen können,
- dass man entsprechend zwischen SN1-Reaktionen und SN2-Reaktionen unterscheiden kann.
Erstes Beispiel
Chlormethan CH3Cl reagiert mit Natronlauge NaOH bei erhöhter Temperatur zu Methanol CH3OH und Natriumchlorid NaCl:
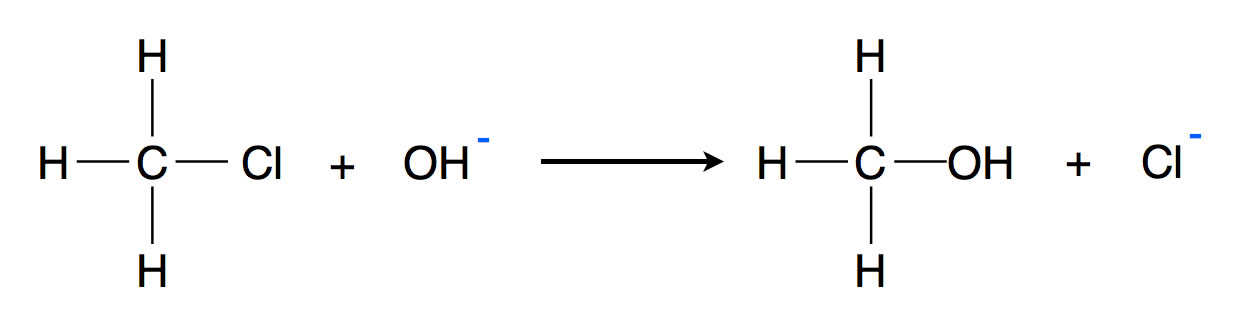
Die Reaktion von Chlormethan mit Hydroxid-Ionen zu Methanol
Die Natrium-Ionen können bei dieser Reaktion vernachlässigt werden.
Untersucht man nun die Kinetik dieser Reaktion, so stellt man fest, dass die Reaktionsgeschwindigkeit sowohl von der Konzentration des Substrats Chlormethan wie auch von der Konzentration des Nucleophils OH- abhängt:
vR = k * c(CH3Cl) * c(NaOH)
Es handelt sich also um eine bimolekulare Reaktion bzw. um eine Reaktion 2. Ordnung. Eine Erklärung für diesen experimentellen Befund ist die Annahme, dass beide Edukt-Teilchen, also sowohl die CH3Cl-Moleküle wie auch die OH--Ionen, aufeinanderprallen müssen, damit es zu einem erfolgreichen Zusammenstoß kommt.
Zweites Beispiel
Kommen wir auf den Versuch zurück, der auf der vorherigen Seite vorgestellt wurde. Wenn wir 2-Brom-2-methylpropan und Ethanol in Anwesenheit von Silbernitrat zusammengeben, beobachten wir eine intensive Reaktion.
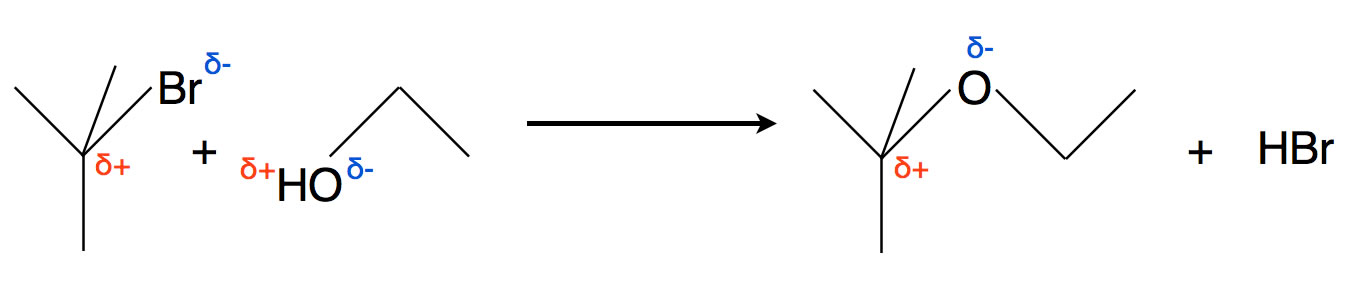
Die Reaktion des tertiären Brombutans mit Ethanol zu einem Ether und HBr
Aus Ethanol und 2-Brom-2-methylpropan bilden sich ein Ethyl-butyl-ether und Bromwasserstoff. An sich könnte man hier nicht viel beobachten. Aber das Silbernitrat reagiert mit den ausgetretenen Bromid-Ionen zu wasserunlöslichem Silberbromid, und die Entstehung dieses Salzes kann man sehr gut beobachten.
Untersucht man die Kinetik dieser Reaktion, so stellt man fest, dass die Reaktionsgeschwindigkeit nur von der Konzentration des Substrats 2-Brom-2-methylpropan abhängt, nicht aber von der Konzentration des neutralen Nucleophils C2H5-OH:
vR = k * c((CH3)3Br)
Es handelt sich also um eine monomolekulare Reaktion bzw. um eine Reaktion 1. Ordnung.
Wir haben jetzt zwei Aussagen, die sich anscheinend widersprechen:
- Die Geschwindigkeit der Reaktion hängt nur von der Substratkonzentration ab, nicht aber von der Konzentration des Nucleophils.
- Bei der Reaktion reagieren zwei Teilchen miteinander, das Substrat und das Nucleophil.
Wieso hat die Konzentration des Nucleophils Ethanol bzw. Ethanolat-Ion keinen Einfluss auf die Reaktionsgeschwindigkeit, wenn es doch eines der beiden Edukte ist?
Die Erklärung für diesen anscheinenden Widerspruch ist folgende:
Eine zweischrittige Reaktion
Die Reaktion läuft in zwei Schritten ab:
Schritt 1: heterolytische Abspaltung des Brom-Atoms. Bei der Abspaltung des Brom-Atoms muss eine kovalente Bindung aufgebrochen werden, dies ist ein endothermer Vorgang mit einer hohen Aktivierungsenergie. Eine solche Reaktion läuft recht langsam ab.
Schritt 2: Anlagerung des Nucleophils. Bei der Anlagerung des Alkoholat-Ions wird eine neue kovalente Bindung erzeugt. Das ist ein exothermer Vorgang mit einer geringen Aktivierungsenergie. Dieser Teilschritt verläuft daher recht schnell.
Welchen Einfluss haben nun diese beiden Teilschritte auf die Gesamtgeschwindigkeit und auf die Kinetik der Gesamtreaktion?
Bei einer mehrschrittigen chemischen Reaktion hängt die Geschwindigkeit der Gesamtreaktion immer von dem langsamsten Teilschritt ab. Diese Reaktion wird dann als geschwindigkeitsbestimmende Reaktion oder geschwindigkeitsbestimmender Schritt bezeichnet.
Bei der eben behandelten nucleophilen Substitution ist die Abspaltung des Nucleofugs der geschwindigkeitsbestimmende Schritt. Und da dieser Schritt monomolekular verläuft, also nur von der Konzentration des Substrats abhängt, nicht aber von der Alkoholkonzentration, verläuft auch die gesamte Reaktion nach einer monomolekularen Kinetik. Daher bezeichnet man diesen Typ der nucleophilen Substitution als SN1-Reaktion, die Zahl 1 steht für "monomolekular".
SN1- und SN2-Reaktionen
Wir haben also gesehen, dass die nucleophile Substitution auf unterschiedliche Weise ablaufen kann. Bei der SN1-Reaktion wird zunächst das Nucleofug abgespalten (geschwindigkeitsbestimmender monomolekularer Schritt), und erst im zweiten (schnellen) Schritt lagert sich das Nucleophil an. Bei der SN2-Reaktion dagegen verdrängt das Nucleophil das Nucleofug aus dem Molekül - in einem Schritt. Die Geschwindigkeit dieses Schrittes hängt dann von der Konzentration des Substrats und der Konzentration des Nucleophils ab.
Welcher Reaktionstyp nun genau vorliegt, kann man mit Hilfe kinetischer Untersuchungen und anderer Methoden herausbekommen. In vielen Fällen kann man aber auch vorhersagen, welcher Mechanismus zur Geltung kommt, und oft ist es sogar möglich, die Reaktionsbedingungen so zu wählen, dass die Substitution nach dem SN1- oder nach dem SN2-Mechanismus verläuft.
Diese Einzelheiten werden wir nun auf den nächsten Seiten näher besprechen.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Morrison/Boyd, Organic Chemistry, 7th Edition, 2011
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
Seitenanfang -
Weiter mit der SN2-Reaktion...