Aufgabe 1
Setzt man Brom-methan mit Natriumiodid um, erhält man Iod-Methan und Natriumbromid in einer SN2-Reaktion. Die Reaktionsgeschwindigkeit dieser Umsetzung wird gemessen und auf den Wert 100 gesetzt (ein rein willkürlicher Vergleichswert!).
Führt man die gleiche Reaktion mit Brom-ethan durch, misst man - bei gleichen Reaktionsbedingungen - eine relative Reaktionsgeschwindigkeit von nur noch 0,69 Einheiten.
Wenn man dann die selbe Reaktion mit 2-Brom-propan durchführt, ist die Reaktionsgeschwindigkeit kaum noch messbar, sie liegt bei 0,005 Einheiten.
Finden Sie eine Erklärung für diese unterschiedlichen Reaktionsgeschwindigkeiten!
Lösungsvorschlag
Der Grund für die Verlangsamung der Reaktionsgeschwindigkeit liegt in der Struktur der Substrat-Moleküle, es geht hier um sterische Hemmung. Das Brom-Atom des Brom-methans ist relativ leicht von der Rückseite angreifbar, keine Alkylgruppen hemmen den Angriff des Nucleophils. Beim Brom-ethan ist das Brom-Atom schon nicht mehr so ganz frei zugänglich, und beim 2-Brom-propan können zwei Methylgruppen die "Einflugschneise" des Nucleophils blockieren.
Aufgabe 2
Setzt man in Methanol gelöstes Brom-methan mit Natriumiodid um, erhält man Iod-Methan und Natriumbromid in einer SN2-Reaktion. Die Reaktionsgeschwindigkeit dieser Umsetzung wird gemessen und auf den Wert 100 gesetzt (ein rein willkürlicher Vergleichswert!).
Ersetzt man nun in einem zweiten Versuch das Lösemittel Methanol durch das Lösemittel Aceton, so verläuft die Reaktion ca. 500 mal schneller!
Finden Sie eine Erklärung für diese enorme Beschleunigung der Reaktion!
Lösungsvorschlag
Wie auf der Vertiefungsseite zur Nucleophilie erläutert wird, ist Methanol ein protisches Lösemittel. Die Methanol-Moleküle solvatisieren die Iodid-Ionen des Natriumiodids (die Natrium-Ionen natürlich auch, aber das spielt hier keine Rolle). Wenn das Nucleophil Iodid das Substrat angreifen soll, muss zunächst die Hülle aus Methanol-Molekülen entfernt werden, und das verzögert die Reaktion erheblich.
Aceton dagegen ist ein aprotisches Lösemittel, bildet zwar auch eine Solvathülle um die Ionen, die aber im Vergleich zur der Methanol-Hülle sehr klein ist. Daher kann diese lockere Solvathülle von den Iodid-Ionen leicht abgestreift werden und die Reaktion verläuft wesentlich leichter.
Aufgabe 3
Ein wichtiger Versuch zum Nachweis des SN2-Mechanismus wurde 1935 von E. Hughes durchgeführt:
2-Iod-octan ist eine optisch aktive Verbindung, weil das C2-Atom chiral ist. Die Verbindung wurde in einer Acetonlösung mit radioaktiv markiertem Iodid (Na+ 131J-) versetzt. Bei den 2-Iod-octan-Molekülen fand eine Substitution des normalen Iods gegen das radioaktive Iod statt, dabei verschwand im Laufe der Reaktion die optische Aktivität des Substrats.
Bei dem Versuch wurden zwei Geschwindigkeiten gemessen:
- VR, Die Reaktionsgeschwindigkeit der Substitutions-Reaktion.
- VO, Die Geschwindigkeit, mit der die optische Aktivität verloren ging.
Dabei stellte sich heraus, dass VO doppelt so groß war wie VR.
Erklären Sie diese Befunde!
Lösungsvorschlag
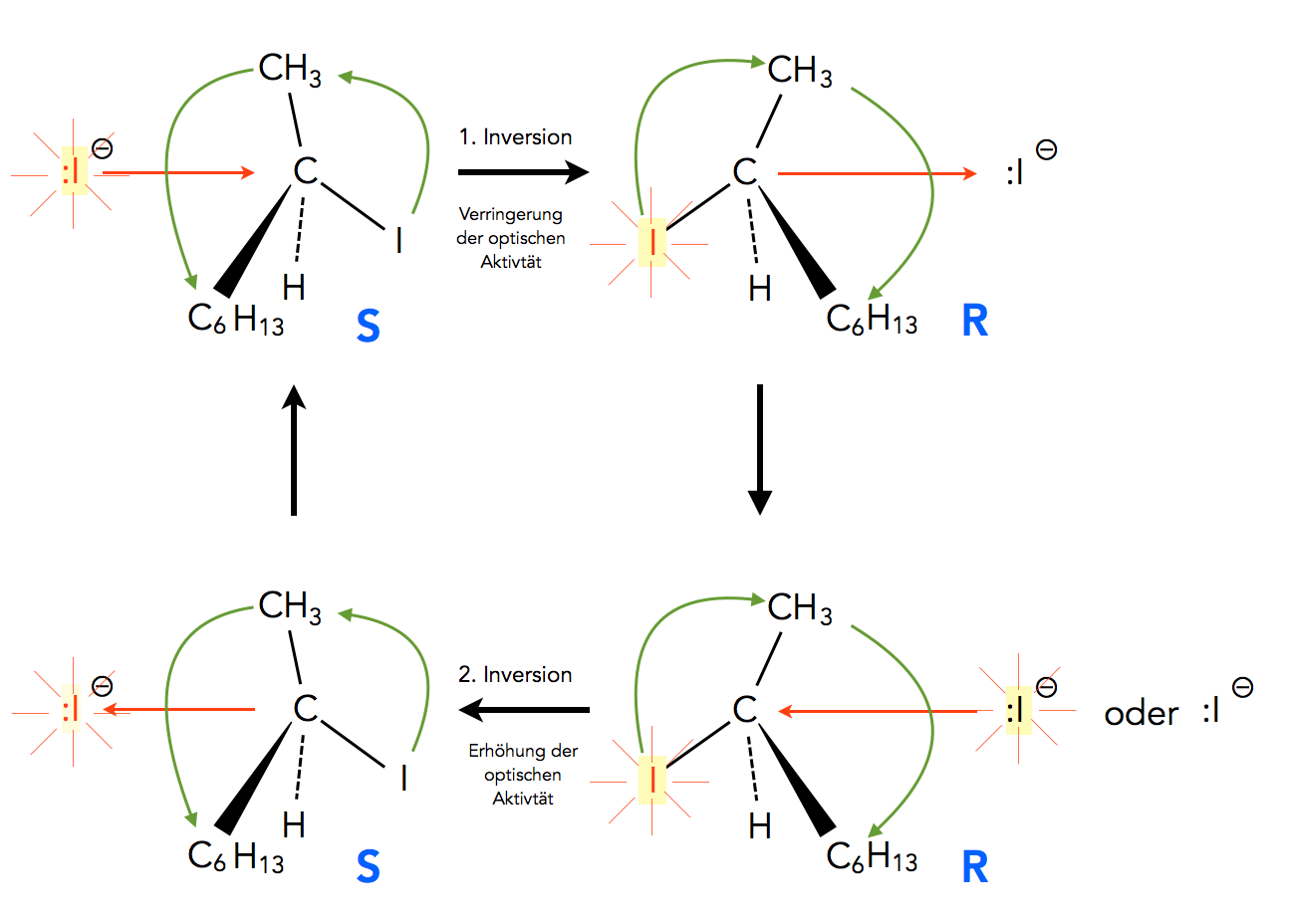
Mehrfache Inversion des Substrats
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Die optische Aktivität des Substrats ist bereits dann aufgehoben, wenn 50% der Substrat-Moleküle reagiert haben. Dann liegen nämlich genau so viele S-Isomere vor wie R-Isomere. Die Reaktion ist aber erst beendet, wenn 100% der Substrat-Moleküle umgewandelt worden sind. Die Geschwindigkeit der Racemisierung ist also doppelt so groß wie die Geschwindigkeit der Reaktion an sich.
Nun könnte man einwenden: Wenn die Reaktion abgeschlossen ist, wenn also 100% der Substrat-Moleküle reagiert haben, müsste die Verbindung doch wieder optisch aktiv sein, da jetzt ja alle Substrat-Moleküle in der R-Konfiguration vorliegen. War die Lösung zu Beginn des Versuchs linksdrehend, müsste sie am Ende des Versuchs rechtsdrehend sein.
Die Abbildung zeigt ab, wieso das nicht so ist. Das Produkt der ersten Inversion kann nämlich weiter mit Iodid-Ionen reagieren, von denen sich ja jede Menge in der Lösung befinden. Das Ergebnis ist dann eine zweite Inversion, welche die erste rückgängig macht. Sobald 50% der Substrat-Moleküle invertiert sind, stellt sich ein Gleichgewicht zwischen den S- und R-Konfigurationen ein. Es liegt dann ein Racemat vor, das optisch nicht aktiv ist.
Quellen:
- Morrison/Boyd, Organic Chemistry, 7th Edition, 2011
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
Seitenanfang -
Weiter mit der SN2-Reaktion im Überblick...