Unter einer Lewis-Säure versteht man ein Teilchen mit einem leeren Orbital, das eine kovalente Bindung mit einer Lewis-Base eingehen kann, also einem elektronegativen Teilchen mit einem freien Elektronen (bzw. doppelt besetzten Orbital). Lewis-Säuren sind in der Regel gleichzeitig auch Elektrophile, also Teilchen, die sich "gern" an negativ geladene oder polarisierte Kohlenstoff-Atome organischer Verbindungen setzen.
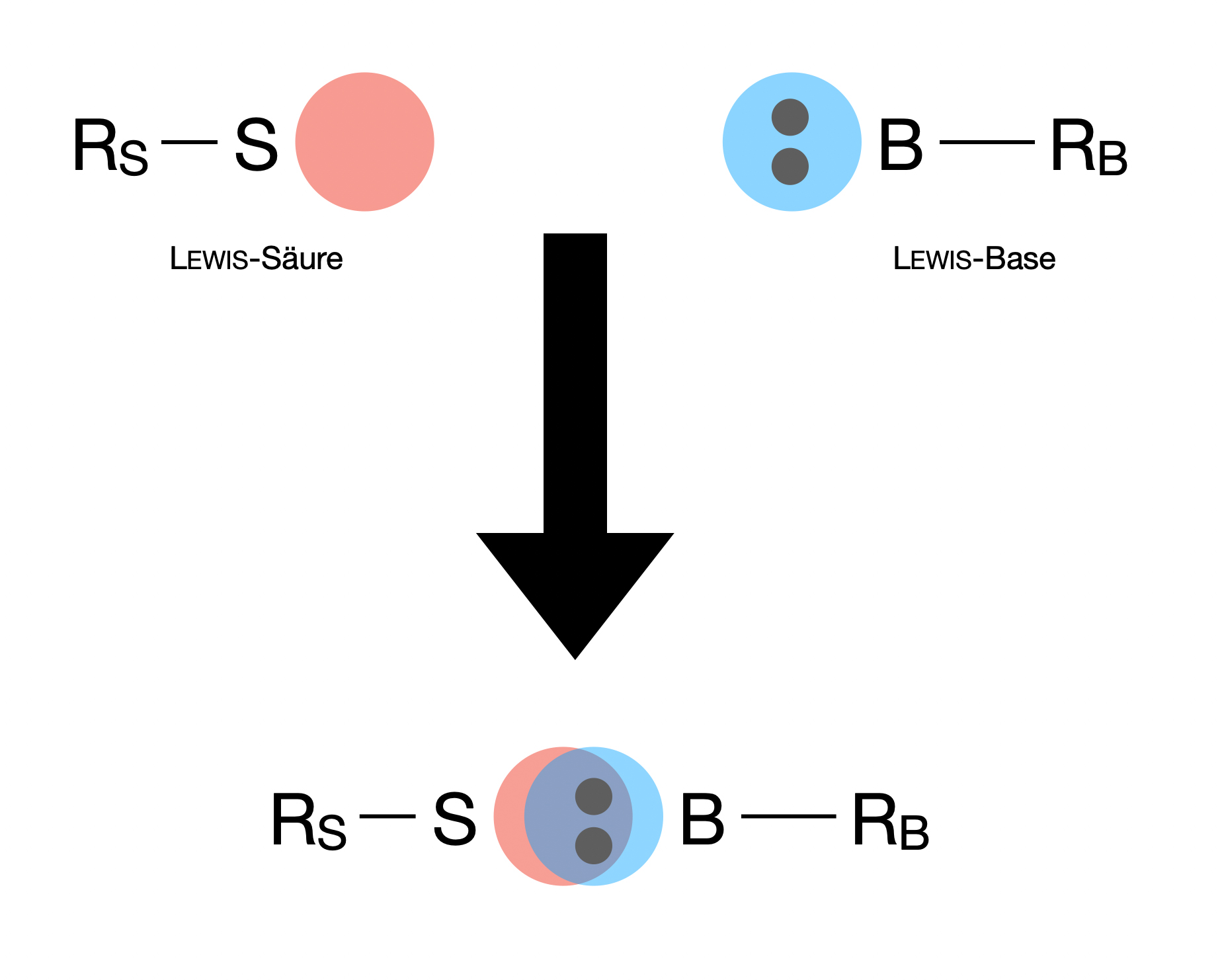
Reaktion einer Lewis-Säure mit einer Lewis-Base, allgemeines Schema.
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Protonen
Das interessanteste Beispiel für eine Lewis-Säure ist das Proton. Nach dem Säure-Base-Konzept von Brönsted, quasi dem Vorläufer von Lewis, sind Säuren Protonendonatoren, können also Protonen abgeben. Nach dem Säure-Base-Konzept von Lewis dagegen ist das Proton selbst eine Säure. Schwefelsäure ist also nach Lewis keine Säure, sondern gibt bei ihrer Dissoziation Säuren ab, nämlich die Protonen.
Carbenium-Ionen
Auch Carbenium-Ionen sind Lewis-Säuren, sie besitzen am zentralen C-Atom ja eine leere Kugelwolke bzw. ein leeres pz-Orbital.
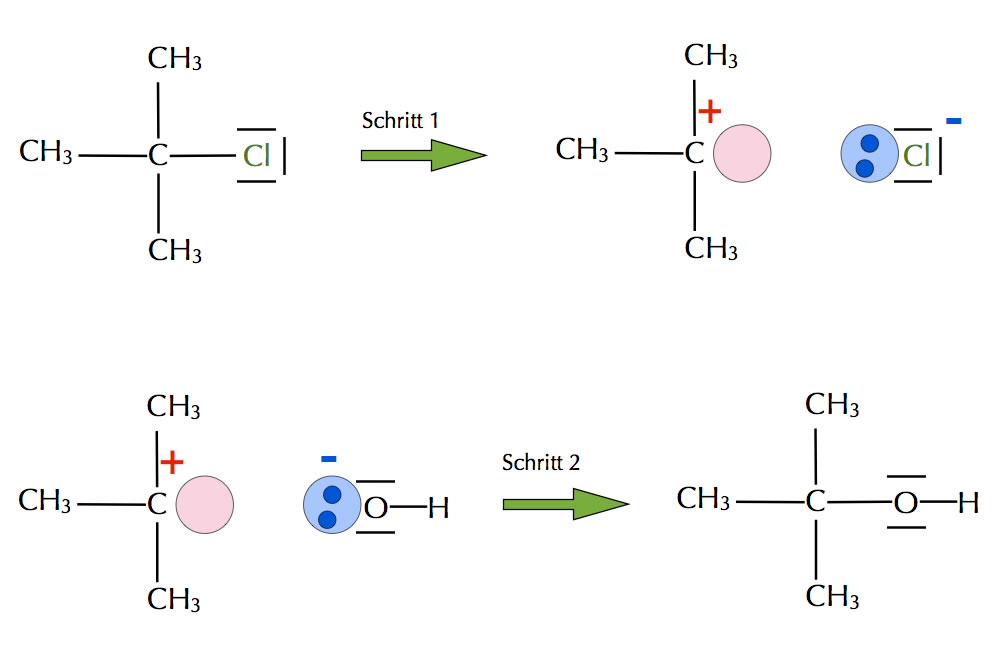
Beispiel für eine nucleophile Substitution nach dem SN1-Mechanismus
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Carbenium-Ionen sind das Angriffsziel von Nucleophilen, die zu den Lewis-Basen gehören.
➥Nucleophile Substitution
Auf diesen beiden Seiten werden Carbenium-Ionen und die nucleophile Substitution näher besprochen.
Aluminiumchlorid und -bromid
Aluminiumchlorid und -bromid sind klassische Lewis-Säuren. Stellen wir uns das Aluminiumchlorid-Molekül nach dem Kugelwolkenmodell vor.

Das AlCl3-Molekül nach dem Kugelwolkenmodell
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
In der Mitte der Abbildung sehen wir ein Al-Atom mit seinen vier Kugelwolken (blau eingefärbt). Drei dieser Kugelwolken sind mit je einem Elektron besetzt, die vierte Kugelwolke ist leer (rot gefärbt).
Die drei einfach besetzten Kugelwolken überlappen nun mit den ebenfalls einfach besetzten Kugelwolken von Chlor-Atomen (grün eingefärbt).
Die Bindungen zwischen dem Al-Atom und den Cl-Atomen sind weder rein ionisch noch rein kovalent, sondern der Bindungstyp liegt irgendwo zwischen ionisch und kovalent-polar; das liegt an dem recht geringen EN-Unterschied zwischen Aluminium und Chlor. Für eine polare kovalente Bindung ist der EN-Unterschied zu groß, für eine Ionenbindung aber zu klein.
Was macht das Aluminiumchlorid nun zu einer Lewis-Säure? Das Vorhandensein der leeren Kugelwolke ist hier entscheidend. Mit dieser leeren Kugelwolke kann sich das AlCl3-Molekül nun an andere Teilchen setzen, die ein freies Elektronenpaar anbieten, zum Beispiel an das NH3-Molekül oder an ein Chlorid-Ion. Tatsächlich bildet sich aus AlCl3 und Cl- die Verbindung AlCl4-. Ammoniak und Chlorid-Ionen sind dementsprechend Lewis-Basen.
Aluminiumbromid AlBr3 hat die gleiche Struktur wie Aluminiumchlorid und ist auch eine Lewis-Säure. AlBr3 spielt eine wichtige Rolle bei der Bromierung von Aromaten (elektrophile Substitution). Das AlBr3-Molekül ist in der Lage, ein Br2-Molekül heterolytisch zu spalten, so dass ein Br+ - und ein Br--Ion entstehen. Das Br--Ion lagert sich dann an die freie Kugelwolke des AlBr3 an, und es entsteht der AlBr4-.-Komplex. Das Br+-Ion greift dann als Elektrophil das Benzol-Molekül an. Logischerweise muss jetzt das Br2-Molekül wieder als Lewis-Base angesehen werden.
Weitere Lewis-Säuren
(Liste direkt aus der Wikipedia übernommen)
- Hart: H+; Li+; Na+; K+; Be2+; Mg2+; Ca2+; BF3; BCl3; Al3+; AlCl3; AlH3; Cr3+; Fe3+; Co3+; Ti4+; Cr6+; Mn2+; Ga3+
- Grenzbereich: B(CH3)3; Zn2+; Ni2+; Co2+; Fe2+; Cu2+; Pb2+; Rh3+; Ir3+; Ru3+
- Weich: Pt2+; Pt4+; Pd2+; Au+; Hg2+; Hg22+; Cd2+; Cu+; BH3; Ag+; Tl+; Ge2+; Rh+; Ir+; Ru2+.
Wo es Lewis-Säuren gibt, gibt es natürlich auch Lewis-Basen, die auf dieser Seite näher dargestellt werden.
Das Säure-Base-Konzept von Lewis wurde 1963 von Pearson erweitert. Einzelheiten dazu finden Sie auf dieser Seite.