Struktur
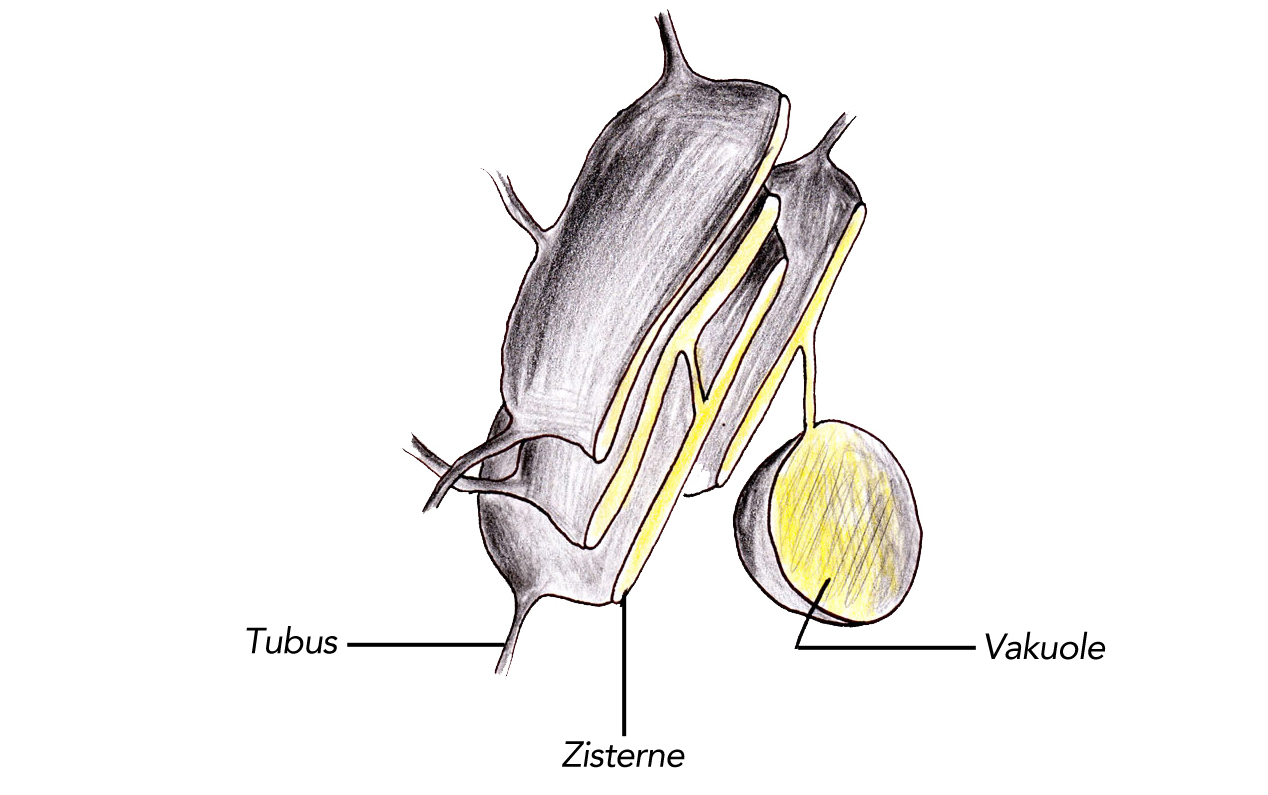
Ausschnitt aus dem endoplasmatischen Reticulum
Autor: Ulrich Helmich 1978, Lizenz: Public domain
Das endoplasmatische Reticulum (kurz: ER) stellt das größte Membransystem der eukaryotischen Zellen dar. Prokaryoten haben keine Organelle, also auch kein ER.
Das Hohlraumsystem des ER besteht aus Tubuli (Röhren), Zisternen (flache Kammern) und Vakuolen (große Hohlräume), die miteinander in Verbindung stehen. Zu diesem Hohlraumsystem ER gehört auch die Kernhülle[2]. In vielen eukaryotischen Zellen stellt das ER mehr als die Hälfte der gesamten Membranfläche[1]. Das ER beansprucht oft mehr als 10% des Zellvolumens [5].
Eine ausführliche Darstellung des Themas "Kernhülle" finden Sie auf der entsprechenden Lexikon-Seite auf dieser Homepage.
Die Flüssigkeit im Innern des ER unterscheidet sich in ihrer chemischen Zusammensetzung deutlich vom Cytoplasma.
Es wird zwischen glattem und rauem ER unterschieden. Das raue EF ist dicht mit Ribosomen besetzt, das gilt auch für die äußere Membran der Kernhülle. Das glatte EF ist dagegen frei von Ribosomen. In der Abb. 1 sieht man glattes ER.
Das ER ist kein statisches System, sondern ein dynamisches. Es entstehen also ständig neue Vakuolen, Zisternen und Tuben, während gleichzeitig alte Strukturen des ER abgebaut und wiederverwertet werden. Bei diesen Prozessen spielen die Mikrotubuli der Zelle eine wichtige Rolle[4].
Glattes ER
In den meisten Zellen ist das glatte, nicht mit Ribosomen besetzte ER nicht so stark vertreten wie das raue ER. Im glatten ER findet vor allem die Synthese von Lipiden statt, die in die verschiedenen Membranen der Zelle eingebaut werden. Zellen, die hauptsächlich Lipide herstellen, haben entsprechend große Mengen an glattem ER.
Einzelheiten zu diesen beiden Themen finden Sie in dieser Zellbiologie-Abteilung auf den beiden hier genannten Seiten.
Wenn diese Bestandteile der Zellmembran in glatten ER hergestellt worden sind, schnüren sich kleine Vesikel vom ER ab und wandern zur Zellmembran. Dort verschmelzen sie mit dieser (Membranfusion). So gelangen die Lipide in die Zellmembran. Diese Bereiche des glatten ER, von denen sich die ER-Vesikel abschnüren, werden auch als transitorisches ER bezeichnet.
Auch die Geschlechtshormone der Wirbeltiere und andere wichtige Hormone werden im glatten ER hergestellt. Deswegen sind die Zellen der Keimdrüsen (Hoden, Eierstöcke) sehr reich an glattem ER [1].
Bestimmte Proteine und auch kleinere Moleküle, die in das ER aufgenommen wurden, können im glatten ER chemisch verändert werden [6].
Bei der Umwandlung des Speicherpolysaccharids Glycogen in Glucose in der Leber der Wirbeltiere spielt das glatte ER der Leberzellen eine wichtige Rolle. Wenn Glycogen in den Leberzellen gespalten wird, entsteht nicht sofort Glucose, sondern zunächst Glucose-6-phosphat. Enzyme in der Membran des glatten ER sind nun dafür verantwortlich, dass die Phosphatgruppe vom Glucose-6-Phosphat abgespalten wird. Erst dann können die Leberzellen reine Glucose in das Blut abgeben, wodurch der Blutzuckerspiegel erhöht wird.
Auch bei einer weiteren Funktion spielt das glatte ER der Leberzellen eine wichtige Rolle, bei der Entgiftung von bestimmten Toxinen (Giftstoffen) und Medikamenten nämlich. Enzyme des glatten ER heften nämlich Hydroxid-Gruppen (OH-Gruppen) und andere polare Gruppen an diese Giftstoffe, damit werden sie besser wasserlöslich (Bildung von H-Brücken) und können schneller aus dem Körper ausgespült werden.
Nicht nur in Muskelzellen spielt das glatte ER - hier als sarkoplasmatisches Reticulum bezeichnet - als Calciumionen-Speicher eine wichtige Rolle. Wird eine Muskelzelle elektrisch erregt, strömen jede Menge Calcium-Ionen aus dem glatten ER in das Cytoplasma. Dort lösen die Ionen dann die Kontraktion der Muskelfasern aus [3]. Die Konzentration der Calcium-Ionen im Lumen des ER beträgt dank vieler aktiver Calciumpumpen in der Membran des ER ca. 10-3 mol/l, während die Ca2+-Konzentration im Cytosol bei 10-7 mol/l liegt. Im ER ist also die Calciumionen-Konzentration 10.000 mal so hoch wie im Cytoplasma. Bestimmte Calcium speichernde Enzyme im ER halten diese hohe Ca2+-Konzentration aufrecht [5].
Raues ER
Die Synthese neuer Proteine findet an den Ribosomen des Zellplasmas statt. Die meisten dieser Ribosomen heften sich an das raue ER. Wenn nun ein Ribosom mit der Translation beginnt, wird die entstehende Polypeptidkette in das Lumen des ER abgegeben - und zwar noch während der laufenden Translation (kotranslationaler Prozess) [5]. Dabei spielen bestimmte Proteine in der Membran des ER eine wichtige Rolle. Diese Proteine dienen einerseits zur Anheftung der Ribosomen, andererseits bilden sie eine Röhre in der ER-Membran, durch die die wachsende Polypeptidkette in das ER-Lumen gelangt.
Außerdem muss das entstehende Peptid oder Proteine mit einer bestimmten ER-Signalsequenz von Aminosäuren beginnen, damit die ER-Enzyme es als "gültig" erkennen [5].
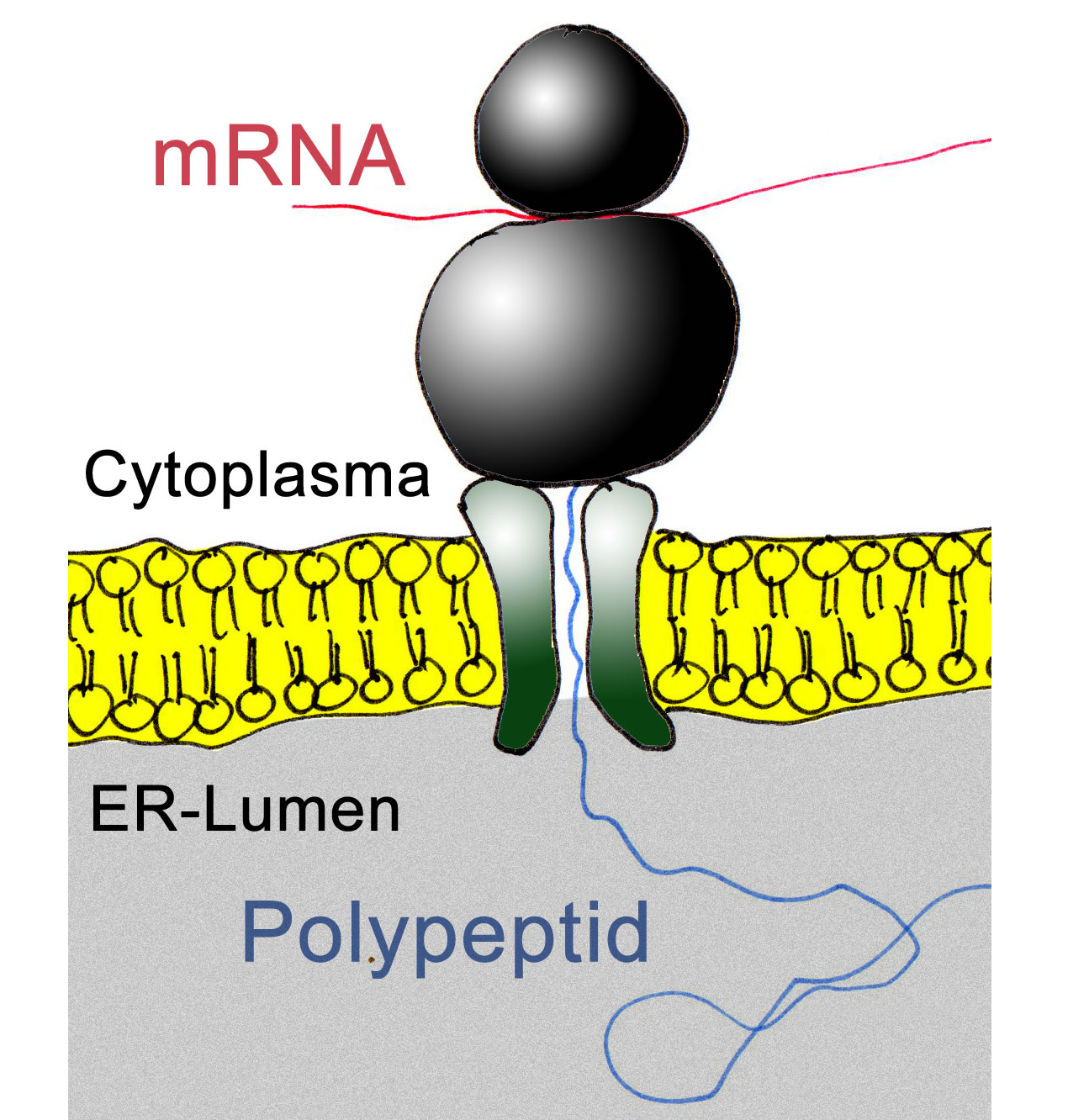
Proteinsynthese am rauen ER
Autor: Ulrich Helmich, Lizenz: Public domain
Von den Ribosomen des rauen ER werden die synthetisierten Peptidketten direkt in das ER-Lumen abgegeben und dann in bestimmten ER-Zisternen angereichert. Dort werden sie nicht nur aufbewahrt und angereichert, sondern die in den Zisternen gespeicherte Peptide (und andere Stoffe) können chemisch verändert werden.
Proteinfaltung
Die Polypeptidketten sind nach der Translation zunächst linear, bilden also eine lange Kette, was aber energetisch sehr ungünstig ist. Teils faltet sich diese Kette von selbst zu einer energetisch günstigeren Struktur, teils helfen Enzyme des ER-Lumens bei dieser Proteinfaltung mit (sogenannte Chaperone). Defekte Polypeptidketten werden von anderen Enzymen erkannt und wieder ins Zellplasma transportiert. Das ER ist also dafür verantwortlich, dass die Primärstruktur der Proteine in eine Tertiärstruktur umgewandelt wird (die Sekundärstrukturen bilden sich meistens von selbst).
Das Beispiel Insulin zeigt, dass die Eingriffe von ER-Enzymen in die Proteinstruktur auch drastischer sein können. Die Ribosomen geben zunächst eine relativ lange prä-Insulin-Kette in das ER-Lumen ab. Dort wird diese Kette zweimal durchgeschnitten, so dass drei kleinere Peptidketten entstehen. Zwei dieser Peptidketten werden dann im ER wieder zusammengeknüpft, und zwar mit Hilfe von Disulfid-Brücken [2].
Chemische Modifikation von Proteinen
An andere Proteine und auch an manche Lipide werden Zuckerketten oder andere Reste angeheftet, so entstehen dann die Glycolipide und Glycoproteine.
Außerdem werden die Proteine im rauen ER mit Signalsequenzen ausgestattet. Mit Hilfe dieser Signalsequenzen können die synthetisierten Proteine gezielt zu ihren späteren Bestimmungsorten transportiert werden. Vor allem für die Enzyme, die für die Lysosomen bestimmt sind, sind solche Signalsequenzen wichtig [6]. Bei diesen Enzymen handelt es sich nämlich um recht aggressive Verdauungsenzyme. Gelangen diese zu einem falschen Zielort, ist das für die Zelle nicht so günstig; im schlimmsten Fall wird die Zelle durch die für die Lysosomen bestimmten Enzyme zerstört.
Bei sekretorischen Zellen (also zum Beispiel bei Drüsenzellen) gelangen die im ER gespeicherten Stoffe in ER-Vakuolen, die sich dann vom ER abschnüren und zum Golgi-Apparat transportiert werden. Dort verschmelzen sie mit Golgi-Zisternen, wo sie eventuell weiter chemisch verändert werden. Der Golgi-Apparat schließlich verpackt die modifizierten Stoff in Golgi-Vesikel, die dann zur Zellmembran wandern und dort mit ihr verschmelzen. Durch diese Exocytose gelangen die Sekrete dann nach außen [2][3]. Andere Proteine gelangen über ER-Vesikel direkt zur Zellmembran oder zu anderen Zellorganellen.
Günter Blobel erhielt 1999 den Medizin-Nobelpreis für die Entdeckung, dass die Proteine selbst bestimmen, zu welchem Zielort sie gelangen. Bei der Proteinsynthese wird jedes Protein mit einer kurzen Signalsequenz ausgestattet, welche den Zielort festlegt. Nach dem Transport des Proteins durch die Membran des ER wird diese Signalsequenz von Enzymen abgespalten, und Proteine, die zur Membran oder zu anderen Zellorganellen versandt werden sollen, werden in Transportvesikel verpackt und dann auf den Weg geschickt. Dabei spielt das Cytoskelett eine entscheidende Rolle, es stellt sozusagen die Straßen oder Schienen für die Transportvesikel dar.
Zusammenarbeit von Kernmembran, Ribosomen, ER und Golgi-Apparat
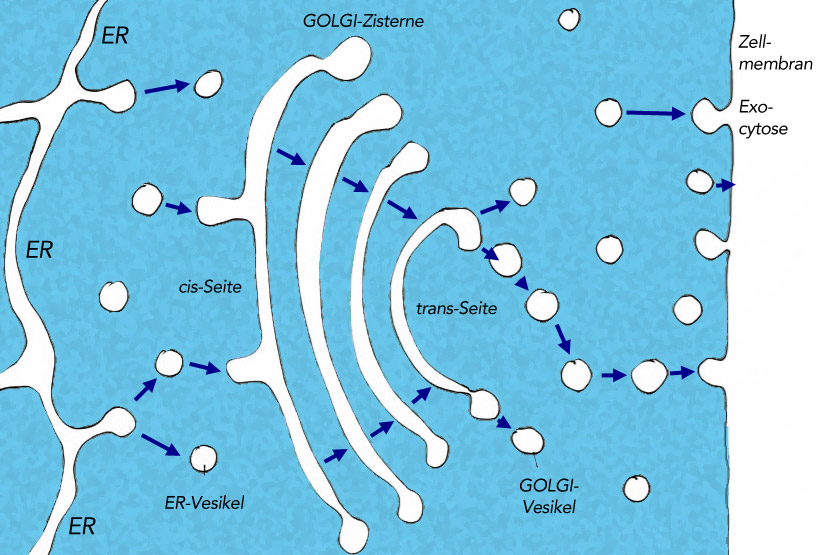
ER, Golgi-Apparat und Zellmembran
Autor: Ulrich Helmich, Lizenz: Public domain
Dieses Bild zeigt den Membranfluss innerhalb einer Zelle. Das ER schnürt Vesikel ab, die mit bestimmten Verbindungen gefüllt sind (beispielsweise Phospholipiden, Proteinen, Hormonen). Diese Membranvesikel gelangen zur Cis-Seite des Golgi-Apparates und verschmelzen dort mit einer Golgi-Zisterne. So gelangen die Verbindungen in den Golgi-Apparat, wo sie chemisch modifiziert werden. Wenn die modifizierten Verbindungen auf der trans-Seite des Golgi-Apparates angekommen sind, werden sie wieder in Vesikel verpackt und gelangen dann zur Zellmembran, mit der sie verschmelzen. Die Verbindungen werden dann entweder in die Membran eingebaut (das ist zum Beispiel bei den Phospholipiden und Membranproteinen der Fall) oder sie werden sezerniert, also außerhalb der Zelle abgegeben (Exocytose, das ist zum Beispiel bei Botenstoffen wie Hormonen oder Neurotransmittern der Fall).
Auf dieser Seite wird der Membranfluss innerhalb der Zelle noch einmal sehr ausführlich erläutert.
Quellen:
- Campbell, Biologie gymnasiale Oberstufe (2011)
- Mitschrift einer Vorlesung "Allgemeine Biologie" von Prof. Heckmann, Münster
- Urry, Cain, Wassermann, Minorsky, Reece. Campbell Biologie, Hallbergmoos 2019, 11.Auflage.
- Wikipedia, Artikel "Endoplasmatisches Reticulum"
- Alberts, Bruce et al. Lehrbuch der Molekularen Zellbiologie, 5. Auflage, Weinheim 2021.
- Savada, Hillis, Heller, Hacker: Purves Biologie, Springer Verlag Deutschland 2019, 10. Auflage. Herausgegeben von Jürgen Markl.