Der Eisennagel-Versuch
Zunächst einmal machen wir einen einfachen aber sehr wichtigen Versuch:
Lies dir zunächst die Versuchsanleitung und dann die Beobachtungen durch. Die Erklärung dazu findetst du dann auf dieser Seite.
Bei dem rotbraunen Belag handelt es sich nicht etwa um Rost, sondern um reines Kupfer. Es hat folgende Redoxreaktion stattgefunden:
$Cu^{2+}(aq) + Fe(s) \to Fe^{2+}(aq) + Cu(s)$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Bei den bisher besprochenen Redoxreaktionen hat immer ein Metall wie Natrium oder Magnesium mit einem Nichtmetall wie Chlor oder Sauerstoff reagiert. Das Metall war der Elektronendonator und hat ein, zwei oder drei Elektronen an das Nichtmetall abgegeben, welches die Rolle des Elektronenakzeptors gespielt hat.
Die Reaktion zwischen Eisen und Kupfersulfat passt nicht in dieses Schema. Hier reagiert ein Metall mit den Ionen eines anderen Metalls.
Die Eisen-Atome geben Elektronen an die Kupfer-Ionen ab, so dass Eisen-Ionen und Kupfer-Atome entstehen. Offensichtlich hat das Kupfer ein größeres "Bedürfnis" zur Elektronenaufnahme als Eisen, während das Eisen eine größere "Neigung" zur Elektronenabgabe hat als Kupfer.
Stellen wir für die obige Redoxreaktion die klassischen Teilgleichungen auf, also erst die Oxidation, dann die Reduktion und schließlich die Gesamtreaktion, die dann als Redoxreaktion bezeichnet wird:
$Fe(s) \to Fe^{2+}(aq) + 2 e^{-} \ \ \ \ (Oxidation)$
$Cu^{2+}(aq) + 2 e^{-} \to Cu(s) \ \ \ \ (Reduktion)$
---------------------------------------------------------------
$Cu^{2+}(aq) + Fe(s) \to Fe^{2+}(aq) + Cu(s) \ \ \ \ (Redoxreaktion)$
Eine zahlenmäßige Anpassung der beiden Gleichungen ist nicht notwendig, da bei der Oxidation genau so viele Elektronen abgegeben werden wie bei der Reduktion benötigt werden.
Weitere Versuche dieser Art
Wenn wir ein Kupferblech in eine Eisensulfat-Lösung stellen, passiert gar nichts. Eine Elektronenübertragungsreaktion vom Kupfer zu den Eisen-Ionen findet also nicht statt, offensichtlich ist dieser Elektronentransfer eine "Einbahnstraße".
Die Elektronen fließen nur vom Eisen zu den Kupfer-Ionen, nicht aber vom Kupfer zu den Eisen-Ionen.
Schau dir nun diesen Versuch an. Wenn man den Kupfernagel für ein paar Tage in der Silbernitrat-Lösung stehen lässt, bildet sich ein dicker Pelz aus Silberkristallen. Die Erklärungen für diesen Versuch findest du dann wieder im folgenden Abschnitt.
Die Redoxreaktion, die bei diesem Versuch abläuft, sieht so aus:
$2 \ Ag^{+}(aq) + Cu(s) \to Cu^{2+}(aq) + 2 \ Ag^{+}(s)$Die Kupfer-Atome geben Elektronen an die Silber-Ionen ab. In umgekehrter Richtung funktioniert die Reaktion nicht. Silber-Atome geben nur "ungern" Elektronen ab, während Silber-Ionen "gern" Elektronen aufnehmen. So ist das eben bei edlen Metallen. Unedle Metalle wie Natrium oder Magnesium geben "sehr gern" Elektronen ab. Wenn sie danach als Kation vorliegen (Kation = positiv geladenes Ion) nehmen sie nur "ungern" wieder Elektronen auf. Sie besitzen dann ja auch eine vollständige Außenschale und befinden sich im Edelgaszustand (Oktettregel).
Man kann nun weitere Versuche dieser Art durchführen (und macht das im Schulunterricht auch). Wenn man beispielsweise einen Eisennagel in eine Silbernitrat-Lösung stellt, so bildet sich auch hier ein Belag aus reinem Silber. Und stellt man Magnesium in eine Eisensulfat-Lösung, so bildet sich auf dem Magnesium ein Eisen-Belag, weil Eisen edler ist als Magnesium und die Mg-Atome daher "gern" Elektronen an die Eisen-Ionen abgeben.
Wenn man viele solcher Versuche systematisch durchgeführt hat, kommt man zur sogenannten Redoxreihe der Metalle, die sich graphisch ungefähr so darstellt:
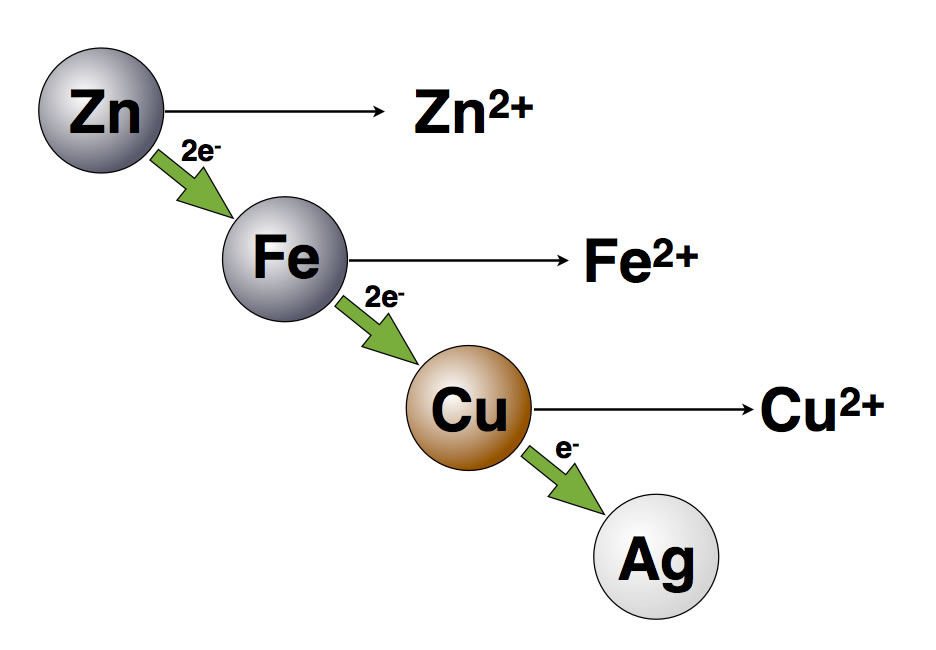
Eine einfache Redoxreihe der Metalle
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
In dieser Zeichnung sind allerdings nur vier Metalle berücksichtigt worden. Das Zink ist am unedelsten, das Eisen ist unedler als Kupfer, und Kupfer ist unedler als Silber. Magnesium beispielsweise ist noch unedler als Zink, während Gold wiederum noch edler ist als Silber. Auf diese Weise kann man sämtliche Metalle, die es gibt, in dieser Redoxreihe unterbringen. Wer sich mehr dafür interessiert, geht auf die Seite, die für Oberstufenkurse geschrieben wurde.
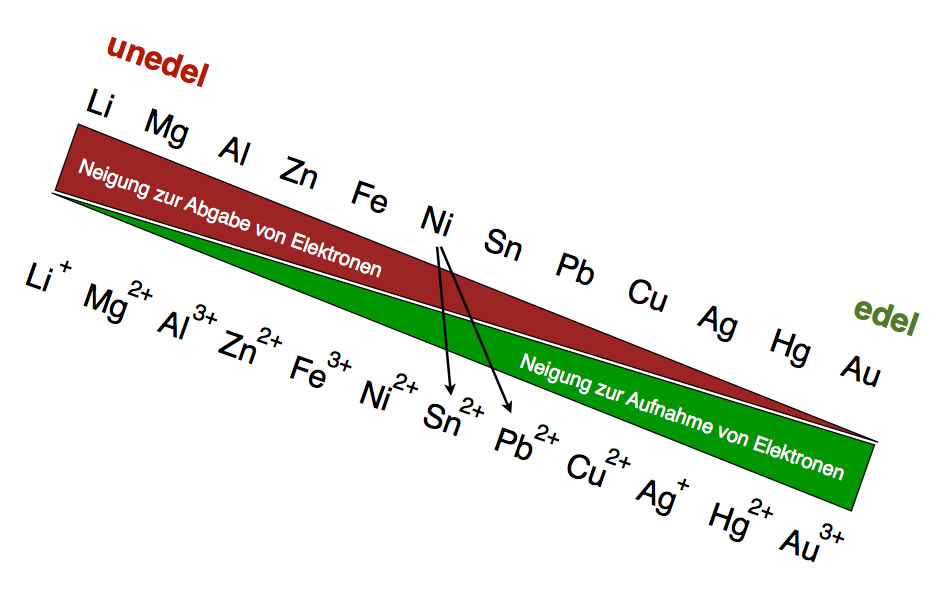
Eine bessere Redoxreihe der Metalle
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Zum Schluss noch eine erweiterte Version der Redoxreihe mit zwölf Metallen. Mit Hilfe einer solchen Graphik kann man chemische Reaktionen vorhersagen. Wenn man zum Beispiel ein Zink-Blech (Zn) in eine Bleisulfat-Lösung stellt, so erhält man eine Reaktion; es bildet sich ein Blei-Belag um das Zinkblech. Blei (Pb) ist edler als Zink, nimmt also "gern" Elektronen auf. Stellt man dagegen ein Blei-Blech in eine Zinksulfat-Lösung, so kommt es nicht zur Reaktion. Wenn man das Blei-Blech aber in eine Kupfersulfat-Lösung stellt, läuft wieder eine Redoxreaktion ab.
Zusammenfassung:
Reaktionen zwischen Metallatomen und Metallionen
Eine häufig vorkommende Redoxreaktion ist die Übertragung von Elektronen von einem Metall auf die Kationen eines anderen Metalls. Diese Elektronenübertragungsreaktion ist ein Beispiel für Donator-Akzeptor-Reaktionen.
Die Neigung zur Abgabe von Elektronen ist von Metall zu Metall unterschiedlich. Die unedlen Metalle geben relativ leicht Elektronen ab, während die edlen Metalle ihre Elektronen lieber behalten. Ordnen man die Metalle nach abnehmender Neigung zur Elektronenabgabe, so erhält man die Redoxreihe der Metalle - hier ein kleiner Ausschnitt:

Die einfache Redoxreihe der Metalle
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Unedlere Metalle können ihre Elektronen nur "bergab" an die Kationen von edleren Metallen abgeben, Zink kann beispielsweise Elektronen an Eisen-Ionen, Kupfer-Ionen oder Silber-Ionen abgeben. Der umgekehrte Weg "bergauf" ist nicht möglich, so kann zum Beispiel Kupfer keine Elektronen an Eisen-Ionen abgeben.