Kompetenzen
Wenn du diese Seite durchgearbeitet hast, solltest du
- die Eigenschaften von sauren Lösungen mit dem Vorhandensein von Oxonium-Ionen erklären können.
Konkrete Lernziele
Wenn du diese Seite durchgearbeitet hast, solltest du
- beschreiben können, wie man aus Kochsalz und konz. Schwefelsäure Salzsäure herstellen kann,
- die einzelnen Beobachtungen dieses Versuchs deuten können,
- die Reaktionsgleichung aufstellen können, die die Bildung der Oxonium-Ionen aus Chlorwasserstoff- und Wasser-Molekülen zeigt,
- erläutern können, wie ein Oxonium-Ion nach dem Kugelwolkenmodell aufgebaut ist,
- angeben können, dass der saure Charakter von sauren Lösungen durch die Anwesenheit von Oxonium-Ionen bedingt wird.
- die Summenformeln der wichtigsten Säuren sowie die Namen der Säurerest-Ionen kennen,
- die Reaktionsgleichungen aufstellen können, die zeigen, wie Salpetersäure und Schwefelsäure mit Wasser Oxonium-Ionen bilden,
- den Unterschied zwischen ein-, zwei- und dreiprotonigen Säuren erläutern können.
Inhalte dieser Webseite
Herstellung einer sauren Lösung
Wenn man als Lehrer oder Lehrerin demonstrieren will, wie eine saure Lösung hergestellt wird, könnte man natürlich einfach konzentrierte Essigsäure mit dest. Wasser verdünnen. Dieser Versuch ist allerdings nicht besonders interessant. Aus der konzentrierten Säure wird eben eine verdünnte, das war's. Schüler wird man damit nicht begeistern können, Schülerinnen auch nicht.
Viel interessanter und vor allem lehrreicher ist der Versuch, bei dem man Chlorwasserstoff herstellt und das gasförmige Reaktionsprodukt dann auf eine Wasseroberfläche leitet.
Dieser Versuch zeigt, wie man Salzsäure aus Kochsalz herstellt. Der Versuch ist nicht als Schülerversuch geeignet und muss im Abzug von der Lehrperson durchgeführt werden.
Wichtig: Ihr müsst euch diese Seite zunächst gründlich durchlesen, bevor ihr hier weitermacht, sonst versteht ihr von dem folgenden Text nur die Hälfte.
Erste Deutung der Beobachtungen Top
Die Beobachtungen sprechen dafür, dass sich in dem Becherglas eine saure Lösung gebildet hat.
Beobachtung 2
In dem grün gefärbten Wasser bilden sich zunächst an der Oberfläche rote Schlieren, die sich im Laufe des Versuchs nach unten ausbreiten.
Die Rotfärbung des Universalindikators zeigt eindeutig, dass aus dem dest. Wasser eine saure Lösung entstanden ist.
Zur Erinnerung:
Saure Lösung = Lösung einer Säure in Wasser.
Beobachtung 3
Vor Beginn des Versuchs konnte in dem Wasser so gut wie keine elektrische Leitfähigkeit nachgewiesen werden, nach Beendigung des Versuchs ist die elektrische Leitfähigkeit relativ hoch.
Der deutliche Anstieg der elektrischen Leitfähigkeit in dem Wasser zeigt uns an, dass sich während des Versuchs Ladungsträger in dem Wasser gebildet haben. In der Chemie wässriger Lösungen kommen als Ladungsträger nur Ionen in Frage.
Zur Erinnerung:
- Ionen = Elektrisch geladene Atome oder Moleküle.
- Kationen = positiv geladene Ionen.
- Anionen = negativ geladene Ionen.
Beobachtung 4
Tropft man nach Beendigung des Versuchs Silbernitratlösung in das Wasser, bildet sich ein gelbweißer Niederschlag oder zumindest eine helle Trübung.
Die elektrische Leitfähigkeit zeigt uns an, dass die Lösung nach dem Versuch Ionen enthält, und die Reaktion mit Silbernitratlösung zeigt, dass es sich bei einem Teil dieser Ionen um Chlorid-, Bromid- oder Iodid-Ionen handeln muss, denn mit anderen Ionen bildet Silbernitrat keinen Niederschlag.
Bei dem Versuch hat zunächst konz. Schwefelsäure mit Kochsalz reagiert. Kochsalz ist nichts anderes als Natriumchlorid NaCl. Bei dieser Reaktion ist Chlorwaserstoff nach der folgenden Reaktionsgleichung entstanden:
$H_{2}SO_{4} + 2 \ NaCl \to 2 \ HCl + Na_{2}SO_{4}$
Der gasförmige Chlorwasserstoff HCl wird dann auf die Wasseroberfläche in dem Becherglas weitergeleitet. Dort findet dann die Reaktion mit Waser statt. Dabei geben die HCl-Moleküle jeweils ein Proton an ein Wasser-Molekül ab:
$HCl + H_{2}O \to H_{3}O^{+} + Cl^{-}$
Die entstehenden Chlorid-Ionen sind mit der Silbernitratlösung nachgewiesen worden. Dabei ist schwerlösliches Silberchlorid entstanden:
$AgNO_{3} + HCl \to AgCl\downarrow + HNO_{3}$
Die eher unwichtigen Aspekte des Versuch hätten wir damit geklärt. Kommen wir nun zu der wichtigsten Erkenntnis dieses Versuchs. Was sind das eigentlich für "komische" Ionen, die sich gebildet haben, als die gasförmigen HCl-Moleküle Protonen an H2O-Moleküle abgegeben haben? H3O+, gibt es so etwas überhaupt?
Oxonium-Ionen Top
Die H3O+-Ionen, die bei dem Versuch entstanden sind, gibt es tatsächlich, sie werden als Oxonium-Ionen bezeichnet. In älteren Chemiebüchern findet man manchmal noch den Begriff Hydronium-Ionen, aber dieser Begriff hat heute eine etwas andere Bedeutung, in modernen Büchern wird nur noch der Begriff Oxonium-Ion verwendet.
Das Wasser-Molekül besteht ja bekanntlich aus einem Sauerstoff-Atom und zwei Wasserstoff-Atomen. Das Sauerstoff-Atom hat aber noch zwei freie Elektronenpaare. Nach dem Kugelwolkenmodell sieht ein Wasser-Molekül folgendermaßen aus:
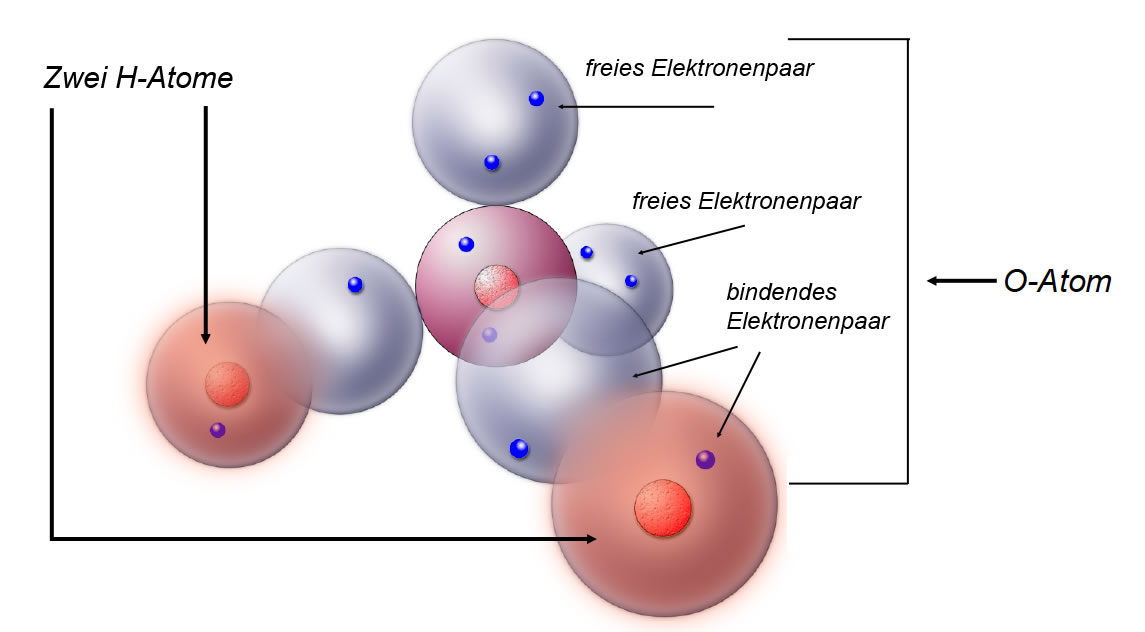
Ein Wasser-Molekül nach dem Kugelwolkenmodell
Autor: Ulrich Helmich 2018, Lizenz: Public domain.
Ganz perfekt ist die Zeichnung noch nicht. Die rot gezeichneten einfach besetzten Kugelwolken der H-Atome überlappen mit den blau gezeichneten einfach besetzten Kugelwolken des O-Atoms zu einer neuen gemeinsamen Kugelwolke, die dann die beiden Elektronen enthält. Beide Elektronen halten sich dann in der neuen bindenden Kugelwolke auf und werden als bindendes Elektronenpaar bezeichnet. In der Zeichnung sieht es aber noch so aus, als würde sich jedes Elektron nur in seiner eigenen Kugelwolke aufhalten.
Wie kann man nun die Bildung der Oxonium-Ionen erklären?
Stellen wir uns ein Proton vor. Was ist das eigentlich? Ein Wasserstoff-Atom besteht wie jedes Atom aus einem Atomkern und einer Elektronenhülle. Beim Wasserstoff befindet sich im Atomkern aber nur ein einziges Elementarteilchen, nämlich ein Proton. Neutronen sind im normalen Wasserstoff nicht vorhanden.
Verliert ein Wasserstoff-Atom nun sein einziges Elektron, so liegt nur noch das Proton des Atomkerns vor. Die Kugelwolke, die das Proton im H-Atom umgibt, ist jetzt leer.
Spitzfindige Chemie-Philosophen könnten nun natürlich die Frage aufwerfen, ob eine leer Kugelwolke überhaupt existiert. Eine Kugelwolke ist ja nichts anderes, also der Raumbezirk, in dem sich ein Elektron mit einer Wahrscheinlichkeit von 95% oder 99% aufhält. Wenn aber kein Elektron mehr vorhanden ist, existiert definitionsgemäß auch keine Kugelwolke mehr. In der praktischen Chemie ist man aber nicht ganz so spitzfindig, sondern sieht die Sache etwas lockerer und vor allem pragmatischer: Eine Kugelwolke kann durchaus leer sein, weil man mit leeren Kugelwolken viele interessante Phänomene erklären kann, wie zum Beispiel die Bildung von Oxonium-Ionen.
Nach der Oktettregel "wollen" Atome aber eine vollbesetzte Außenschale bzw. vollbesetzte Kugelwolken haben. Wasserstoff-Atome streben also den Edelgaszustand des Helium-Atoms mit einer doppelt besetzten Kugelwolke an.
Wie könnte denn ein Proton seine leer Kugelwolke mit zwei Elektronen auffüllen, um den Helium-Zustand zu erreichen?
Moment mal - sind da nicht Wasser-Moleküle in der Nähe, und bieten deren O-Atome nicht doppelt besetzte Kugelwolken quasi umsonst an, die gerade nichts zu tun haben?
Genau! Ein Proton kann sich nun mit seiner leeren Kugelwolke mit einer doppelt besetzten Kugelwolke eines O-Atoms vereinigen, und schon hat man eine neue kovalente Bindung mit zwei Bindungselektronen hergestellt:
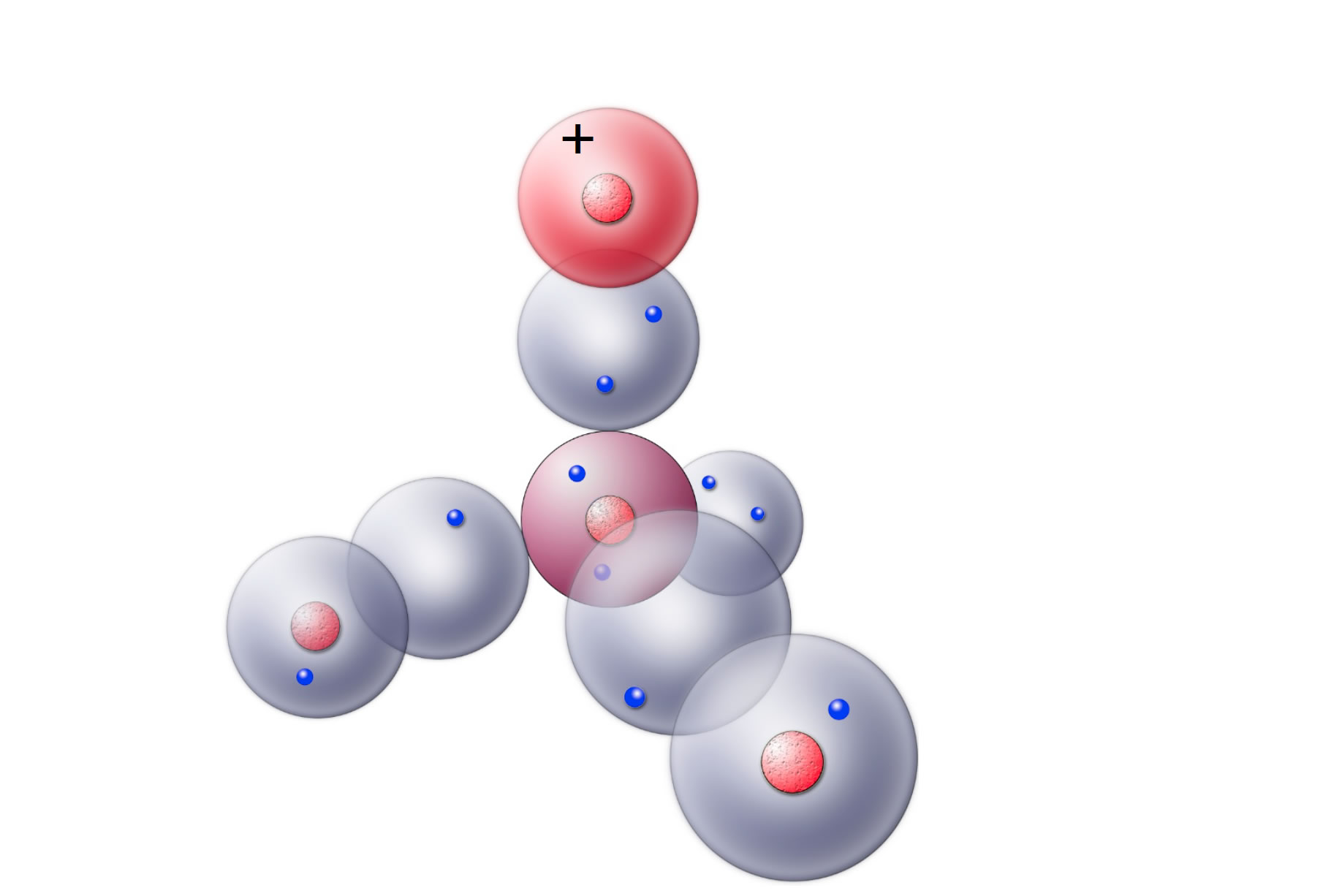
Ein Oxonium-Ion nach dem Kugelwolkenmodell
Autor: Ulrich Helmich 2018, Lizenz: Public domain.
Diese Abbildung zeigt ein Oxonium-Ion, dargestellt nach dem Kugelwolkenmodell. Das "obere" freie Elektronenpaar des O-Atoms hat sich mit der leeren Kugelwolke eines Protons vereinigt. Aus H2O und H+ ist das Oxonium-Ion H3O+ entstanden.
Zusammenfassung
Die HCl-Moleküle des Chlorwasserstoff-Gases reagieren mit H2O-Molekülen des Wassers zu Oxonium-Ionen H3O+. Bei der Reaktion bleiben dann Chlorid-Ionen Cl- übrig. Solche Anionen, die bei der Abgabe eines Protons entstehen, werden allgemein als Säurereste oder Säurerest-Anionen bezeichnet.
Überlegung
Das Oxonium-Ion H3O+ besitzt noch eine weitere mit zwei Elektronen besetzte Kugelwolke. Theoretisch könnte sich also noch ein weiteres Proton an das Ion anlagern zum H4O2+. Warum passiert das nicht?
Ein Oxonium-Ion ist positiv geladen, ein Proton ebenso. Wenn sich ein weiteres Proton einem Oxonium-Ion nähert, wird dieses elektrisch abgestoßen. Daher ist die Existenz von H4O2+zwar nicht unmöglich, aber doch sehr unwahrscheinlich.
Säuren und ihre Säurerest-Ionen Top
Auf der ersten Seite dieses Kurses hatten wir bereits zwischen Säuren und sauren Lösungen unterschieden. Nach den Erkenntnissen, die wir aus dem Versuch 2, den Beobachtungen und vor allem den Deutungen gewonnen haben, kann man die Definitionen der Begriffe Säure und saure Lösung jetzt etwas genauer fassen:
Säuren sind Teilchen, welche in der Lage sind, ein oder mehrere Protonen an Wasser-Moleküle abzugeben, wobei sich Oxonium-Ionen und Säurerest-Ionen bilden.
Daher werden Säuren auch als Protonendonatoren bezeichnet, von lateinisch donare = abgeben, spenden.
Saure Lösungen sind wässrige Lösungen, die Oxonium-Ionen und Säurerest-Ionen enthalten.
Das wohl bekannteste Beispiel ist die Salzsäure, die ihren Namen eigentlich gar nicht verdient. Denn Salzsäure ist die wässrige Lösung von Chlorwasserstoff HCl. Also ist Chlorwasserstoff HCl(g) die Säure, und Salzsäure HCl(aq) ist eine saure Lösung mit Oxonium-Ionen und Chlorid-Ionen als Säurerest-Ionen.
Betrachten wir nun die beiden anderen wichtigen technischen Säuren, Schwefelsäure und Salpetersäure. Wie reagieren diese beiden Säuren mit Wasser?
Salpetersäure
Die Salpetersäure hat nur ein Proton zur Verfügung, das sie abgeben kann. Bei der Reaktion mit Wasser entstehen Oxonium-Ionen und Nitrat-Ionen NO3- als Säurerest-Ionen:
$HNO_{3} + H_{2}O \to H_{3}O^{+} + NO_3^{-}$
Schwefelsäure
Etwas komplizierter wird es bei der Schwefelsäure H2SO4. Die Moleküle der Schwefelsäure haben nämlich zwei Wasserstoff-Atome, die sie als Protonen abgeben können. Zuerst wird aber nur ein Proton abgespalten:
$H_2SO_4 + H_2 O \to H_3 O^{+} + HSO_4^{-}$
Das Säurerest-Ion, das sich in diesem Reaktionsschritt bildet, wird als Hydrogensulfat-Ion bezeichnet. Diese Hydrogensulfat-Ionen können das noch vorhandene H-Atom in einem zweiten Reaktionsschritt an Wasser-Moleküle abgeben:
$HSO_4^{-} + H_2O \to H_3O^{+} + SO_4^{2-}$
Wieder entstehen Oxonium-Ionen, und die Säurerest-Ionen werden jetzt als Sulfat-Ionen bezeichnet.
Phosphorsäure (für Chemie-Profis)
Noch komlizierter wird die Sache bei der Phosphorsäure H3PO4, weil hier drei H-Atome vorhanden sind, die als Protonen abgegeben werden können.
Schritt 1: Bildung von Dihydrogenphosphat-Ionen
$H_3PO_4 + H_2O \to H_3O^+ + H_2PO_4^-$
Schritt 2: Bildung von Hydrogenphosphat-Ionen
$H_2PO_4^-+ H_2O \to H_3O^+ + HPO_4^{2-}$
Schritt 3: Bildung von Phosphat-Ionen
$ HPO_4^{2-} + H_2O \to H_3O^+ + PO_4^{3-}$
Säuren wie HCl oder HNO3, die nur ein Proton abgeben können, bezeichnet man übrigens als einprotonige Säuren, Säuren wie H2SO4 als zweiprotonige Säuren und Säuren wie H3PO4 logischerweise als dreiprotonige Säuren.