Kompetenzen*
Wenn du diese Seite durchgearbeitet hast, solltest du
- Protonendonatoren als Säuren und Protonenakzeptoren als Basen klassifizieren können,
- an einfachen Beispielen die Vorgänge der Protonenabgabe und -aufnahme beschreiben können,
- Neutralisationsreaktionen und Salzbildungen erläutern können.
Konkrete Lernziele
Wenn du diese Seite durchgearbeitet hast, solltest du
- das Säure-Base-Konzept von Arrhenius erklären und an selbst gewählten Beispielen verdeutlichen können,
- das Säure-Base-Konzept von Brønsted erklären und auf Neutralisationsreaktionen anwenden können,
- Unterschiede und Gemeinsamkeiten der beiden Konzepte aufzeigen können,
- begründen können, wieso NaOH nach Arrhenius eine Base ist, nach Brønsted jedoch nicht,
- begründen können, wieso NH3 nach Brønsted eine Base ist, nach Arrhenius aber nicht.
*Kompetenzen laut NRW Kernlehrplan Chemie von 2019.
Inhalte dieser Webseite
Das Säure-Base-Konzept von Arrhenius
Was sind Säuren?
Nach Arrhenius sind Säuren Wasserstoff-Verbindungen, die Protonen (also H+-Ionen) abgeben können, wenn sie in Wasser gelöst werden:
1. Beispiel Chlorwasserstoff
$HCl(g) \to H^{+}(aq) + Cl^{-}(aq)$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Der gasförmige Chlorwasserstoff HCl(g) wird gespalten in ein Proton und ein Chlorid-Ion. Das Symbol (aq) zeigt, dass beide Ionen in Wasser gelöst sind. Der Säurerest ist hier das Chlorid-Ion Cl-.
2. Beispiel Schwefelsäure
Schauen wir uns als zweites Beispiel die Schwefelsäure an, eine zweiprotonige Säure:
$H_2SO_4(l) \to 2 \ H^{+}(aq) + SO_4^{2-}(aq)$
Die flüssige konz. Schwefelsäure H2SO4(l) dissoziiert im Wasser in zwei Protonen und ein Sulfat-Ion, das wieder den Säurerest darstellt.
Was sind nun Basen?
Nach Arrhenius sind Basen Verbindungen, die Hydroxid-Ionen (also OH--Ionen) abgeben, wenn sie in Wasser gelöst werden.
3. Beispiel Natriumhydroxid
$NaOH(s) \to Na^{+}(aq)+ OH^{-}(aq)$
Die Hydroxid-Ionen sind bereits im festen Natriumhydroxid NaOH(s) (oft als Ätznatron bezeichnet) vorhanden. Beim Auflösen des Salzes werden dann die OH-(aq)-Ionen freigesetzt, die für die basischen Eigenschaften der Natronlauge verantwortlich sind. Die Na+-Ionen sind der Basenrest.
4. Beispiel Calciumhydroxid
Ein anderes Beispiel ist Calciumhydroxid, das in Wasser gelöst als Kalkwasser bezeichnet wird:
$Ca(OH)_2(s) \to Ca^{2+}(aq) + 2 \ OH^{-}(aq)$
Das feste Calciumhydroxid Ca(OH)2(s) löst sich im Wasser, dabei entstehen Hydroxid-Ionen und Calcium-Ionen Ca2+(aq), die hier wieder den Basenrest darstellen.
Basen neutralisieren Säuren
Schon früh in der Geschichte der Chemie wusste man, dass man saure Lösungen mit Hilfe von Basen neutralisieren kann. Wir wollen uns dazu das wohl bekannteste Beispiel anschauen: Die Neutralisation von Salzsäure mit Natronlauge.
5. Beispiel NaOH + HCl
$HCl + NaOH \to NaCl + H_2O$
Nach Arrhenius gibt das HCl-Molekül in wässriger Lösung ein Proton H+(aq) ab, das im Wasser gelöste NaOH spaltet sich in Na+(aq) und OH-(aq)-Ionen auf (siehe 3. Beispiel), und die Protonen und die Hydroxid-Ionen vereinigen sich dann zu Wasser-Molekülen:
$H^{+} Cl^{-} + Na^{+}OH^{-} \to Na^{+}Cl^{-} + H_2O$
So könnte man diese Reaktion aufschreiben, die Symbole (aq), (s) oder (l) wurden hier weggelassen, weil es sonst zu unübersichtlich wird.
Bei dieser Neutralisation entstehen aus einer sauren Lösung (Salzsäure) und einer basischen Lösung (Natronlauge) Wasser und ein Salz, in diesem Fall Natriumchlorid, auch als Kochsalz bekannt.
Um das bisher Gelernte noch weiter zu festigen, schauen wir uns ein zweites Beispiel für eine solche Neutralisation an.
6. Beispiel H2SO4 + KOH
$H_2SO_4 + 2 \ KOH \to K_2SO_4 + 2 \ H_2O$
Schwefelsäure ist eine sogenannte zweiprotonige Säure. Das heißt, ein Molekül Schwefelsäure kann nicht nur ein, sondern zwei H-Atome als Proton abgeben. Für die Neutralisation der Schwefelsäure werden also pro Schwefelsäure-Molekül zwei OH--Gruppen benötigt. Da eine KOH-Einheit aber nur je eine OH--Gruppe abgeben kann, werden pro Schwefelsäure-Molekül zwei KOH-Einheiten benötigt. Zwei Protonen und zwei Hydroxid-Gruppen vereinigen sich dann zu zwei Wasser-Molekülen.
Säure-Base-Konzept von Arrhenius
Säuren sind Verbindungen, die in wässriger Lösung Protonen abgeben können.
Basen sind Verbindungen, die in wässriger Lösung Hydroxid-Ionen abgeben können.
Fazit
Das Säure-Base-Konzept von Arrhenius kann viele Reaktionen von Säuren und Basen wie zum Beispiel die Neutralisation bzw. Salzbildung gut erklären. Für viele chemische Vorgänge, die in der Sekundarstufe I behandelt werden, reicht das Arrhenius-Konzept völlig aus. Allerdings hat dieses Säure-Base-Konzept ein paar Schwächen, die wir im nächsten Abschnitt kurz besprechen werden.
Schwächen
Arrhenius konnte nicht erklären, wieso die Lösung von Ammoniak in Wasser, das sogenannte Ammoniakwasser (auch als Salmiakgeist bekannt) basische Eigenschaften hat.
Eine Arrhenius-Base gibt bekanntlich Hydroxid-Ionen an die wässrige Lösung ab. Das Ammoniak besitzt aber keine OH-Gruppe im Molekül, noch nicht mal ein Sauerstoff-Atom. Die Summenformel von Ammoniak ist NH3, ein Stickstoff-Atom ist also mit drei Wasserstoff-Atomen verbunden. Da könnte man vielleicht sogar erwarten, dass Ammoniak eine Säure ist, die ein Proton abgibt. Aber nein, Ammoniak reagiert basisch, wenn man es in Wasser löst.
Das Säure-Base-Konzept von Brønsted/Lowry
Das Säure-Base-Konzept von Arrhenius ist also nicht schlecht, musste aber erweitert werden, als man Basen wie NH3 entdeckte, die keine Hydroxid-Ionen abgeben können, weil die Moleküle keine OH-Gruppen besitzen. Zwei Chemiker, nämlich der Däne Johannes Nicolaus Brønsted und der Engländer Martin Lowry, haben unabhängig voneinander das Säure-Base-Konzept von Arrhenius stark erweitert. Vielleicht haben sie ja beide den Versuch mit konz. Salzsäure und konz. Ammoniak-Lösung durchgeführt, den man auch heute noch im Schulunterricht macht.
Versuch
Reaktion von Chlorwasserstoff mit Ammoniak
Durchführung:
Ein Weithals-Erlenmeyerkolben wird mit etwas konz. Salzsäure befüllt, ein anderer Weithals-Erlenmeyerkolben mit der gleichen Menge konz. Ammoniaklösung. Dann werden beide Erlenmeyerkolben dicht nebeneinander gestellt.
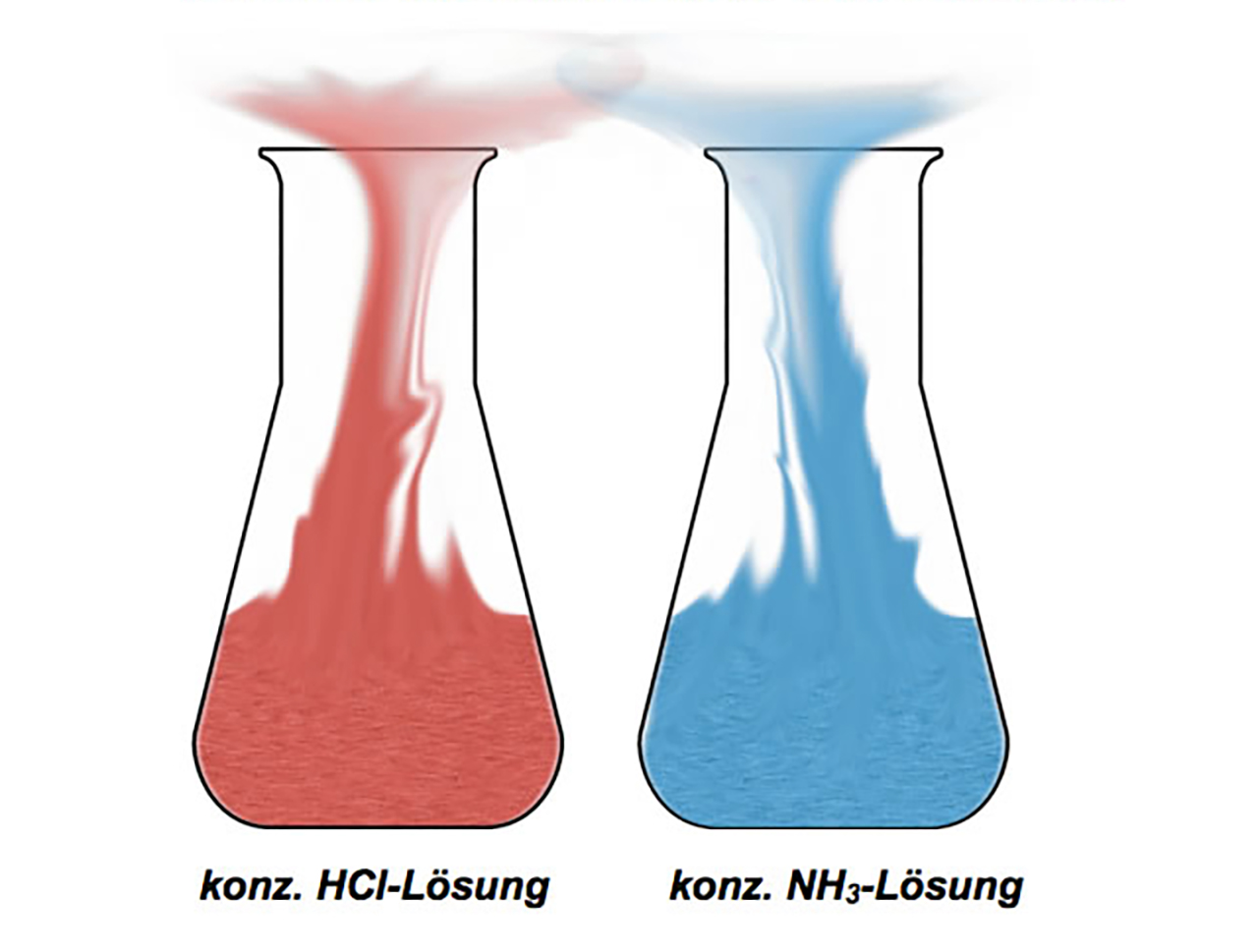
Beobachtungen:
Bei diesem Versuch bildet sich schöner dichter weißer Nebel an den Mündungen der beiden Erlenmeyerkolben.
Wer sich den Versuch einmal im Film anschauen möchte, dem sei das YouTube-Video von "Chemie im Labor" empfohlen, das diesen Versuch sehr anschaulich zeigt.

Bild aus dem Video "Salzsäure & Ammoniaklösung"
Autor: Chemie im Labor
Mit dem Arrhenius-Konzept kann man die Versuchsbeobachtungen nicht erklären, Ammoniak ist zwar eine Base, kann aber keine Hydroxid-Ionen abgeben. Was passiert also bei diesem wichtigen Versuch? Schauen wir uns dazu die Reaktionsgleichung an:
$HCl(g) + NH_3 (g) \to NH_4 Cl (s)$
Die Chlorwasserstoff-Moleküle geben Protonen ab, und zwar an die Ammoniak-Moleküle. Die NH3-Moleküle besitzen ein freies Elektronenpaar am Stickstoff-Atom, und diese doppelt besetzte Kugelwolke kann nun mit der leeren Kugelwolke eines Protons überlappen und so eine kovalente N-H-Bindung bilden:
$:NH_3 + H^{+}\to H:NH_3^{+}$
Es entsteht ein Ammonium-Ion H:NH3+, das man üblicherweise als NH4+ schreibt. Nach der Abspaltung des Protons von dem HCl-Molekül bleibt der Säurerest Cl- übrig, und diese negativen Chlorid-Ionen bilden nun mit den positiven NH4+-Ionen den Feststoff NH4Cl, das Ammoniumchlorid.
Nach dem Brønsted/Lowry-Konzept sind Säuren Protonendonatoren und Basen Protonenakzeptoren. Säuren können also ein oder mehrere Protonen abgeben, und Basen können ein oder mehrere Protonen aufnehmen. Im Prinzip sind alle Teilchen (Atome, Moleküle, Ionen), die ein freies Elektronenpaar besitzen, ein Protonenakzeptor, und alle Teilchen, die ein "locker" gebundenes H-Atom besitzen, Protonendonatoren.
Methan CH4 ist eine wasserstoffreiche Verbindung, an das zentrale C-Atom sind vier H-Atome gebunden. Allerdings sind diese Bindungen keineswegs "locker", sondern sehr fest. Daher ist Methan auch keine Säure, die H-Atome können nicht als Protonen abgegeben werden.
Säure-Base-Konzept von Brønsted und Lowry
Säuren sind Teilchen, die Protonen abgeben können (Protonendonatoren)
Basen sind Teilchen, die Protonen aufnehmen können (Protonenakzeptoren).
Wieso ist Ammoniakwasser basisch?
Wir wollen nun diese Frage klären. Mit dem Arrhenius-Konzept gelingt dies ja nicht. Vielleicht aber mit dem Konzept von Brønsted und Lowry.
$NH_3 + H_2O\to NH_4^{+} + OH^{-}$
In dieser Reaktion tritt Wasser als Säure auf (Protonendonator) und Ammoniak als Base (Protonenakzeptor). Die H2O-Moleküle geben je ein Proton ab, und als Säurerest bleiben OH--Ionen übrig. Die Ammoniak-Moleküle nehmen je ein Proton auf und werden zu Ammonium-Ionen. Die entstandenen Hydroxid-Ionen bewirken dann den basischen Charakter des Ammoniakwassers.
Beim Lösen von Ammoniak in Wasser entstehen also OH--Ionen, diese kommen allerdings nicht aus dem Ammoniak, sondern aus dem Wasser selbst. Das Wasser ist hier die Säure!
Wieso ist Salzsäure sauer?
Auch diese Reaktion kann man gut mit dem Brønsted/Lowry-Konzept erklären. Beim Lösen von HCl(g) in Wasser geben die HCl-Moleküle ein Proton ab, und die H2O-Moleküle nehmen je ein Proton auf und werden zu H3O+-Ionen, zu Oxonium-Ionen also.
Was versteht man unter einer Protolyse?
Unter einer Protolyse versteht man wörtlich die "Ablösung eines Protons". Gemeint ist hier allerdings mehr, nicht nur der Vorgang der Protonenabgabe. Eine Protolyse ist die Übertragung eines Protons von einem Protonendonator (einer Säure) auf einen Protonenakzeptor (eine Base). Daher ist der Begriff "Protolyse" nicht hundertprozentig korrekt, hat sich aber im Laufe der Zeit so eingebürgert.
7. Beispiel
$NH_3 + H_2O\to NH_4^{+} + OH^{-}$
Diese Protolyse kennen wir bereits, es werden Protonen von Wasser-Molekülen auf Ammoniak-Moleküle übertragen.
8. Beispiel
$HCl+ H_2O\to H_3O^{+} + Cl^{-}$
Auch diese Protolyse haben wir schon des Öfteren erwähnt, allerdings noch nicht als "Protolyse" bezeichnet. Chlorwasserstoff-Molekül geben Protonen an Wasser-Moleküle ab, es bilden sich Chlorid-Ionen als Säurerest und Oxonium-Ionen.
Dieses Beispiel zeigt auch sehr schön einen wichtigen Unterschied zum Säure-Begriff von Arrhenius auf: Nach Arrhenius geben Säuren Protonen ab. Diese befinden sich dann als H+-Teilchen im Wasser. Nach dem Brønsted/Lowry-Konzept geben Säuren ebenfalls Protonen ab, diese binden sich aber sofort an Wasser-Moleküle und bilden Oxonium-Ionen. Freie Protonen können in einer wässrigen Lösung nicht existieren.
Und damit wären wir auch schon beim Vergleich der beiden wichtigen Säure-Base-Konzepte.
Beide Konzepte im Vergleich
Unterschied 1
Nach Arrhenius sind Säuren Verbindungen, die in Protonen und Säurereste dissoziieren.
Nach Brönsted/Lowry sind Säuren Teilchen, die Protonen an eine Base abgeben können. Sie werden als Protonendonatoren bezeichnet.
Unterschied 2
Nach Arrhenius sind Basen Verbindungen, die in Hydroxid-Ionen und Basenreste dissoziieren.
Nach Brönsted/Lowry sind Basen Teilchen, die Protonen von einer Säure aufnehmen können. Sie werden als Protonenakzeptoren bezeichnet.
Diesen Unterschied kann man sich am Beispiel der Natronlauge sehr schön klar machen. Nach Arrhenius ist die Verbindung NaOH eine Base. Löst man festes Ätznatron NaOH (s) in Wasser, so dissoziiert es in Na+-Ionen und OH--Ionen.
Nach Brönsted/Lowry ist NaOH keine Base, sondern ein Salz. Bei der Dissoziation in Wasser werden Na+-Ionen und OH--Ionen freigesetzt. Die OH--Ionen können Protonen aufnehmen, sind also hier die Basen. Gelöstes NaOH ist keine Base, sondern eine Lauge, also eine wässrige Lösung, die Basen wie OH- enthält.
Unterschied 3
Nach Arrhenius geben Säuren "nackte" Protonen ab, nach Brönsted/Lowry bilden die Protonen in einer wässrigen Lösung sofort Oxonium-Ionen, weil nackte Protonen in einer wässrigen Lösung nicht existieren können.
Oxonium-Ionen und Hydronium-Ionen
Manche Menschen haben Schwierigkeiten mit den beiden Fachbegriffen Oxonium-Ion und Hydronium-Ion. Ein Oxonium-Ion ist das H3O+-Teilchen, also ein Wasser-Molekül mit einem kovalent gebundenem Proton. Ein Hydronium-Ion dagegen ist ein Oxonium-Ion, das über Wasserstoffbrücken-Bindungen mit drei weiteren Wasser-Molekülen verbunden ist. Daher sieht man im Zusammenhang mit Hydronium-Ionen oft die Formeln H3O+ * 3 H2O oder sogar H9O4+.
Wer das alles verstanden hat, der darf in Zukunft auch einfach H+ (aq) schreiben, das vereinfacht die Sache manchmal. Er oder sie muss dann allerdings in der Lage sein, den Unterschied zwischen Oxonium- und Hydronium-Ionen zu erklären, wenn ein Lehrer mal nachfragt.
Unterschied 4
Brönsted/Lowry haben den Protolyse-Begriff eingeführt. Bei einer Protolyse überträgt eine Säure ein Proton auf eine geeignete Base. Ist keine Base vorhanden, kann die Säure ihr Proton nicht abgeben.
Umgekehrt kann eine Base nur dann ein Proton aufnehmen, wenn eine Säure anwesend ist, die bereit ist, ihr Proton abzugeben.
Vertiefungsseiten
Auf dieser Homepage gibt es einige Vertiefungsseiten, die aber wahrscheinlich nur für Schüler(innen) der Oberstufe interessant sind. Dennoch soll hier kurz darauf hingewiesen werden.
Auf dieser Seite für die Stufe Q2 wird ebenfalls auf die Säure-Base-Konzepte von Arrhenius und Brönsted eingegangen, aber zusätzlich auch auf das moderne Konzept von Lewis, nach dem Säuren Teilchen mit einer leeren Kugelwolke und Basen Teilchen mit einer doppelt besetzten Kugelwolke sind.
Dieser Artikel im Chemie-Lexikon behandelt die Geschichte des Säure-Base-Begriffs und beginnt schon 16. Jahrhundert, als man von Säuren nur wusste, dass sie sauer schmecken und ätzen, und von Basen, dass sie Säuren neutralisieren können. Die Konzepte von Arrhenius und Brönsted werden ebenfalls angesprochen und auch das moderne Konzept von Lewis sowie aktuelle Verfeinerungen dieses Konzepts.
Der erste Abschnitt ist für Schüler(innen) der Sekundarstufe 1 vielleicht noch ganz interessant, aber ab Lewis wird es etwas schwierig.