Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie
- Die drei Einflussfaktoren nennen können, welche die Reaktionsgeschwindigkeit beeinflussen,
- begründen können, wieso die Reaktionsgeschwindigkeit von diesen drei Faktoren abhängt.
- die RGT-Regel anwenden können.
Am Ende der Einleitung in dieses neue Thema haben wir zwei wichtige Fragen gestellt:
- Von welchen Faktoren hängt die Reaktionsgeschwindigkeit nun genau ab?
- Wie kann man die Geschwindigkeit einer chemischen Reaktion möglichst genau messen?
Auf dieser Seite wollen wir einige Faktoren kennenlernen, von denen die Reaktionsgeschwindigkeit abhängt. Wie man die Geschwindigkeit einer Reaktion messen kann, wird dann auf der nächsten Seite erläutert.
Faktor 1:
Konzentration der Edukte
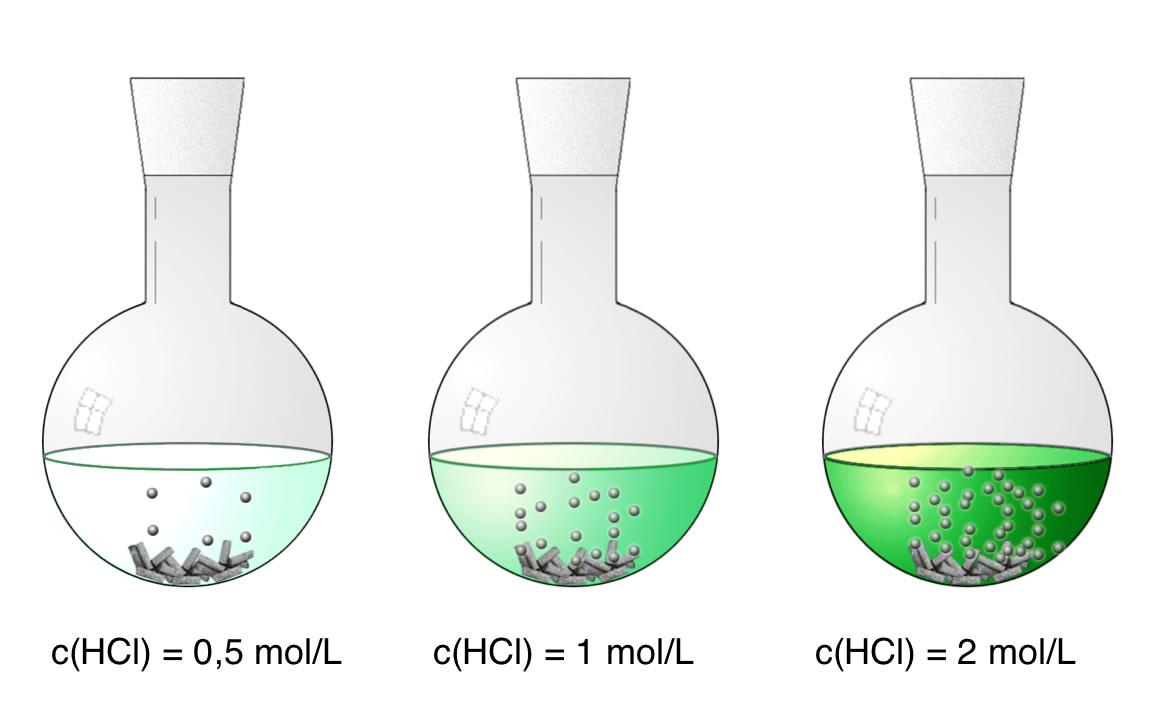
In drei Kolben wird 100 ml Salzsäure unterschiedlicher Konzentration gefüllt: 0,5 mol/l, 1 mol/l und 2 mol/l. Dazu wird jeweils die gleiche Menge an Zinkspänen gegeben.
In allen drei Kolben läuft folgende Reaktion ab:
$Zn_{(s)} + 2 HCl_{(aq)} \to ZnCl_{2(aq)} + H_{2(g)}$
Falls der Browser die Gleichungen auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Die Reaktion läuft mit steigender HCl-Konzentration schneller ab, was man an der Anzahl der aufsteigenden Gasbläschen halb-quantitativ verfolgen kann. Alternativ könnte man das Gas mit einem Kolbenprober auffangen und genau messen. Eine andere Alternative: Man stellt die Kolben auf eine empfindliche Waage und verfolgt die Abnahme der Masse im Laufe der ersten Minuten.
In allen Fällen kommen wir zu dem folgenden Ergebnis:
Die Geschwindigkeit einer chemischen Reaktion hängt von der Konzentration der Ausgangsstoffe bzw. Edukte ab: Je größer c(Edukte), desto größer die Reaktionsgeschwindigkeit vR.
Hier gilt der Spruch: "Viel hilft viel!". Eine hohe HCl-Konzentration beschleunigt die Reaktion deutlich.
Ein Fall für Experten
Führt man den oben dargestellten Versuch mit konzentrierter Essigsäure und verdünnter Essigsäure durch, erhält man ein völlig überraschendes Ergebnis: In der verdünnten Essigsäure läuft die Reaktion erheblich intensiver als als in der konzentrierten Essigsäure.
Das liegt daran, dass das Zink nicht mit der Essigsäure CH3COOH selbst reagiert, sondern mit den Oxonium-Ionen H3O+, die entstehen, wenn Essigsäure Protonen H+ an Wasser-Moleküle H2O abgibt:
$CH_{3}COOH_{(l)} + H_{2}O_{(l)} \rightleftharpoons CH_{3}COO^{-}_{(aq)} + H_{3}O^{+}_{(aq)}$
In konz. Essigsäure sind aber noch keine Wasser-Moleküle vorhanden, an die die Essigsäure-Moleküle Protonen abgeben könnten. Erst in Anwesenheit von Wasser-Molekülen können die Essigsäure-Moleküle dissoziieren und Protonen abgeben, so dass sich die reaktiven Oxonium-Ionen bilden, die dann wiederum mit dem Zink reagieren:
$2 H_{3}O^{+}_{(aq)} + Zn_{(s)} \rightarrow Zn^{2+}_{(aq)} + 2 H_{2}O_{(l)} + H_{2_(g)}$
Wenn man sich diese Reaktionsgleichungen betrachtet, stellt man fest, dass die Versuchsergebnis keinen Widerspruch zu der obigen Aussage "Viel hilft viel" darstellen. Je mehr Oxonium-Ionen in der Lösung sind, desto schneller läuft die Reaktion ab. Bei der Reaktion von HCl mit Zn ist das übrigens genau so. HCl der Konzentration 2 mol/l enthält doppelt so viele Oxonium-Ionen wie HCl der Konzentration 1 mol/l.
Mehr zum Thema Oxonium-Ionen und Reaktion von Säuren erfahren Sie auf den Q1-Seiten zur Säure-Base-Chemie.
Faktor 2:
Zerteilungsgrad der Edukte
Wenn man Sie fragen würde, ob Eisen brennt, würden Sie doch wahrscheinlich mit einem klaren "Nein" antworten. In der Tat, wenn man einen Eisenträger in eine Flamme hält, passiert gar nichts. Man kann auch Töpfe aus Eisen oder Stahl stundenlang über ein Lagerfeuer halten, ohne dass der Topf groß zu Schaden kommt.

In diesem YouTube-Video wird gezeigt, dass Eisen u.U. brennen kann
Eisenwolle dagegen verbrennt in der Bunsenflamme innerhalb weniger Sekunden, und wenn man Eisenstaub durch ein Glasrohr in die Bunsenflamme bläst, so erfolgt die Reaktion mit dem Luftsauerstoff noch viel schneller.
Ein zweites Beispiel soll das eben Gesagte verdeutlichen. Wenn man etwas Salzsäure auf eine Fensterbank tropft, die aus Marmor besteht, so passiert zunächst gar nichts. Erst nach einiger Zeit stellt man fest, dass sich kleine Bläschen bilden, dass es also zu einer chemischen Reaktion gekommen ist. Nimmt man dagegen kleine Marmorstückchen und übergießt sie in einem Erlenmeyerkolben mit Salzsäure, so kommt die Reaktion schon deutlich schneller in Gang. Pulverisiert man Marmor und gibt dann in einem Kolben Salzsäure dazu, findet sofort eine sehr heftige Gasbildung statt.
Die Geschwindigkeit einer chemischen Reaktion hängt von dem Zerteilungsgrad der Ausgangsstoffe bzw. Edukte ab: Je feiner die Ausgangsstoffe zerteilt sind, desto größer ist die Reaktionsgeschwindigkeit vR.
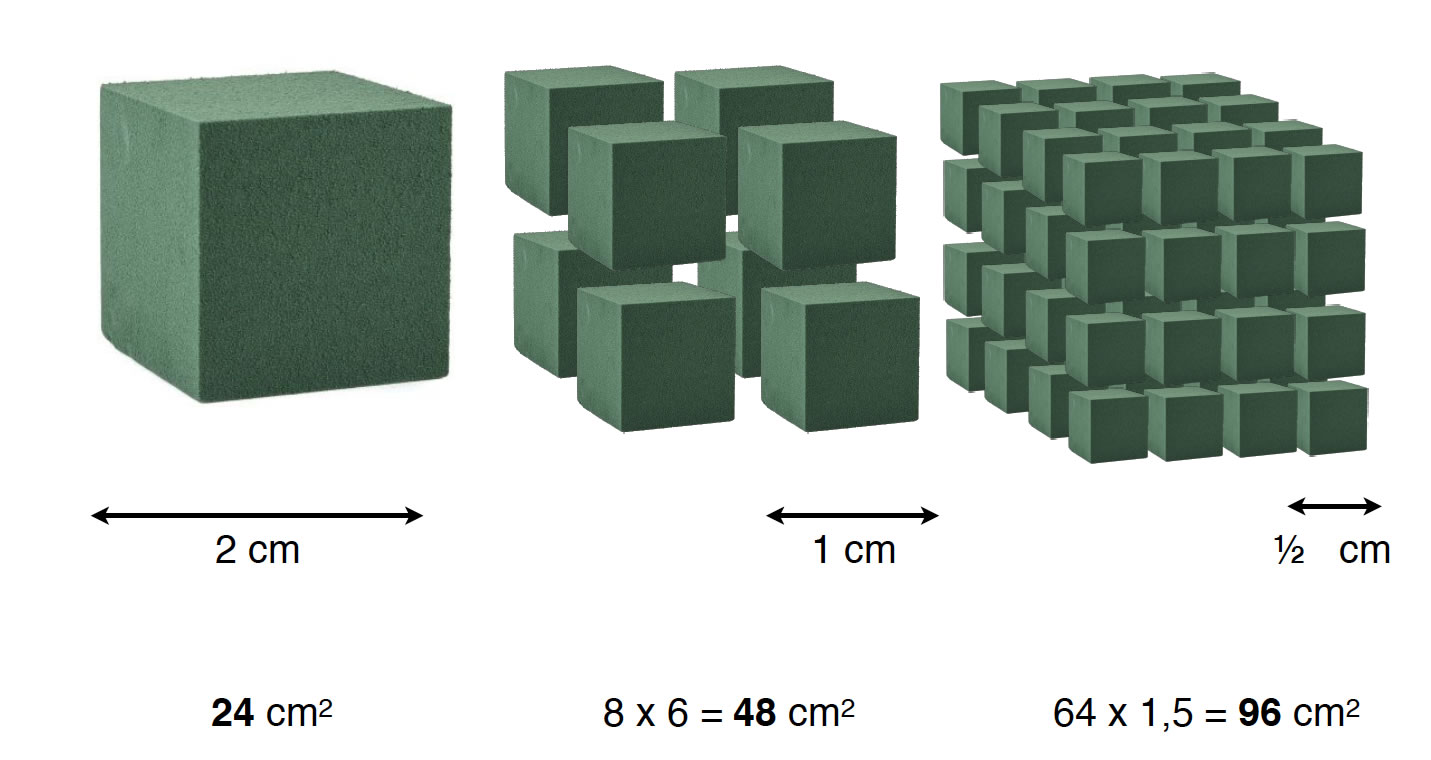
Oberflächenvergrößerung durch Zerteilung eines Würfels
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Das hängt natürlich mit dem Prinzip der Oberflächenvergrößerung zusammen. Ein Metallklotz reagiert nur an seiner Oberfläche mit der Säure. Ein Magnesiumwürfel der Kantenlänge 2 cm hat eine Oberfläche von 24 cm2. Zerteilt man den Würfel in acht kleinere Würfel, so hat man immer noch die gleiche Masse Magnesium, aber jeder der kleineren Würfel hat eine Kantenlänge von 1 cm und eine Oberfläche von 6 cm2. Insgesamt haben wir acht solcher Würfel und somit eine Gesamtoberfläche von 48 cm2. Die Oberfläche hat sich also verdoppelt. Zerteilt man jeden dieser acht Würfel noch einmal in acht kleinere Würfel, erhält man 64 Würfel mit dem gleichen Volumen wie der ursprüngliche Würfel. Aber die Oberfläche ist jetzt auch insgesamt 96 cm2 angewachsen, also auf das Vierfache der ursprünglichen Oberfläche.
Daher sollte sich auch die Reaktionsgeschwindigkeit mit der Säure verdoppelt bzw. vervierfacht haben. Und wenn man Magnesiumpulver mit einem massiven Stück Magnesium vergleicht? Das Stück wird nicht nur einmal in acht kleinere Stücke zerteilt, sondern der Vorgang muss viele Male wiederholt werden, bis man ein Pulver hat. Die Oberfläche des Magnesiums verdoppelt sich also nicht, sondern wächst viel stärker (siehe Kasten für Mathe-Experten).
Für Mathe-Experten
Angenommen, der Magnesium-Würfel hat eine Kantenlänge von 1 cm, während ein Pulverkorn einen Durchmesser von 0,1 mm hat. Wie oft musste der Würfel dann geteilt werden?
Nach der 1. Teilung beträgt die Kantenlänge 0,5 cm, nach der 2. Teilung 0,25 cm, nach der 3. Teilung 0,125 cm und so weiter. Es sind zwischen 6 und 7 Teilungen notwendig, damit Pulverkörner mit ca. 0,1 mm Durchmesser entstehen, wenn man so weitermacht.
Nach der 1. Teilung hat sich die Gesamtoberfläche des Magnesiums verdoppelt, nach der 2. Teilung vervierfacht, nach der 3. Teilung verachtfacht und so weiter. Nach der 6. Teilung hat man die 64-fache Oberfläche, und nach der 7. Teilung die 128-fache Oberfläche.
Ein sehr schönes Video mit einem interessanten Versuch habe ich auf der tollen Webseite LNCU.de (Lebensnaher Chemieunterricht) gefunden.
Das Video zum Versuch
Schauen Sie sich das Video doch bitte selbst an. In dem Versuch wird eindrucksvoll gezeigt, wie unterschiedlich Magnesiumband und Magnesiumspäne mit Salzsäure reagieren.
Faktor 3:
Temperatur
Ein dritter Faktor ist wichtig für die Geschwindigkeit einer chemischen Reaktion, die Temperatur.
Jeder Mensch weiß aus eigener Erfahrung, dass man chemische Reaktionen durch Erhitzen beschleunigen kann, zum Beispiel das Backen von Brot oder das Braten von Würstchen. Wir machen im Alltag ständig Gebrauch von dieser RGT-Regel (Reaktionsgeschwindigkeits-Temperatur-Regel).
RGT-Regel
Die Geschwindigkeit einer chemischen Reaktion verdoppelt sich, wenn die Temperatur um 10°C steigt.
Die RGT-Regel ist natürlich nur eine Faustregel, es gibt viele Reaktionen, bei denen man die Temperatur um 20 oder gar 30° erhöhen muss, damit es zu einer Verdopplung der Reaktionsgeschwindigkeit kommt, bei anderen Reaktionen reichen vielleicht schon 7 oder 8°C aus.
Was wir aber auf jeden Fall festhalten können, ist Folgendes:
Die Geschwindigkeit einer chemischen Reaktion hängt von der Temperatur der Umgebung ab: Je höher die Temperatur, desto größer ist die Reaktionsgeschwindigkeit vR.
Fassen wir am Ende alle wichtigen Erkenntnisse dieser Seite noch einmal übersichtlich zusammen:
Die Geschwindigkeit einer chemischen Reaktion nimmt zu mit der
- Konzentration der Edukte,
- mit dem Zerteilungsgrad der Edukte und
- mit der Temperatur.
Für Experten der Faktor 4:
Reaktionsgeschwindigkeit und Entropie
Unter der Entropie versteht man ein Maß für die Unordnung eines Systems. Je größer die Unordnung, desto entropiereicher ist das System. Feststoffe, Kristalle etc. besitzen zum Beispiel nur sehr wenig Entropie, weil sie ja in hochgeordneten Strukturen vorliegen. Flüssigkeit, Lösungen etc. besitzen schon sehr viel mehr Entropie, und Gase schließlich sind extrem entropiereich.
Wenn bei einer chemischen Reaktion die Entropie zunimmt, ist das eine ziemlich starke Triebkraft für die Reaktion. Die Heftigkeit von Explosionen erklärt sich zumindest teilweise aus der starken Entropiezunahme: Aus Feststoffen wie Dynamit werden Gase wie CO2, Stickoxide etc.
Was hat nun die Entropie mit der Reaktionsgeschwindigkeit zu tun? In dem neuen Lehninger "Priciples of Biochemistry" von 2021, einem der Standardwerke der Biochemie, findet sich ein tolles Beispiel, das den Zusammenhang zwischen Reaktionsgeschwindigkeit und Entropie sehr gut erklärt. Ich habe mal versucht, dieses Beispiel mit Hilfe des schönen Molekülbau-Programms Avogadro.app zu verdeutlichen. Wer sich dafür interessiert, geht bitte auf die folgende Expertenseite.
➥Reaktionsgeschwindigkeit und Entropie
Die Expertenseite, auf der der Zusammenhang zwischen diesen beiden Größen anschaulich erklärt wird.
Auf dieser Expertenseite wird gezeigt, wie die Herabsetzung der Entropie bei den Edukten die Reaktionsgeschwindigkeit erhöhen kann, weil die Wahrscheinlichkeit eines erfolgreichen Zusammenstoßes der Edukt-Moleküle erhöht wird. Auch Katalysatoren arbeiten nach diesem Prinzip der Entropie-Erniedrigung. Das Thema "Katalysatoren" wird noch auf einer eigenen Seite thematisiert, die aber für die Stufe EF wahrscheinlich zu komplex ist. Wer's sich aber zutraut, kann sich ja gerne weiterbilden.
Eine ausführliche Darstellung der homogenen und heterogenen Katalyse auf dieser Lexikonseite.
Seitenanfang -
Weiter mit Messung der Reaktionsgeschwindigkeit ...