Temperatur und Reaktionsgeschwindigkeit EF
Wie wohl jeder weiß, kann man chemische Vorgänge durch Erhitzen beschleunigen. In heißem Tee löst sich Zucker schneller auf als in kaltem Kaffee. Umgekehrt kann man chemische und biochemische Prozesse durch Abkühlen verlangsamen, warum sonst legt man seine leicht verderblichen Lebensmittel in den Kühl- oder Gefrierschrank?
RGT-Regel
Bereits Ende des 19. Jahrhunderts hat der Chemiker Jacobus van't Hoff Experimente zu diesem Thema durchgeführt und dabei die RGT-Regel aufgestellt: Eine Temperaturerhöhung von 10 Grad Celsius führt normalerweise zu einer Verdopplung bis Verdreifachung der Geschwindigkeit chemischer und biochemischer Reaktionen. Zumindest dann, wenn "normale" Temperaturen herrschen, also so zwischen 0 und 200 Grad Celsius.
Wie kommt es aber dazu, dass die Temperatur einen solch starken Einfluss auf die Geschwindigkeit chemischer (und physikalischer) Vorgänge hat?
Um diese Frage beantworten zu können, müssen wir uns zunächst etwas mit der sogenannten Stoßtheorie der Reaktionsgeschwindigkeit beschäftigen.
Stoßtheorie der Reaktionsgeschwindigkeit EF
Erfolgreiche und nicht erfolgreiche Stöße
Bei der Stoßtheorie der Reaktionskinetik geht man davon aus, dass die Teilchen der Ausgangsstoffe aus kleinen, massiven Kügelchen bestehen. Jedes Teilchen hat eine bestimmte Masse, eine bestimmte Geschwindigkeit und eine bestimmte Bewegungsrichtung.
Das erinnert etwas an das Atommodell von Dalton. Man braucht also kein Kugelwolkenmodell oder Schalenmodell, um die Stoßtheorie zu verstehen.
Damit es zu einer chemischen Reaktion zwischen zwei Teilchen kommt, müssen diese zusammenstoßen. Aber nicht bei jedem Zusammenprall kommt es zur Reaktion. Manche Zusammenstöße sind nicht energiereich genug. Ob ein Zusammenstoß erfolgreich ist - also zu einer Reaktion führt - oder nicht, hängt im Wesentlichen von drei Faktoren ab:
- Geschwindigkeit der Teilchen
- Richtige Orientierung der Teilchen
- Günstiger Stoßwinkel, in dem die Teilchen zusammenprallen
1. Geschwindkeit
Ein wichtiger Faktor, von dem die Energie eines Zusammenpralls abhängt, ist die Geschwindigkeit der Teilchen. Stoßen zwei Teilchen mit hoher Geschwindigkeit zusammen, so ist dieser Stoß sehr energiereich. Vielleicht energiereich genug, um zu einer chemischen Reaktion zu führen.
Stoßen die beiden Teilchen dagegen mit geringer Geschwindigkeit zusammen, so passiert nicht viel. Die Teilchen prallen voneinander ab, erhalten eine neue Bewegungsrichtung, und das war's dann auch schon. Der Stoß war nicht energiereich genug für eine Reaktion.
Die Geschwindigkeit der Teilchen ist also der entscheidende Faktor. Und damit auch die Temperatur, denn die Temperatur wirkt sich direkt auf die Geschwindigkeit der kleinsten Teilchen aus.
2. Orientierung
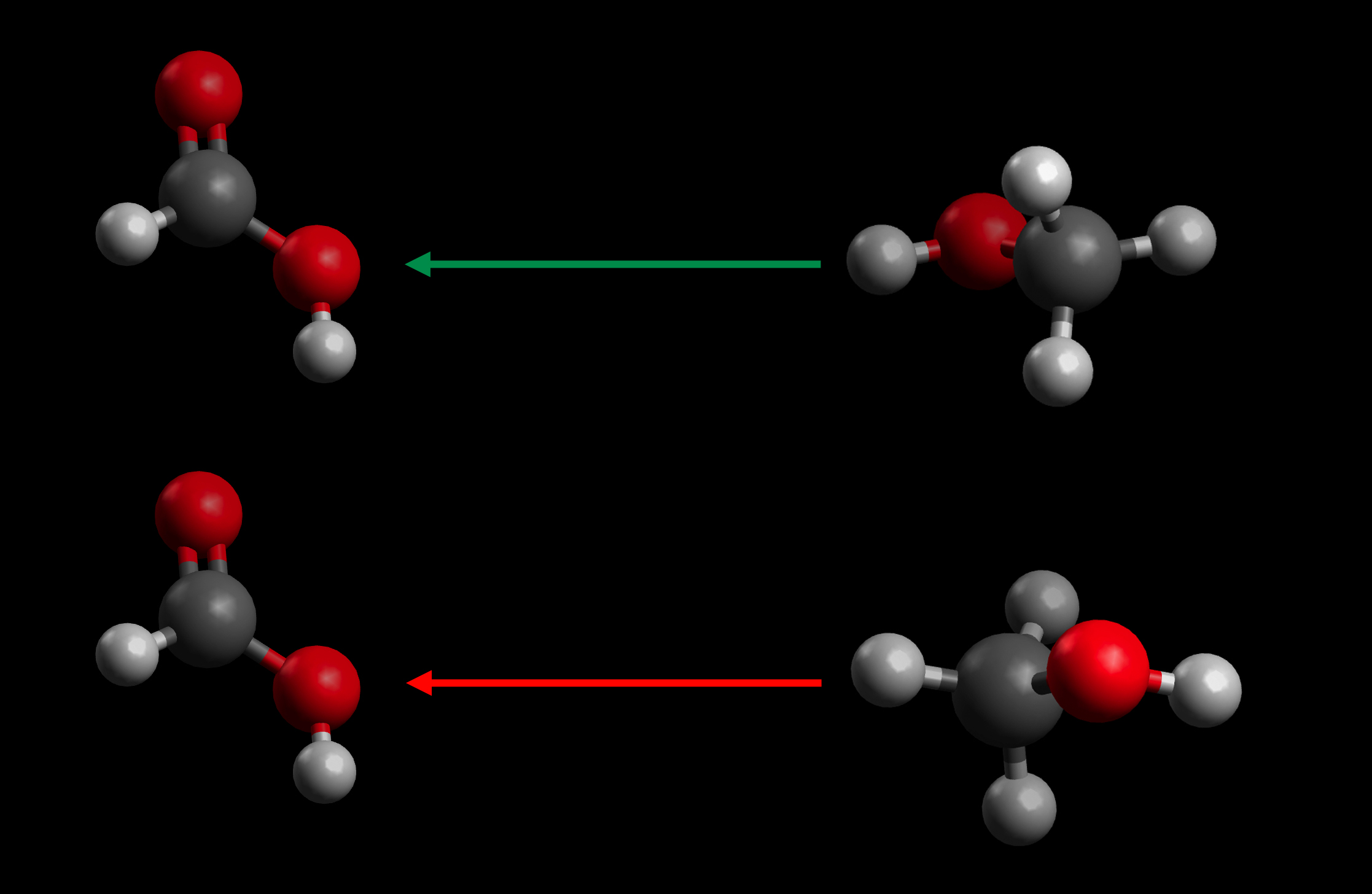
Ameisensäure und Methanol stoßen zusammen
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Betrachten wir nun die obige Abbildung. Hier trifft ein Ameisensäure-Molekül (links) auf ein Methanol-Molekül (rechts). Der obere Zusammenstoß ist erfolgreich (grüner Pfeil), weil die Teilchen mit der richtigen Mindestgeschwindigkeit und in der richtigen Orientierung zusammenstoßen. Die OH-Gruppe des Methanols trifft auf die OH-Gruppe der Ameisensäure, so kann dann leicht ein Wasser-Molekül abgespalten werden, und die beiden Moleküle können sich zu Ameisensäure-Methylester vereinigen.
Der Zusammenstoß unten ist zwar auch energiereich genug, aber die beiden Moleküle sind sehr ungünstig orientiert. Hier trifft die Methylgruppe des Methanols auf die OH-Gruppe der Ameisensäure. Dann kann aber keine Reaktion stattfinden; die Methylgruppe kann kein H-Atom abspalten, weil die C-H-Bindung zu stark ist.
Neben der Geschwindigkeit ist also auch die Orientierung wichtig, mit dem die beiden Teilchen zusammenprallen.
3. Stoßwinkel
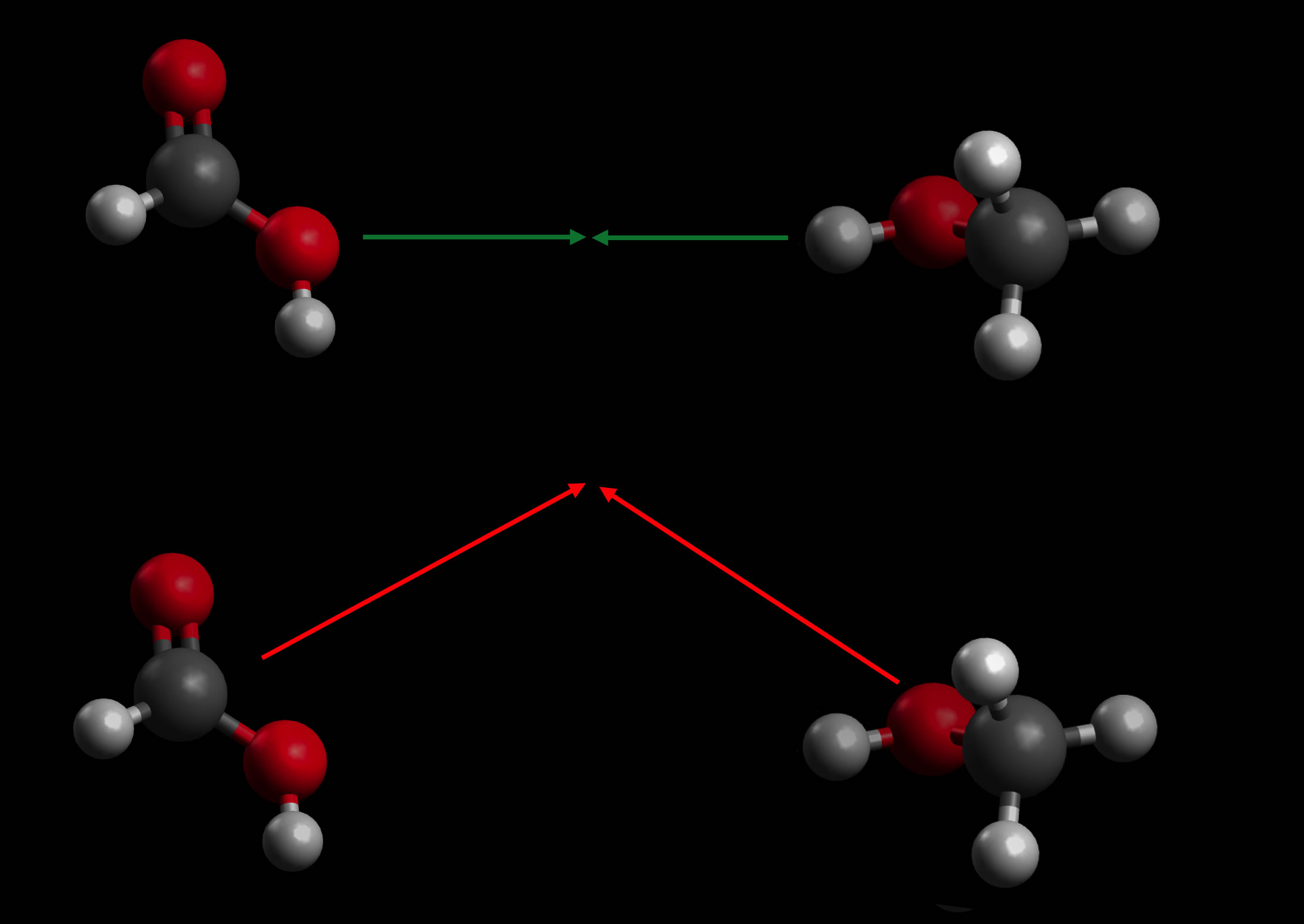
Der Stoßwinkel spielt eine wichtige Rolle
Autor: Ulrich Helmich 2021, Lizenz: Public domain
In dieser Abbildung haben die beiden Moleküle zwar in beiden Fällen die richtige Geschwindigkeit, trotzdem ist der untere Zusammenstoß nicht erfolgreich. Der Stoßwinkel spielt neben der Geschwindigkeit und der Orientierung ebenfalls eine wichtige Rolle.
Wenn zwei sehr schnelle Teilchen in einem spitzen Winkel zusammenprallen, so ist dieser Stoß dennoch nicht energiereich genug. Prallen dagegen zwei etwas langsamere Teilchen frontal und in der richtigen Orientierung aufeinander, so kann es durchaus zu einer Reaktion kommen.
Temperatur und Geschwindigkeit der Teilchen Q1
Bereits in dem Einführungsteil (Stufe EF) hatten wir gesehen, dass die Geschwindigkeit, mit der sich die Teilchen in einer Flüssigkeit oder einem Gas bewegen, von der Temperatur abhängt. Wir hatten dort die RGT-Regel kennengelernt. Je höher die Temperatur, desto schneller bewegen sich die Teilchen im Reaktionsgemisch, und desto wahrscheinlicher ist es, dass ein Zusammenstoß zweier Teilchen "erfolgreich" ist.
Betrachten wir nun folgende Abbildung:
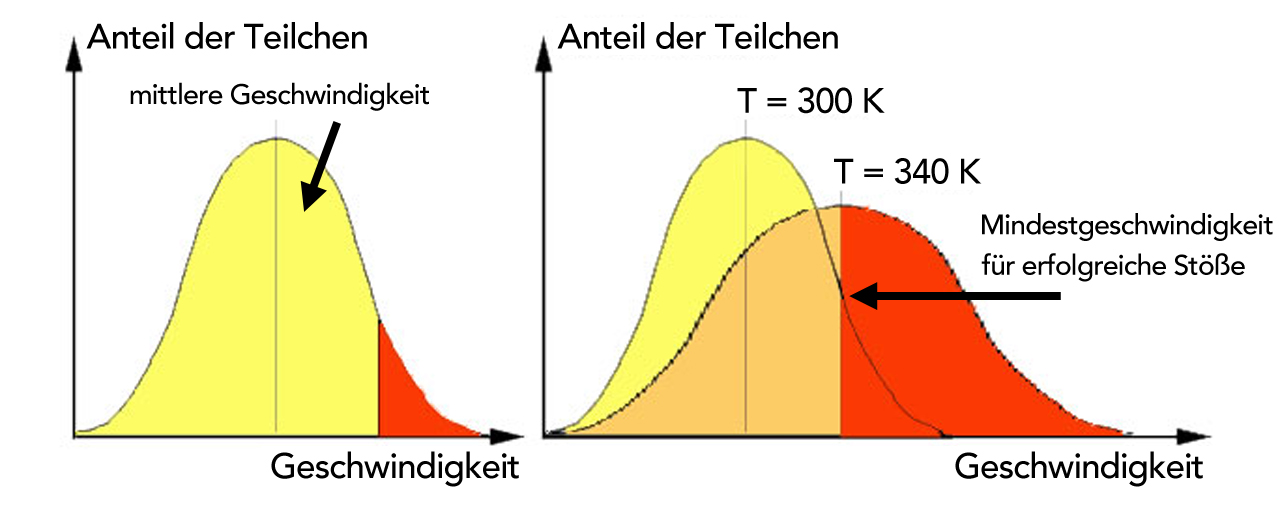
Links sehen wir die Geschwindigkeitsverteilung der Teilchen in einem Gas. Es ist ja nicht so, dass sich alle Teilchen eines Gases (oder einer Flüssigkeit) mit exakt der gleichen Geschwindigkeit bewegen. Einige Teilchen sind sehr langsam (links in der gelben Kurve), andere sehr schnell (rechts im roten Abschnitt der Kurve). Die meisten Teilchen bewegen sich mit einer Geschwindigkeit, die irgendwo zwischen diesen beiden Extremen liegt, also mit einer mittleren Geschwindigkeit.
Diese mittlere Geschwindigkeit reicht jedoch nicht aus, um einen erfolgreichen Zusammenstoß zu fabrizieren. Wie wir weiter oben schon gesehen hatten, ist ein Zusammenstoß zwischen zwei Teilchen ja nur dann erfolgreich, wenn die Teilchen eine bestimmte Mindestgeschwindigkeit haben, in der richtigen Orientierung aufeinanderprallen und wenn der Stoßwinkel optimal ist.
In der Abbildung links (T = 300 K, also ca. 27 ºC) hat nur ein sehr kleiner Teil der Moleküle eine Geschwindigkeit, die für einen erfolgreichen Stoß ausreicht. Dieser Teil ist in dem Graphen rot markiert.
Erhöht man nun die Temperatur um 40 Grad auf 340 K, dann ändert sich die Geschwindigkeitsverteilung erheblich. Insgesamt werden die Teilchen nun schneller, die mittlere Geschwindigkeit steigt an, und die Zahl der Teilchen, die schnell genug für einen erfolgreichen Stoß sind, wächst an, von ca. 10% bei 300 K auf ca. 50% bei 350 K. Es gibt also fünfmal so viele Teilchen, die beim Zusammenstoßen "erfolgreich" sind. Daher steigt die Geschwindigkeit der Reaktion ebenfalls auf das Fünffache, falls die Reaktion monomolekular ist, und auf das 25fache, wenn die Reaktion bimolekular ist.
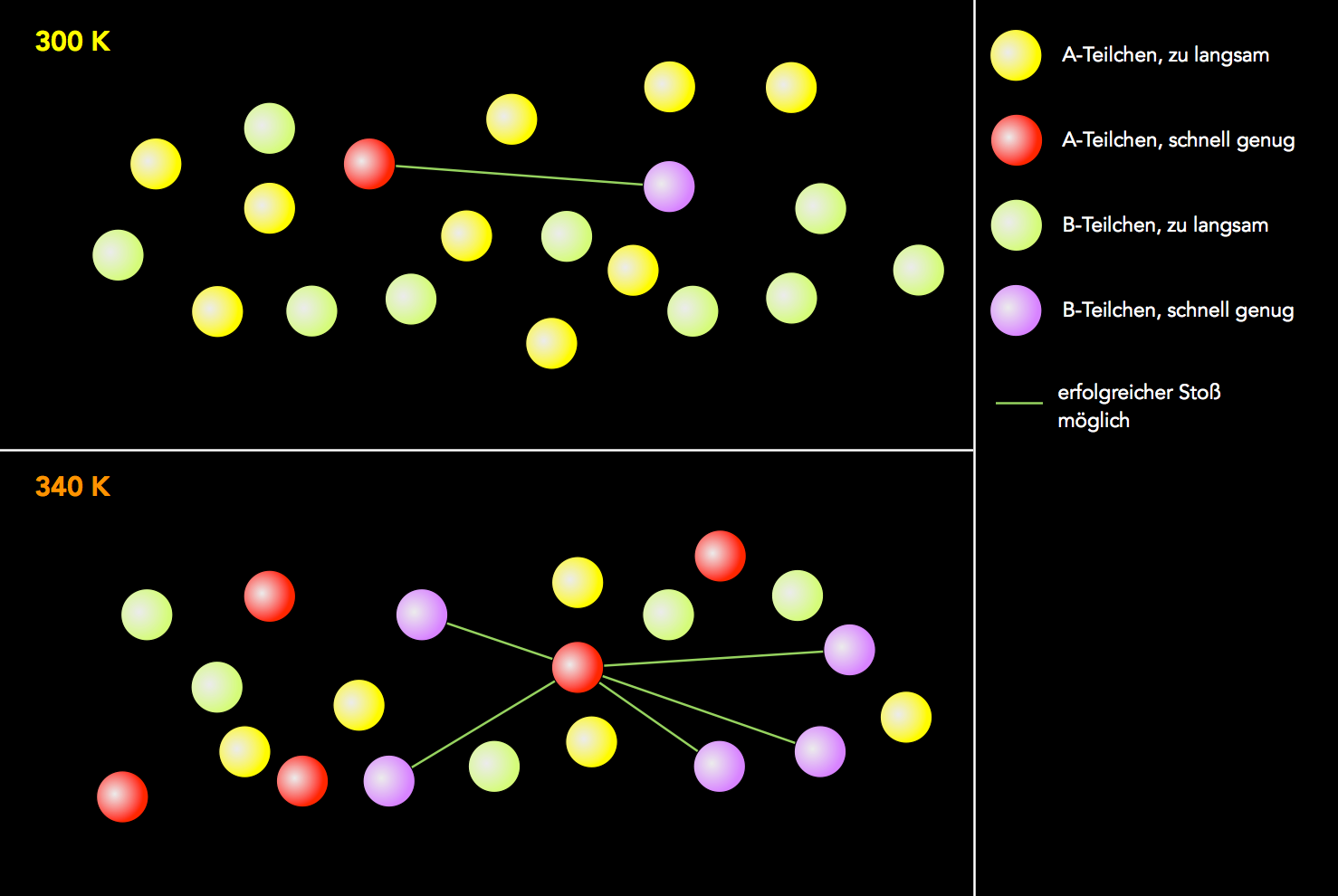
Stoßwahrscheinlichkeit und Temperatur
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Diese Graphik soll noch einmal verdeutlichen, wieso die Wahrscheinlichkeit eines erfolgreichen Stoßes mit steigender Temperatur zunimmt. Dazu verwenden wir hier ein einfaches Modellsystem. Die Teilchen sind jetzt einfache Kugeln. Das heißt, der Faktor Orientierung spielt hier keine Rolle mehr, und den Faktor Stoßwinkel wollen wir einmal vernachlässigen.
Bei 300 K ist von den 10 A-Teilchen nur eines schnell genug für einen erfolgreichen Zusammenstoß, ebenso nur eines von den B-Teilchen. Die Wahrscheinlickeit, dass ausgerechnet diese beiden Teilchen zusammenstoßen, berechnet sich zu 1/10 * 1/10, ist also 1/100.
Bei 340 K sind von den 10 A-Teilchen fünf schnell genug für einen erfolgreichen Zusammenstoß, ebenso bei den B-Teilchen. Die Wahrscheinlichkeit, das eines der 5 A-Teilchen mit einem der 5 B-Teilchen zusammenstößt, ist 1/2 * 1/2 = 1/4. Die Wahrscheinlichkeit eines erfolgreichen Zusammenstoßes ist jetzt also 25 mal höher als bei 300 K.