Geräte:
Fünf Erlenmeyerkolben, Stoppuhr,
Chemikalien:
Natriumthiosulfatlösung (0,1 mol/l), Salzsäure (2 mol/l).
Durchführung:
Man mischt in fünf Erlenmeyerkolben (100 ml) folgende Lösungen aus Natriumthiosulfatlösung (0,1 mol/l), Wasser und Salzsäure (2 mol/l) :
| Nummer | Na2S2O3 | Wasser | Salzsäure |
| 1 | 50 ml | 0 ml | 5 ml |
| 2 | 40 ml | 10 ml | 5 ml |
| 3 | 30 ml | 20 ml | 5 ml |
| 4 | 20 ml | 30 ml | 5 ml |
| 5 | 10 ml | 40 ml | 5 ml |
Zuerst werden das Thiosulfat und das Wasser in die Kolben gegeben. Erst dann gibt man die Salzsäure dazu. Sobald die Salzsäure im Kolben ist, stellt man diesen auf ein weißes Blatt Papier, auf dem sich ein schwarzes Zeichen befindet. Nun startet man eine Stoppuhr und misst die Zeit, die vergeht, bis man das schwarze Zeichen nicht mehr erkennen kann. Dieser Versuch ist mit jedem Erlenmeyerkolben zu wiederholen.
Auswertung
Bei der Reaktion entsteht Schwefel nach folgender Gleichung:
$S_{2}O_{3}^{2-}(aq) + 2 H^{+} (aq) \to SO_{2} (g) + S (s) + H_{2}O (l)$Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Da sich Schwefel bekanntlich nicht in Wasser löst, entsteht mit der Zeit eine immer "dickere" Suspension, welche nach und nach völlig undurchsichtig wird.
Als Maß für die Reaktionsgeschwindigkeit wollen wir den Kehrwert der gemessenen Zeit verwenden (das ist zwar nicht ganz wissenschaftlich, reicht für unsere Zwecke aber völlig aus). Benötigt ein Kolben 20 Sekunden bis zum völligen Trübwerden, ein zweiter aber nur 10 Sekunden, so ist die Reaktionsgeschwindigkeit im zweiten Kolben doppelt so groß wie im ersten Kolben.
Zur Auswertung des Versuchs wird eine Graphik erstellt, in der die so ermittelte Reaktionsgeschwindigkeit gegen die Konzentration der Thiosulfationen aufgetragen wird.
Man erkennt, dass die Reaktionsgeschwindigkeit direkt von der Thiosulfat-Konzentration abhängt - im Idealfall müsste die Graphik eine Gerade zeigen:
$v_{R} = k \cdot S_{2}O_{3(aq)}^{2-} $Dabei ist k die Geschwindigkeitskonstante.
Ideales Beispiel
Wir wollen die oben beschriebene Auswertung nun gemeinsam durchführen. Ein ideales Beispiel für die Messwerte könnte so aussehen:
| Nummer | Na2S2O3 | Wasser | Salzsäure | Trübungszeit |
| 1 | 50 ml | 0 ml | 5 ml | 19 |
| 2 | 40 ml | 10 ml | 5 ml | 25 |
| 3 | 30 ml | 20 ml | 5 ml | 31 |
| 4 | 20 ml | 30 ml | 5 ml | 40 |
| 5 | 10 ml | 40 ml | 5 ml | 58 |
Ich habe hier mal die Thiosulfat-Menge (Volumen in ml) und den Kehrwert der Trübungszeit in Excel eingegeben, den Diagrammtyp "xy-Diagramm" gewählt und ein entsprechendes Diagramm erzeugt. Hier ist das Bildschirmphoto:
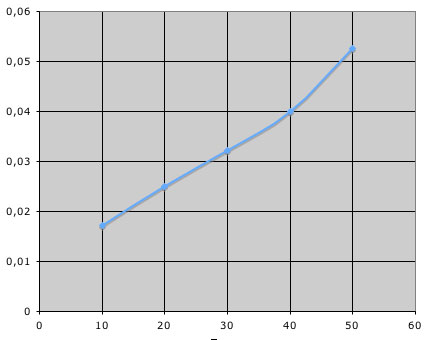
Auf der x-Achse sehen wir die Thiosulfat-Menge in ml, auf der y-Achse den Kehrwert der Trübungszeit, die "Reaktionsgeschwindigkeit" also. Wir können feststellen, dass die "Reaktionsgeschwindigkeit" mehr oder weniger linear von der "Konzentration" des Thiosulfats abhängt.
Reelles Beispiel 1
Kurz vor dem Ausbruch der Corona-Krise konnte ich mit meinen Schüler(innen) der Stufe EF den Versuch im Unterricht durchführen. Hier die Ergebnisse einer Schüler-Gruppe:
| Nummer | Na2S2O3 | Wasser | Salzsäure | Trübungszeit |
| 1 | 50 ml | 0 ml | 5 ml | 44 |
| 2 | 40 ml | 10 ml | 5 ml | 75 |
| 3 | 30 ml | 20 ml | 5 ml | 77 |
| 4 | 20 ml | 30 ml | 5 ml | 101 |
| 5 | 10 ml | 40 ml | 5 ml | 103 |
Hier ist zwar die Trübungszeit um so kleiner, je höher die Konzentration an Natriumthiosulfat ist, was ja schon mal positiv zu bewerten ist. Allerdings gibt es ein paar unschöne Auffälligkeiten bei den Messwerten. Der zweite und der dritte Wert (75 / 77) liegen zu nah zusammen, ebenso der vierte und fünfte Messwert (101 / 103). Aber so ist das eben, wenn man Schülerversuche macht und aus Zeitgründen schnell arbeiten muss.
Reelles Beispiel 2
Hier die Ergebnisse einer anderen Schülergruppe aus dem März 2020, als wir wieder mal Präsenzunterricht hatten.
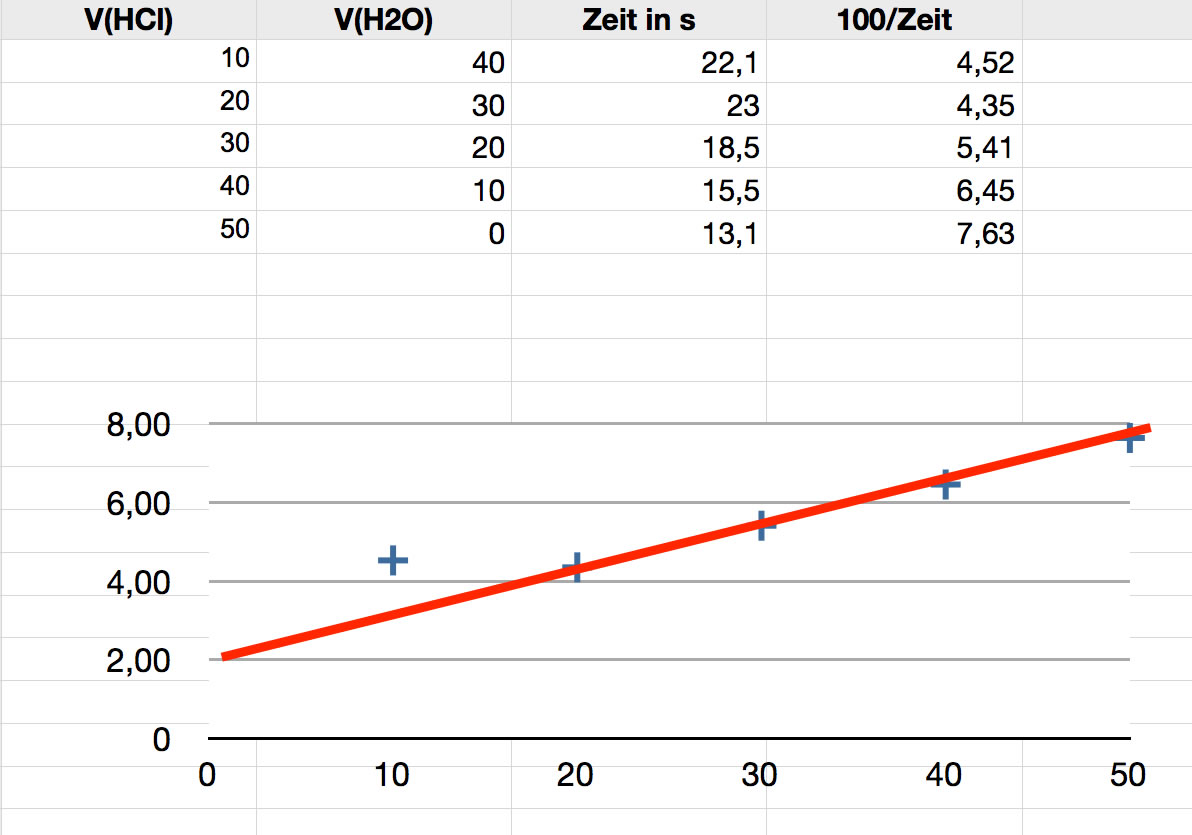
Ergebnisse einer anderen Schülergruppe
Autor: Schüler(innen) von Ulrich Helmich 2020, Lizenz: Public domain
Auffällig ist hier der zweite Messwert, der höher ist als der erste. An sich sollte die Reaktion schneller verlaufen, wenn die Konzentration der Salzsäure größer wird.
Die Ausgleichsgerade wurde von mir in die Graphik gelegt. Sie müsste eigentlich durch den Nullpunkt gehen. Wenn keine Salzsäure im Medium vorhanden ist, kann die Reaktion ja nicht ablaufen.