Begriffsklärung
Die Begriffe "Reaktionsordnung" und "Reaktionsmolekularität" werden oft verwechselt, daher soll auf dieser Seite einmal ganz klar der Unterschied zwischen diesen beiden Begriffen herausgearbeitet werden.
Reaktionsordnung
Unter der Reaktionsordnung versteht man die experimentell ermittelte Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration der Edukte. Dabei unterscheidet man:
- Reaktionen 0. Ordnung (vR = k)
- Reaktionen 1. Ordnung (vR = k * [A])
- Reaktionen 2. Ordnung (vR = k * [A] * [B]) oder (vR = k * c[A]2)
- Reaktionen 3. Ordnung (vR = k * [A] * [B]* [C]) oder (vR = k * c[A]2 * [B])
- Reaktionen gebrochener Ordnung (zum Beispiel vR = k * [A] * [B]1/2)
Bei Reaktionen 0. Ordnung hängt die Reaktionsgeschwindigkeit nicht von der Konzentration der Edukte ab, die Reaktion läuft - sofern überhaupt Edukte in ausreichender Konzentration vorhanden sind, mit konstanter Geschwindigkeit ab. Typisch ist das zum Beispiel für enzymatisch katalysierte Reaktion.
Bei Reaktionen 1. oder 2. Ordnung hängt die Reaktionsgeschwindigkeit von der Konzentration eines Eduktes A (1. Ordnung) oder zweier Edukte A, B oder A, A (2. Ordnung) ab. Gleiches gilt für die sehr seltenen Reaktionen 3. Ordnung, hier hängt die Reaktionsgeschwindigkeit von den Konzentrationen dreier Edukte A, B und C ab.
Bei Reaktionen gebrochener Ordnung ermittelt man Geschwindigkeitsgesetze, die durch kompliziertere Gleichungen ausgedrückt werden.
Auf die einzelnen genannten Reaktionsordnungen wird weiter unten auf dieser Seite noch näher eingegangen.
Reaktionsmolekularität
Unter der Reaktionsmolekularität versteht man die Anzahl der Teilchen (Atome, Moleküle, Ionen), die zusammenstoßen müssen, damit es zu einem Reaktionsschritt (einer Elementarreaktion) kommt. Man unterscheidet:
- monomolekulare Reaktionen
- bimolekulare Reaktionen
- trimolekulare Reaktionen
Die Reaktionsmolekularität kann nicht so einfach experimentell ermittelt werden wie die Reaktionsordnung. Außer bei ganz einfachen Reaktionen, die in einem einzigen Schritt ablaufen, besteht kein direkter Zusammenhang zwischen der Reaktionsordnung und der Reaktionsmolekularität. Die meisten Reaktionen, gerade in der organischen Chemie, laufen in mehreren Schritten ab.
Jeder dieser Schritte kann nach einem mono- oder bimolekularen Mechanismus verlaufen, ganz selten auch nach einem trimolekularen. Ein monomolekularer Einzelschritt einer solchen Reaktionskette ist immer eine Reaktion 1. Ordnung, ein bimolekularer Einzelschritt ist stets auch eine Reaktion 2. Ordnung. Trotzdem kann die Gesamtreaktion, also die Summe der Einzelschritte, eine abweichende Reaktionsordnung haben. Beispiele dafür werden wir auf dieser Seite noch kennenlernen.
Reaktionen erster Ordnung
Bei Reaktionen erster Ordnung hängt die Reaktionsgeschwindigkeit nur von der Konzentration eines Stoffes ab. Hier ein paar allgemeine Beispiele für Reaktionen 1. Ordnung:
$A \to B$
$v_{R} = -\frac{\Delta A}{\Delta t} = -k\cdot [A]$
Das könnte zum Beispiel eine Isomerisierung sein, bei der sich ein Molekül in ein isomeres Molekül umwandelt (Isomere = Moleküle mit gleicher Summenformel aber unterschiedlicher Struktur).
Das negative Vorzeichen bei diesem Beispiel (und dem nächsten) ist notwendig, da die Reaktionsgeschwindigkeit immer einen positiven Wert haben muss.
$A \to B + C$
$v_{R} = -\frac{\Delta A}{\Delta t} = -k\cdot [A]$
Diese Reaktion könnte ein Beispiel für eine Dissoziation sein, die Abspaltung eines Atoms oder einer Atomgruppe von einem Molekül. 2-Brom-propan beispielsweise gibt das Brom-Atom recht leicht als Bromid-Ion ab, übrig bleibt dann ein Propyl-Kation mit einer positiven Ladung am mittleren C-Atom.
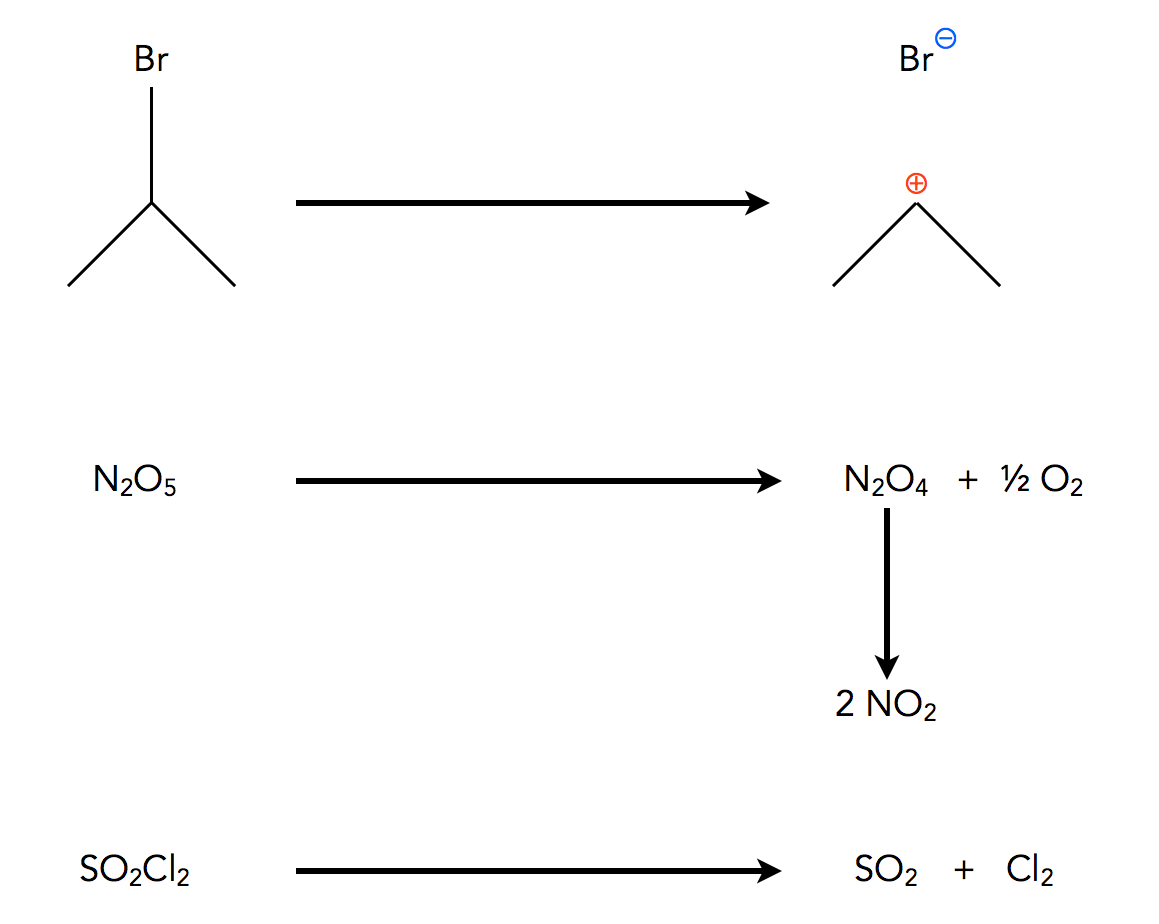
Vier Beispiele für Reaktionen 1. Ordnung
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Ein anderes Beispiel ist der Zerfall von Distickstoffpentoxid N2O5 in Distickstofftetroxid N2O4 und Sauerstoff ½ O2. Das dritte Beispiel ist der Zerfall von Distickstofftetroxid N2O4 in zwei Stickstoffdioxid-Moleküle 2NO2. Das vierte Beispiel ist der Zerfall von Sulforylchlorid SO2Cl2 in Schwefeldioxid SO2 und Chlor Cl2.
Fallbeispiel 1:
Wenden wir uns nun der folgende Reaktion zu:
$R-Br + OH^{-} \to R-OH + Br^{-}$
Betrachtet man diese Reaktionsgleichung, so würde man zunächst denken, dass die Umsetzung als Reaktion 2. Ordnung abläuft. Allem Augenschein nach hängt die Reaktionsgeschwindigkeit doch sicherlich von der Konzentration des Alkylbromids R-Br und von der Konzentration der Lauge (mit den OH--Ionen) ab, so dass für die Bildungsgeschwindigkeit von R-OH gilt:
$V_{R} = k \cdot c(R \mbox{-} Br) \cdot c(OH^{-})$
Stellt man nun aber die Reaktionsordnung experimentell fest, erhält man eine Reaktion 1. Ordnung:
$V_{R} = k \cdot c(R \mbox{-} Br)$
Die Reaktionsgeschwindigkeit hängt nur von c(R-Br) ab, nicht aber von c(OH-). Wie kommt es zu diesem Widerspruch?
Dazu muss man sich den Mechanismus der Reaktion genauer anschauen. Die Reaktion findet nämlich in zwei Schritten statt:
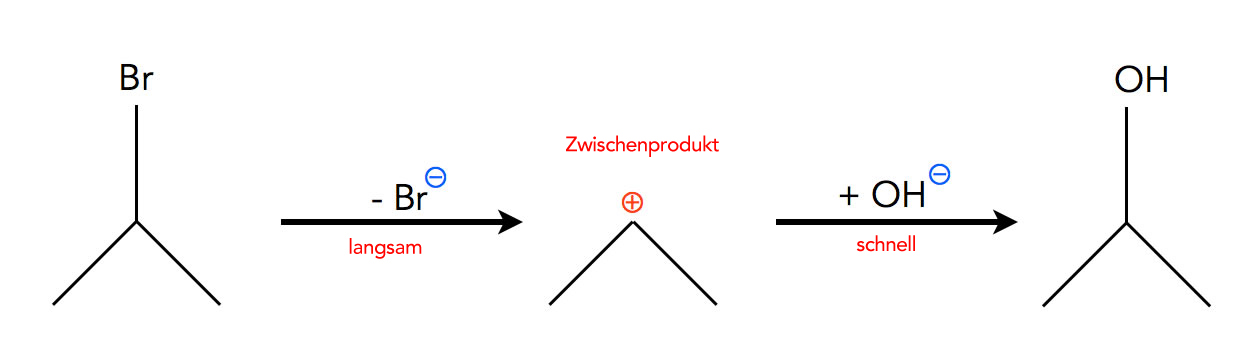
Eine zweischrittige Reaktion, eine Nucleophile Substitution nach dem SN1-Mechanismus.
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Im ersten Schritt spaltet R-Br - hier 2-Brom-propan - das Brom-Atom in Form eines Bromid-Ions ab. Dabei entsteht ein positiv geladenes Propyl-Kation.
Im zweiten Schritt lagert sich an dieses Propyl-Kation ein Hydroxid-Ion an, es bildet sich so der Alkohol R-OH.
Der erste Schritt ist eine monomolekulare Reaktion (Dissoziation = Zerfall eines Teilchens), und der zweite Schritt ist eine bimolekulare Reaktion , bei der zwei Teilchen zusammenstoßen müssen.
Die Reaktionsordnung der Gesamtreaktion hängt nun davon ab, wie schnell die beiden Schritte verlaufen. Ist die erste Reaktion schneller als die zweite, dann wird sehr schnell viel Zwischenprodukt gebildet. Dieser Teilschritt ist eine Reaktion 1. Ordnung, da es sich um eine Dissoziation handelt. Wenn der zweite Schritt nun langsamer ist als der erste, dann hängt die Geschwindigkeit der gesamten Reaktion von der Geschwindigkeit des zweiten Schrittes ab. Und der zweite Schritt ist bimolekular, daher sollte auch die Gesamtreaktion eine Reaktion 2. Ordnung sein.
Nun ist aber das Gegenteil der Fall: Der erste Schritt ist langsamer als der zweite, und daher hängt die Geschwindigkeit der Gesamtreaktion von der Geschwindigkeit des ersten Schrittes ab. Der erste Schitt ist hier der geschwindigkeitsbestimmende Schritt - ein wichtiger Fachbegriff übrigens
Da der geschwindigkeitsbestimmende Schritt der Reaktion eine monomolekulare Reaktion ist, ist die gesamte Reaktion eine Reaktion 1. Ordnung.
Man darf aber nicht sagen, dass die Gesamtreaktion eine monomolekulare Reaktion ist, denn die Begriffe "monomolekular" und "bimolekular" beziehen sich immer nur auf einen einzelnen Reaktionsschritt, auf eine Elementarreaktion. Auf eine Gesamtreaktion, die aus zwei oder mehreren Schritten besteht, darf man diese beiden Begriffe nicht anwenden.
Fallbeispiel 2:
Schauen wir uns ein anderes Fallbeispiel an, eine Reaktion, die jeder Schüler und jede Schülerin aus dem Chemieunterricht kennen sollte, nämlich die Reaktion von Salzsäure mit Zink:
$Zn (s) + 2 \ HCl (aq) \to ZnCl_{2} (aq) + H_{2} (g)$
Auf den ersten Blick könnte man denken, dass es sich um eine Reaktion 2. Ordnung handelt, da ja zwei Edukte auf der linken Seite der Gleichung stehen, Salzsäure und Zink. Und von der Salzsäure stehen sogar 2 "Exemplare" auf der linken Seite, da könnte man leicht auf den Gedanken kommen, dass bei der Reaktion drei Teilchen zusammenstoßen müssen, es sich also um eine Reaktion 3. Ordnung handelt.
Gibt man aber Zinkpulver im Überschuss in den Erlenmeyerkolben - so wie man es in der Regel macht - so hängt die Geschwindigkeit der Wasserstoff-Entwicklung ausschließlich von der Konzentration der Salzsäure ab. Solange sich das Zink im Überschuss befindet, hat die Zink-Menge überhaupt keinen Einfluss auf das Volumen an Wasserstoff, das sich pro Sekunde bildet. Daher gilt für diese Reaktion das Geschwindigkeitsgesetz:
$V_{R} = k \cdot c(HCl)$
Es handelt sich also um eine Reaktion 1. Ordnung. Trotzdem müssen die Protonen bzw. Oxonium-Ionen der Salzsäure auf Zink-Atome treffen, damit sich Wasserstoff und Zink-Kationen bilden können. Das ist eindeutig eine bimolekulare Reaktion. Sie erscheint dem Betrachter aber wie eine monomolekulare Reaktion, und wird daher gelegentlich als pseudomonomolekulare Reaktion bezeichnet. Eine Recherche in der Fachliteratur und im Internet ergab allerdings nicht allzu viele Ergebnisse für diesen Fachbegriff, er scheint nicht so verbreitet zu sein.
Reaktionen zweiter Ordnung
Bei den Reaktionen 2. Ordnung hängt die Reaktionsgeschwindigkeit von der Konzentration zweier Edukte ab. Die Reaktion von Salzsäure mit Natriumthiosulfat ist ein schönes Beispiel für eine bimolekulare Reaktion, genauso wie die Nucleophile Substitution, die nach dem SN2-Mechanismus in einem einzigen Schritt verläuft, bei dem zwei Teilchen zusammenstoßen müssen.
Auch die Hydrolyse von Estern unter basischer Katalyse ist eine Reaktion zweiter Ordnung. Der Reaktionsmechanismus ist sehr komplex und verläuft in mehr als zwei Schritten, von denen einige monomolekular, andere bimolekular sind. Aber offensichtlich ist der geschwindigkeitsbestimmende Schritt eine bimolekulare Reaktion, und damit ist die gesamte Esterhydrolyse eine Reaktion zweiter Ordnung.
Fallbeispiel 3:
Die Reaktion von Salzsäure Salzsäure mit Natriumthiosulfat hatten wir uns schon einmal angesehen. Hier noch einmal die Reaktionsgleichung:
$S_{2}O_{3}^{2-}(aq) + 2 H^{+} (aq) \to SO_{2} (g) + S (s) + H_{2}O (l)$
In dem Schulbuch "Chemie heute SII Einführungsphase" aus dem Schroedel-Verlag ist dieser Versuch sogar als Schülerexperiment dargestellt. Hier wird allerdings nur die Konzentration des Thiosulfats variiert. Daher könnte man meinen, dass die Umsetzung eine Reaktion 1. Ordnung ist mit dem Geschwindigkeitsgesetz
$V_{R} = k \cdot c(S_{2}O_{3(aq)}^{2-})$
Mir selbst kam diese Annahme im Chemieunterricht immer schon etwas eigenartig vor, hängt doch die Reaktionsgeschwindigkeit eindeutig auch von der Konzentration der Salzsäure ab. Wenn man gar keine Salzsäure in den Kolben gibt, kann die Reaktion auch nicht ablaufen.
In Wirklichkeit verhält sich die Sache etwas komplizierter. Bei einer einigermaßen großen HCl-Konzentration ist die Reaktionsgeschwindigkeit tatsächlich nicht von der Säure-Konzentration abhängig, sondern nur von der Thiosulfat-Konzentration. Bei niedrigen HCl-Konzentrationen jedoch hängt die Reaktionsgeschwindigkeit von beiden Konzentrationen ab, und zwar nach folgendem Geschwindigkeitsgesetz:
$v_{R} = \frac{k \cdot [H^{+}]}{1+k' \cdot [H^{+}]} \cdot [S_{3}O_{2}^{2-}]$
Es handelt sich also um eine Reaktion mit gebrochener Ordnung. Bei niedrigen HCl-Konzentrationen macht sich der Bruchterm durchaus bemerkbar, bei höheren HCl-Konzentrationen nähert sich der Wert des Bruchs dem Wert 1 an und verliert dadurch zunehmend an Bedeutung, so dass bei hohen HCl-Konzentrationen die Reaktionsgeschwindigkeit tatsächlich nur von der Konzentration der Thiosulfat-Ionen abhängt.
Fallbeispiel 4:
Wenden wir uns noch einmal der folgende Reaktion zu:
$R-Br + OH^{-} \to R-OH + Br^{-}$
Bei tertriären oder sekundären Alkylbromiden kann man experimentell meistens eine Reaktion 1. Ordnung feststellen. Bei primären Alkylhalogeniden, zum Beispiel bei 1-Brom-propan, findet man jedoch in der Regel eine Reaktion 2. Ordnung. Das liegt daran, dass bei primären Alkylhalogeniden eine sogenannte SN2-Reaktion abläuft, eine Nucleophile Substitution 2. Ordnung. Dieser Reaktionsmechanismus besteht nicht aus zwei Elementarschritten, sondern nur aus einem einzigen. In diesem Schritt stoßen tatsächlich zwei Teilchen aufeinander, nämlich das Alkylbromid und das Hydroxid-Ion. Es handelt sich also um eine bimolekulare Reaktion. Und da dieser Schritt der einzige Schritt der Reaktion ist, ist die Reaktion auch gleichzeitig eine Reaktion 2. Ordnung.
Fallbeispiel 5:
Und wieder eine interessante Reaktion
$NO_{2} \to NO + \frac{1}{2} O_{2}$
Stickstoffdioxid zerfällt zu Stickstoffmonoxid und Sauerstoff. Auf den ersten Blick eine Reaktion 1. Ordnung. Im Experiment stellt man jedoch fest, dass es sich um eine Reaktion 2. Ordnung handelt. Es müssen offensichtlich immer zwei NO2-Moleküle zusammenstoßen, damit es zur Reaktion kommt. Das Geschwindigkeitsgesetz ist daher
$V_{R} = k \cdot c(NO_{2} )^{2}$
und die Reaktionsgleichung sollte besser folgendermaßen formuliert werden, um dieser Tatsache Geltung zu verschaffen:
$2 \ NO_{2} \to 2 \ NO + O_{2}$
Reaktionen dritter Ordnung
Reaktionen 3. Ordnung sind sehr selten.
Fallbeispiel 6:
Ein bekanntes Lehrbuchbeispiel ist die Umsetzung von Stickstoffmonoxid NO und Brom zur Verbindung NOBr:
$2 NO + Br_{2} \to 2 NOBr$
Das Geschwindigkeitsgesetz dieser Reaktion lautet:
$v_{R} = k \cdot [NO]^{2} \cdot [Br_{2}]$
Diese Reaktionsordnung sagt überhaupt nichts über den Mechanismus der Reaktion aus. Es ist auch nicht gesagt, dass überhaupt ein trimolekularer Reaktionsschritt vorkommt, in dem drei Teilchen zusammenstoßen müssen.
Reaktionen 0. Ordnung
In der Biologie kennt man dieses Phänomen von den Enzymen. Gibt man beispielsweise eine Lösung von Stärke und etwas Amylase in ein Reagenzglas, so beginnt die Amylase (das Enzym), die Stärke zu zersetzen. Wenn im Reagenzglas jetzt aber nur - sagen wir mal - 10.000 Amylase-Moleküle vorhanden sind und ein Amylase-Molekül pro Sekunde 25.000 Stärke-Moleküle spalten kann, dann können im ganzen Reagenzglas pro Sekunde maximal 10.000 mal 25.000 = 250 Millionen Stärke-Moleküle zerlegt werden. Dann ist es egal, ob sich drei Milliarden oder zehn Milliarden Stärke-Moleküle im Reagenzglas befinden, die Reaktionsgeschwindigkeit der Stärke-Zerlegung hängt nicht von der Stärke-Konzentration ab. Wohl aber von der Konzentration des Katalysators. Erhöht man die Amylase-Menge, dann wird auch mehr Stärke pro Sekunde umgesetzt. Nun nimmt ein Katalysator aber formal nicht an der Reaktion teil - das ist ja das Wesen eines Katalysators - daher auch die Konzentration des Katalysators auch in keiner Geschwindigkeitsgleichung auf.
Ein anderes Beispiel sind photochemische Reaktionen. Kommt zum Beispiel die Spaltung eines Moleküls durch den Einfluss von UV-Licht zustande und ist die Menge des eingestrahlten UV-Lichts begrenzt, so kann pro Sekunde nur eine bestimmte Anzahl von Molekülen photolysiert (durch Licht gespalten) werden. Erhöht man die Konzentration des Eduktes, nicht aber gleichzeitig auch die Lichtintensität, so hat das keine Auswirkungen auf die Reaktionsgeschwindigkeit. Es findet eine Reaktion 0. Ordnung statt.