Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- von welchen Faktoren der Verlauf der elektrophilen Addition abhängt,
- insbesondere wie +I- und -I-Effekt die Elektronendichte der C=C-Doppelbindung beeinflussen und somit auch die Reaktivität eines Alkens,
- wie polare Lösemittel die Edukte und Zwischenprodukte stabilisieren,
- wieso die Bromierung von Cyclohexen ein wichtiger Beweis für den Rückseitenangriff ist,
- was die Markownikow-Regel besagt und wieso sie auf der Stabilität von Carbenium-Ionen beruht.

Elektrophile (und radikalische) Addition
In diesem Video von Ramona Reinhart werden die Mechanismen der beiden Additionsreaktionen anschaulich erklärt. Auch bzw. gerade auf die Bromierung von Ethen wird hier eingegangen.
Beispiel: Bromierung von Ethen
Zu diesem Thema gibt es jetzt eine Präsentation "Belege für den Mechanismus", die Sie gegen eine kleine Kostenbeteiligung von mir für Ihren Unterricht erhalten können".
Ein Standardbeispiel für die elektrophile Addition ist die Bromierung von Ethen, die wir bereits auf der ersten Seite kennengelernt haben. Hier noch einmal der Ablauf in Einzelschritten:
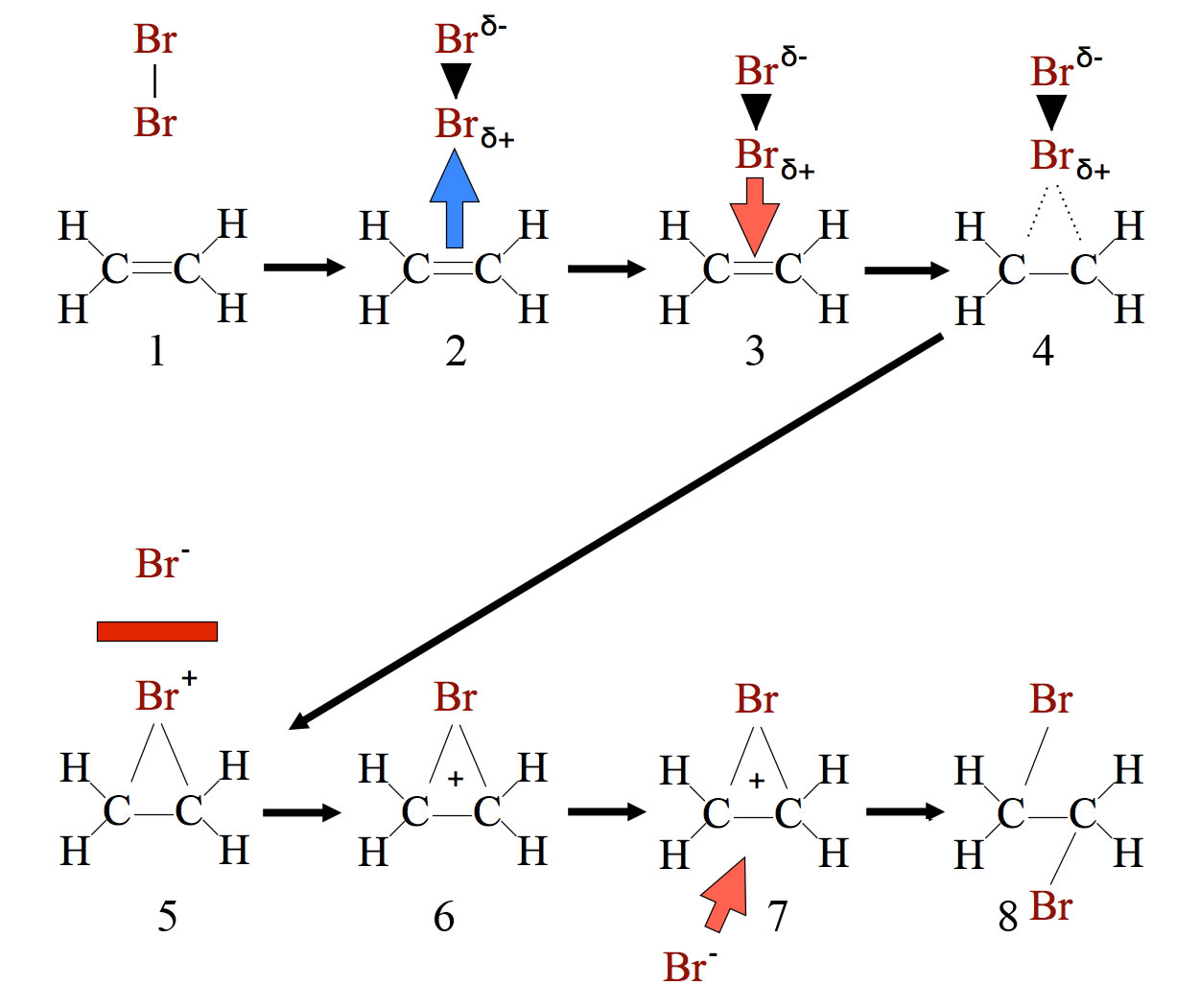
Die Bromierung von Ethen
Eine genaue Beschreibung dieser Bromierung finden Sie auf der Einführungsseite zur elektrophilen Addition.
Induktive Effekte «
Beginnen wir mit dem ersten entscheidenden Schritt, der Bildung des Pi-Komplexes aus der C=C-Doppelbindung und dem polarisiertem Brom-Molekül (Schritte 2 - 3 in der obigen Übersicht). Dieser Schritt ist der langsamste der gesamten Bromierung und bestimmt daher die Geschwindigkeit der Gesamtreaktion.
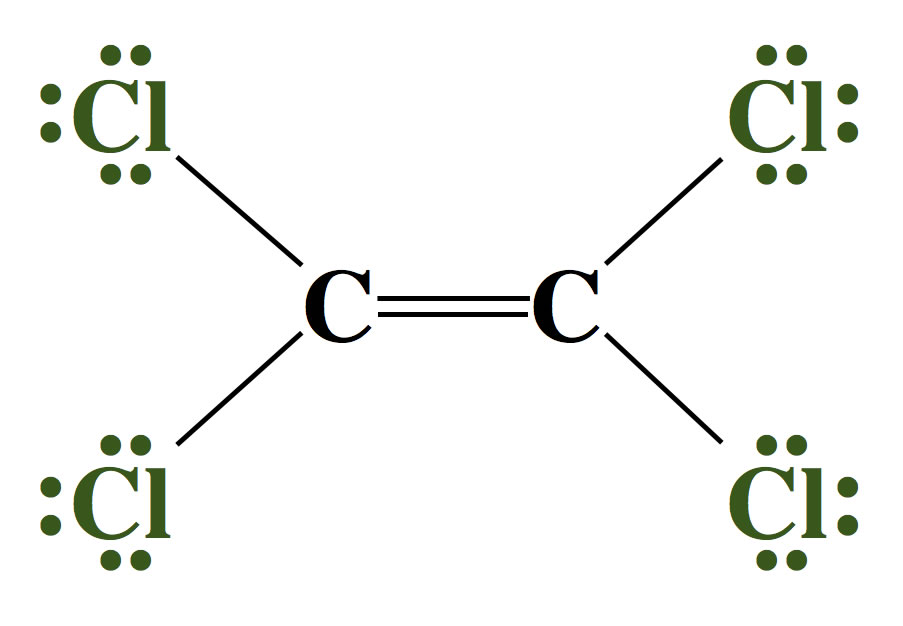
Das Tetrachlorethen-Molekül
Hier ist die Verbindung Tetrachlorethen abgebildet, die auch als PER (Perchlorethylen) bekannt ist. Diese Verbindung hat eine C=C-Doppelbindung, reagiert aber so gut wie gar nicht mit Bromwasser. Wie kommt das?
Ein negativer induktiver Effekt macht die Doppelbindung weniger reaktiv
Die Cl-Atome sind sehr elektronegativ, ziehen also die Bindungselektronen der C-Cl-Bindungen recht stark an (negativer induktiver Effekt). An den C-Atomen entsteht so eine positive Teilladung:
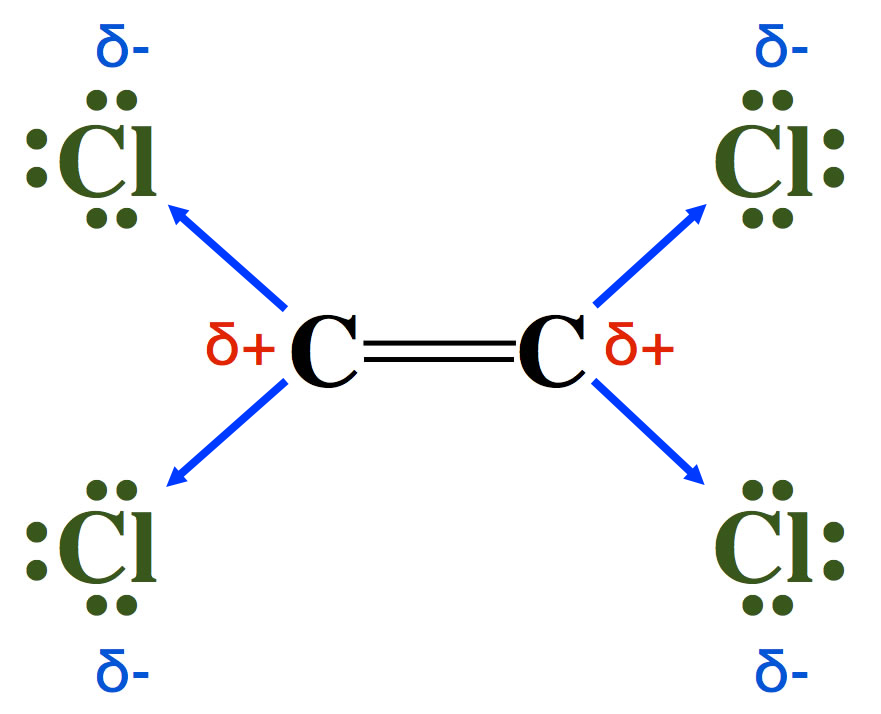
Das Tetrachlorethen-Molekül
Die Elektronendichte an den C-Atomen der Doppelbindung verringert sich, und daher werden elektrophile Teilchen nicht mehr so stark angezogen.
Ein positiver induktiver Effekt macht die Doppelbindung reaktiver
Umgekehrt ist es bei Alkylgruppen an der Doppelbindung. Alkylgruppen haben einen positiven induktiven Effekt (+I-Effekt).
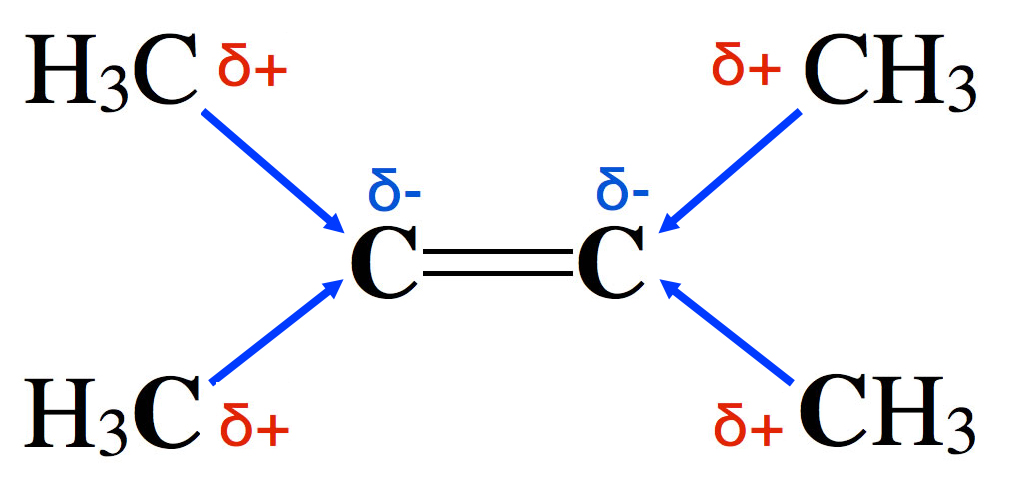
Das 2,3-Dimethyl-but-2-en-Molekül
Das hier abgebildete 2,3-Dimethyl-but-2-en hat also eine besonders hohe Elektronendichte an der C=C-Doppelbindung und ist damit reaktiver als beispielsweise das "normale" But-2-en.
Die C=C-Doppelbindung ist elektronenreich und zieht damit elektrophile Teilchen an. Dieser Effekt kann durch elektronenziehende Substituenten (-I-Effekt) stark abgeschwächt werden. Durch elektronenschiebende Substituenten (+I-Effekt) dagegen kann der Effekt sogar verstärkt werden.
Lösemitteleffekte «
Das Brom-Molekül wird bei der Bromierung eines Alkens durch die C=C-Doppelbindung vorübergehend polarisiert (induzierter temporärer Dipol). Ein polares Lösemittel wie Wasser unterstützt diesen Vorgang. Einige Wasser-Moleküle gruppieren sich mit ihrem negativen Pol um das leicht positive Br-Atom und andere Wasser-Moleküle umgeben mit ihrem positiven Pol das leicht negative Br-Atom:
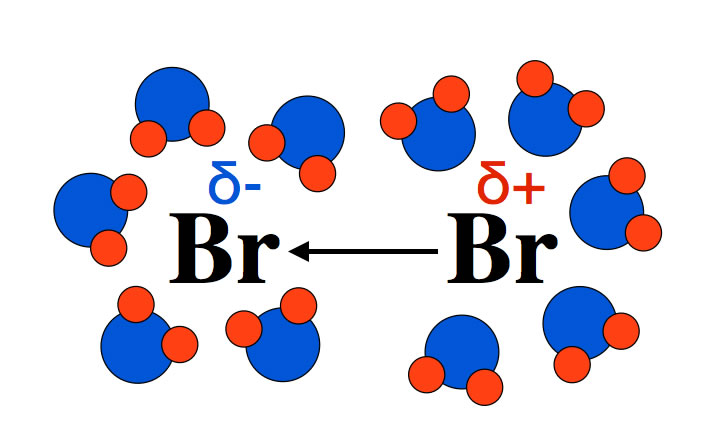
Wasser-Moleküle stabilisieren den induzierten temporären Br2-Dipol
Löst man das Brom in einem polaren Lösemittel wie z.B. Wasser, so erfolgt die Bromierung des Alkens recht schnell. Wird das Brom dagegen in einem unpolaren Lösemittel wie z.B. CCl4 gelöst, so dauert die Bromierung des Alkens deutlich länger. Wasser und andere polare Lösemittel stabilisieren nämlich den temporären Dipol Br2, so dass es häufiger zur Bildung von Pi-Komplexen im Eduktgemisch kommt.
In polaren Lösemitteln verläuft die Bromierung schneller als in unpolaren Lösemitteln, weil der temporäre Dipol durch die polaren Lösemittelmoleküle besser stabilisiert werden kann.
Rückseitenangriff «
Der folgende Versuch bestätigt die Vermutung, dass das Bromid-Ion die Doppelbindung von der Rückseite her angreift:
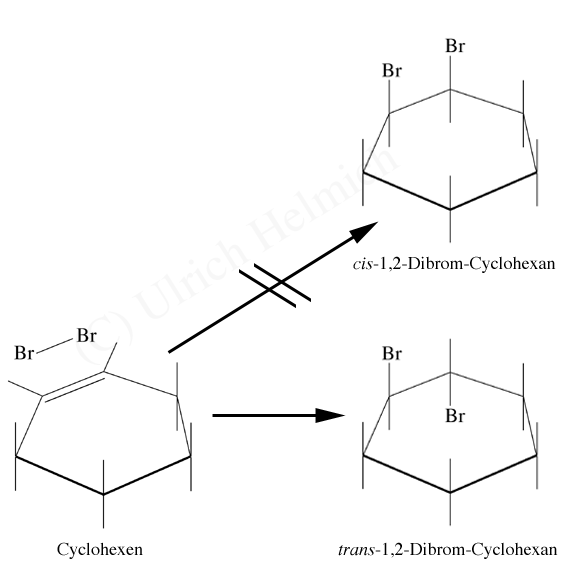
Bei der Bromierung von Cyclohexen können zwei Additionsprodukte entstehen
Wenn man Cyclohexen bromiert, können zwei verschiedene Reaktionsprodukte entstehen:
- Durch syn-Addition das cis-1,2-Dibrom-Cyclohexan,
- durch anti-Addition das trans-1,2-Dibrom-Cyclohexan.
Das Produktverhältnis ist recht interessant: Es bildet sich zu mehr als 85% das trans-Bromierungsprodukt. Diese Tatsache lässt sich gut mit einem Rückseitenangriff des Bromid-Ions erklären. Die Addition von Brom an Cyclohexen ist also eine anti-Addition.
Die Tatsache, dass sich auch ca. 15% cis-Produkt bilden, lässt sich damit erklären, dass das Bromonium-Ion mit dem entsprechenden Carbenium-Ion im Gleichgewicht steht. Das sp2-hybridisierte, positiv geladene C-Atom dieses Ions kann dann von beiden Seiten von dem Nucleophil angegriffen werden, so dass cis- und trans-Produkte gleichermaßen entstehen.
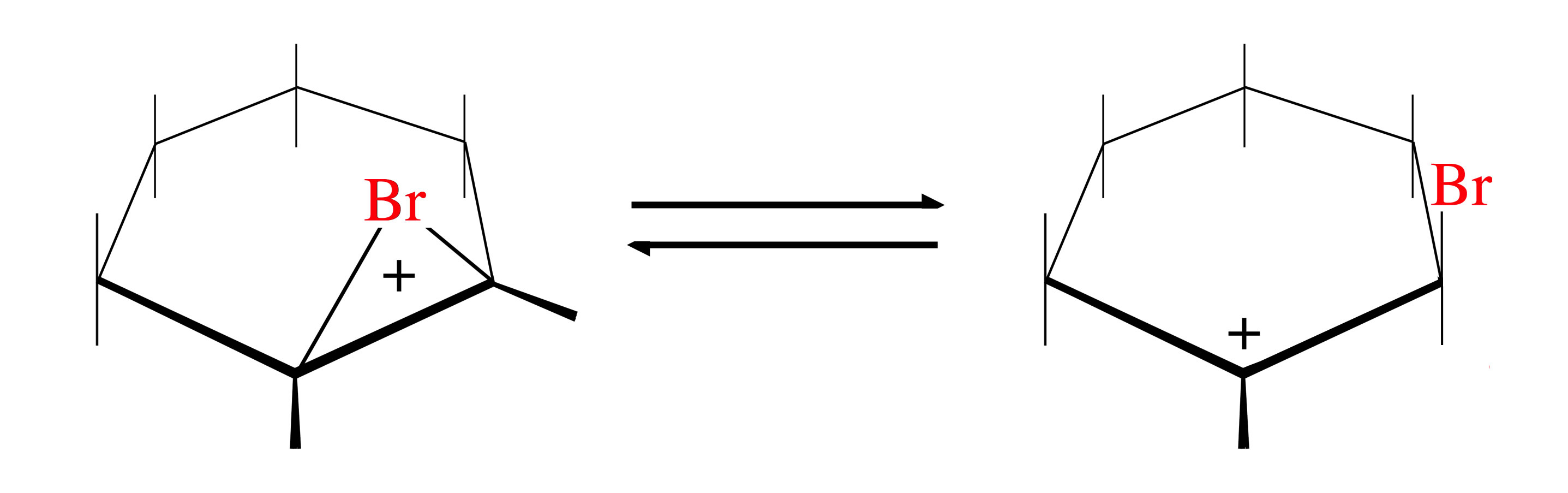
Chemisches Gleichgewicht zwischen Bromonium- und Carbenium-Ion
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die Bildung des Bromonium-Ions «
Der entscheidende Punkt bei der Bromierung eines Alkens ist die Anlagerung des polarisierten Brom-Moleküls an die C=C-Doppelbindung. Mit seinem positiven Ende dringt der Brom-Dipol in die Elektronenwolken der Doppelbindung ein. Was nun passiert, kann man mit Hilfe einer weiteren Abbildung am besten erklären:

Das Bromonium-Ion im Kugelwolkenmodell
Autor: Ulrich Helmich 2012, Lizenz: Public domain.
Das Br+-Ion, das ja durch heterolytische Spaltung des Br2-Moleküls entstanden ist, hat zwei doppelt besetzte Orbitale und zwei einfach besetzte. Die pi-Bindung der C=C-Doppelbindung hat sich in ihre beiden p-Orbitale aufgetrennt, und jedes dieser einfach besetzten Orbitale überlappt jetzt mit einem der einfach besetzten Orbitale des Br+-Ions.
Die positive Ladung ist nicht mehr auf das Br+-Ion beschränkt, sondern verteilt sich über den ganzen Ring aus dem Br-Atom und den beiden C-Atomen der ursprünglichen Doppelbindung. Man spricht hier auch von einer Delokalisierung der positiven Ladung (Näheres siehe "Bromonium-Ion" im Lexikon).
Markownikow-Regel «
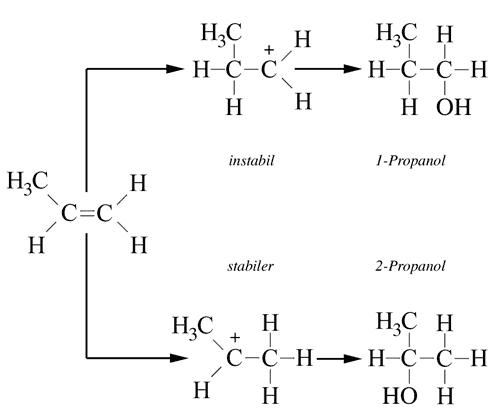
Es bildet sich vorzugsweise das stabilere Carbenium-Ion
Viele Elektrophile sind bereits polarisiert, beispielsweise HBr oder H2O. Es muss also nicht wie bei der Bromierung erst ein induzierter Dipol gebildet werden. Solche Elektrophile spalten im ersten Schritt ein Proton ab, welches sich dann an die C=C-Doppelbindung anlagert. Es entsteht ein Carbenium-Ion.
Bei symmetrischen Alkenen wie Ethen spielt es keine Rolle, an welches der beiden C-Atome sich das Proton anlagert. Bei unsymmetrischen Alken dagegen wie Propen kann sich das Proton an zwei verschiedene Stellen des Moleküls anlagern.
Betrachten wir dazu das obere Bild. Wenn sich das Proton an das "linke" C-Atom der Doppelbindung anlagert (oberer Reaktionsweg), dann entsteht ein primäres Carbenium-Ion. Lagert sich das Proton aber an das "rechte" C-Atom der Doppelbindung an (unterer Reaktionsweg), so entsteht ein sekundäres Carbenium-Ion.
Nun ist es aber so, dass das sekundäre Carbenium-Ion stabiler ist als das primäre. Es entsteht also bevorzugt. Genau diesen Sachverhalt beschreibt die so genannte Markownikow-Regel, die nach dem russischen Chemiker Wladimir Wassiljewitsch Markownikow benannt ist. Im obenstehenden Beispiel entsteht daher hauptsächlich 2-Propanol.
Tertiäre Carbenium-Ionen sind noch stabiler als sekundäre (eine Folge des +I-Effekts der Alkylgruppen), daher würde die Verbindung 2-Methyl-propen noch schneller mit Wasser zu einem Alkohol reagieren.
Die Markownikow-Regel besagt, dass bei einer elektrophilen Addition stets das Carbenium-Ion als Zwischenprodukt entsteht, das am stabilsten ist.