Allgemeines
Allgemein kann man sagen, dass Monosaccharide (Einfachzucker) chemisch im Grunde nichts anderes sind als Aldehyde oder Ketone mit drei oder mehr C-Atomen, die viele OH-Gruppen besitzen. Umgekehrt könnte man Monosaccharide als mehrwertige Alkohole bezeichnen, die eine Aldehyd- oder Keto-Gruppe besitzen.
Monosaccharide sind die Bausteine der Disaccharide (Zweifachzucker wie zum Beispiel Lactose oder Saccharose), der Oligosaccharide und der Polysaccharide (wie zum Beispiel Stärke oder Cellulose).
Die wichtigsten Monosaccharide sind sicherlich Glucose, Fructose und Galactose. Glucose ist als Traubenzucker bekannt, Fructose als Fruchtzucker, und Galactose (Schleimzucker) ist ein Baustein der Lactose (Milchzucker).
Erwähnt werden sollte auch die Xylose, das mengenmäßig zweitwichtigste Monosaccharid auf der Erde, Bestandteil der Zellwände und das Holzes von Pflanzen. Auch Ribose und Desoxyribose sollten kurz erwähnt werden, sie sind Bausteine der RNA bzw. DNA.
Strukturen
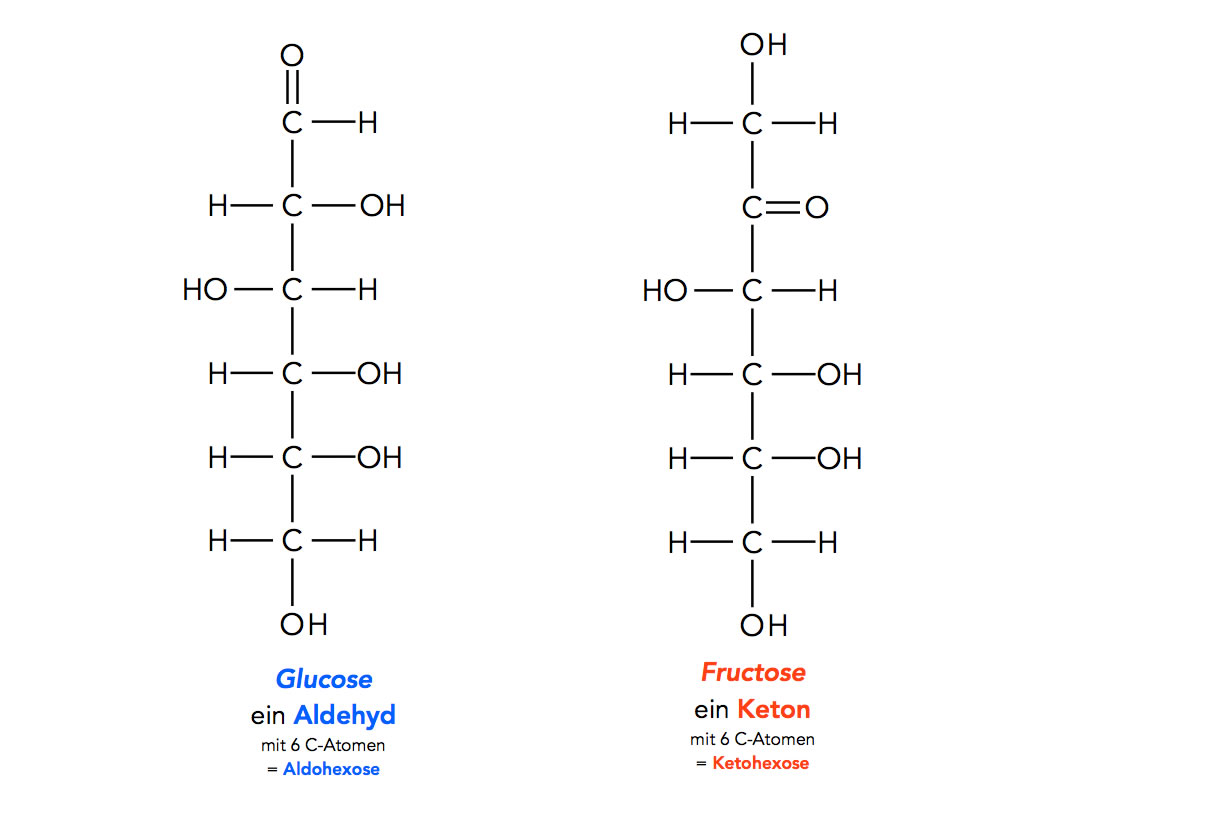
Das Glucose- und das Fructose-Molekül
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Das Grundgerüst beider Monosaccharide ist eine Kette aus sechs C-Atomen. Jedes C-Atom trägt eine OH-Gruppe. Bei der Glucose ist das erste C-Atom oxidiert, hier liegt eine Aldehyd-Gruppe vor, während bei der Fructose das zweite C-Atom oxidiert ist, so dass eine Keto-Gruppe entsteht.
Die Kettenstrukturen kommen allerdings nur in sehr geringem Maße vor. In wässriger Lösung oder wenn die Monosaccharide als Baustein von Di-, Oligo- oder Polysacchariden vorkommen, bilden die Moleküle einen Ring aus fünf oder sechs Atomen:
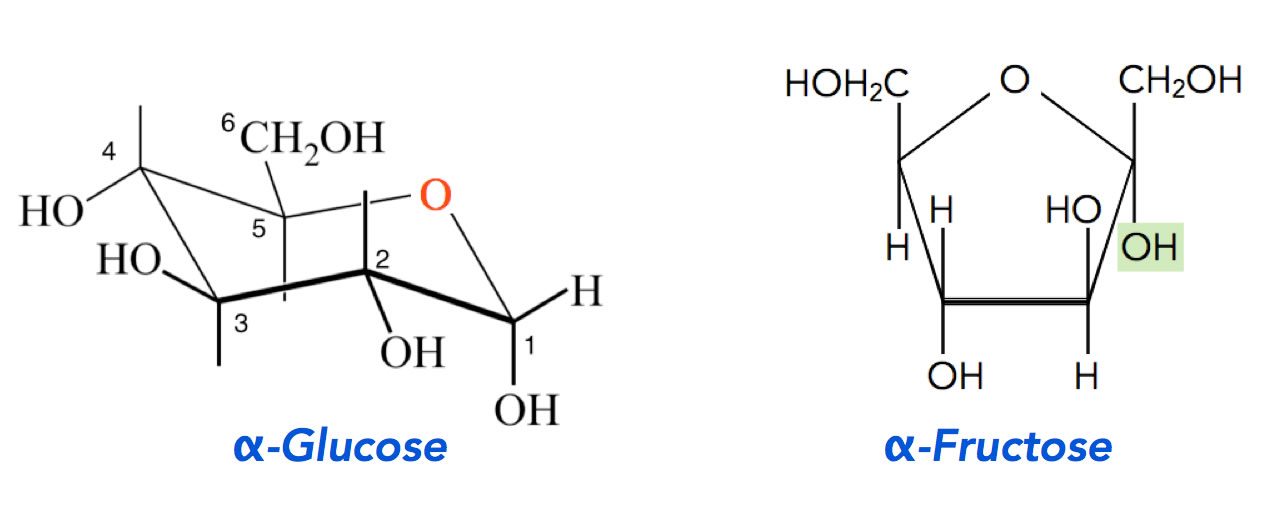
Glucose und Fructose als zwei Stellvertreter der Monosaccharide
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Ringbildung durch Halbacetal-Bildung
Hier sehen wir die Glucose und die Fructose in der Ringstruktur, die in wässriger Lösung am meisten vorkommen. Die Ringbildung erfolgt folgendermaßen:
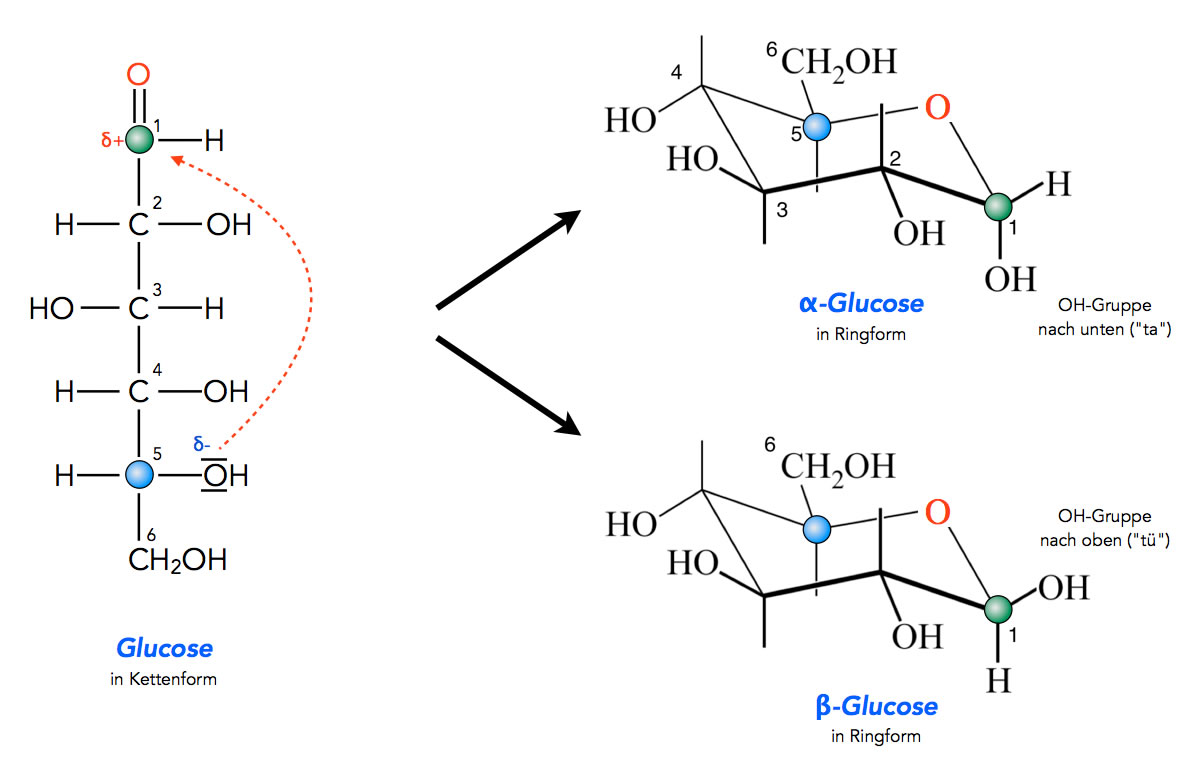
Ringbildung bei der Glucose
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Die OH-Gruppe am 5. C-Atom der Glucose-Kette reagiert mit der C=O-Gruppe an Position 1.
Mutarotation

Die Ringbildung ist eine Gleichgewichtsreaktion
Autor: Ulrich Helmich, Lizenz: Public domain.
Wie man auf diesem Bild gut sehen kann, ist die Ringbildung eine Gleichgewichtsreaktion. Die alpha-Form des Monosaccharids (hier Glucose) kann sich über die offenkettige Form in die beta-Form umwandeln und umgekehrt. Diesen Vorgang bezeichnet man als Mutarotation.
Halbacetalbildung
Bei der Ringbildung handelt es sich um einen Spezialfall der nucleophilen Addition, nämlich um die Bildung eines Halbacetals.
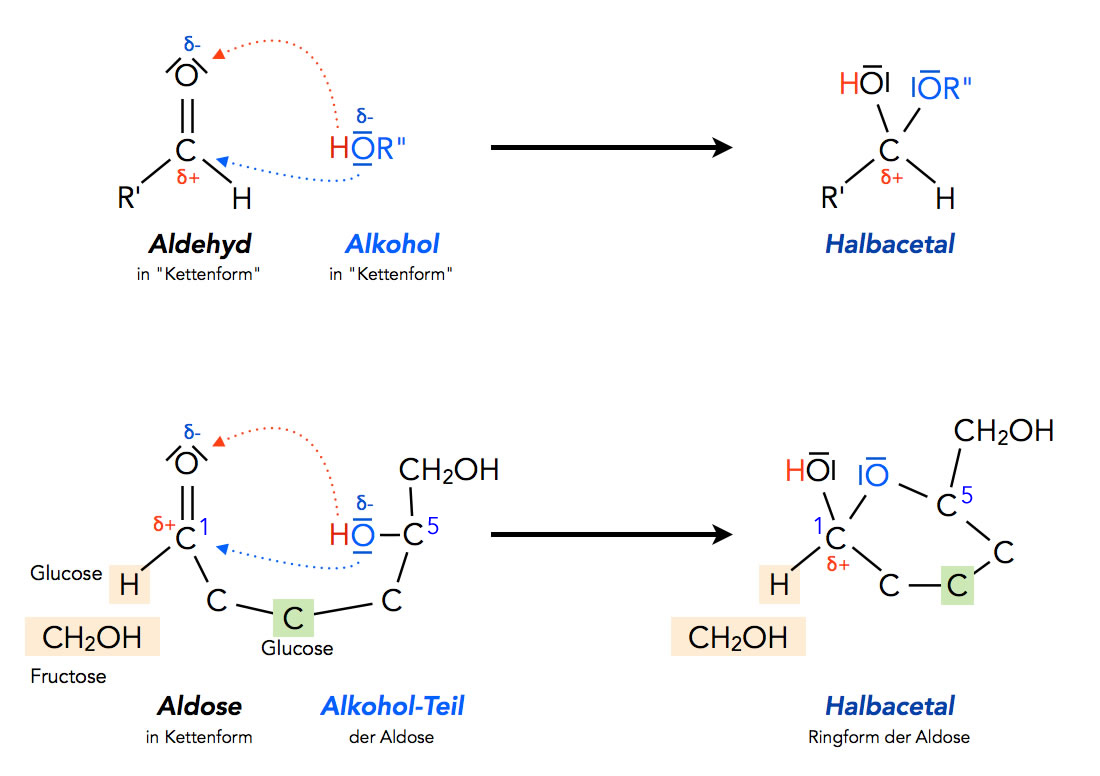
Bildung eines Halbacetals allgemein und bei einer Aldose bzw. Ketose
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Das C-Atom der Carbonylgruppe (C1) ist positiv polarisiert, da das O-Atom stark elektronegativ ist und die Bindungselektronen stärker anzieht als das C-Atom. Das O-Atom der OH-Gruppe am Atom C5 ist dagegen negativ polarisiert und wird von dem C1-Atom angezogen. Bei der Reaktion öffnet sich die C=O-Doppelbindung, und eine Bindung zum O-Atom der OH-Gruppe des C5-Atoms bildet sich aus. Das H-Atom dieser OH-Gruppe wird dann auf das ehemalige Carbonyl-O-Atom am C1-Atom übertragen.
α- und β-Isomere durch Ringbildung
Durch die Ringbildung entsteht ein zusätzliches Chiralitätszentrum. Das soll am Beispiel eines anderen Monosaccharids erläutert werden, der Xylose, einer Aldopentose.
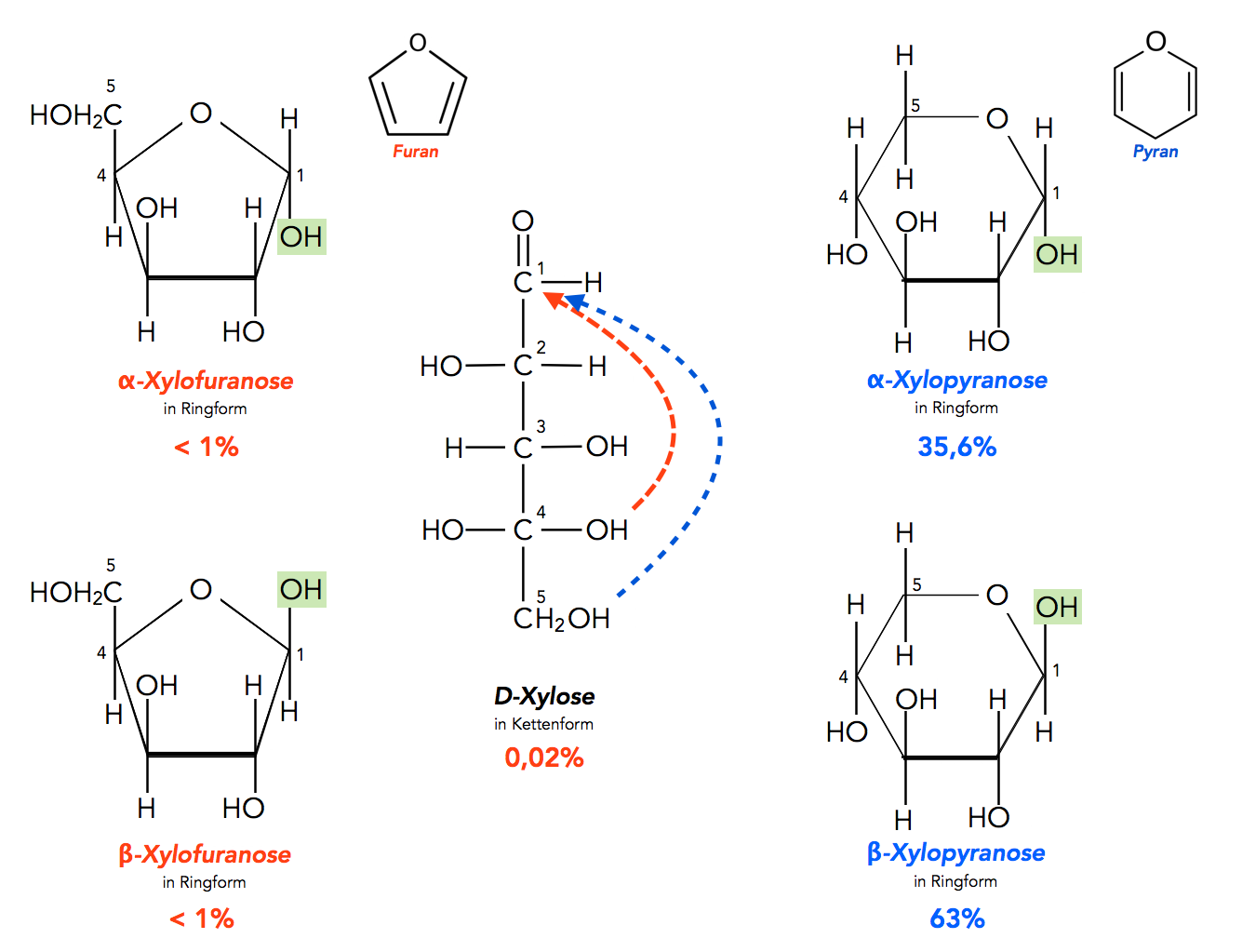
Ringbildung bei der D-Xylose und Anteile der verschiedenen Varianten
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Xylose ist nach Glucose das mengenmäßig häufigste Monosaccharid auf diesem Planeten, denn alle Pflanzenzellwände sowie Holz enthalten Xylose als Baustein.
Das Xylose-Molekül kann in drei Formen existieren. Einmal als Kette (in der Bildmitte gezeigt), dann in Form eines 5er Rings (links) und in Form eines 6er Rings (rechts). Die 5er Ringe der Monosaccharide werden als Furanosen bezeichnet, nach dem einfachen Furan-Molekül. Die 6er Ringe werden entsprechend als Pyranosen bezeichnet, nach dem einfachen Pyran-Molekül.
Die Kettenform der Xylose hat drei Chiralitätszentren, nämlich an den C-Atomen 2, 3 und 4, demnach existieren acht ( = 23) Stereoisomere der Xylose, vier D-Isomere und vier L-Isomere. Die L-Isomere kommen in der Natur so gut wie nicht vor, daher interessieren vor allem die D-Isomere.
Die Furanoseform des Monosaccharids entsteht, wenn die OH-Gruppe am C4-Atom mit der Carbonylgruppe (C1) reagiert (rot markierter Weg in der Abbildung). Die Pyranoseform entsteht dagegen, wenn die OH-Gruppe am C5-Atom mit der C=O-Gruppe reagiert (blau markierter Weg).
Durch die Ringschließung entsteht ein weiteres Chiralitätszentrum am C1-Atom, das jetzt mit vier verschiedenen Gruppierungen verbunden ist. Auf diese Weise gibt es zwei verschiedene Isomere der D-Xylose, nämlich die α-Xylose mit der OH-Gruppe am C1-Atom in trans-Stellung zum C5-Atom, und die β-Xylose mit dieser OH-Gruppe in cis-Stellung zum C5-Atom.
Beide Ringsysteme sind stabil, sowohl der 5er Ring wie auch der 6er Ring. In dem 5er Ring können die C-Atome und das O-Atom Bindungswinkel von ca. 109 Grad ausbilden, was dem Tetraederwinkel entspricht. Ringspannungen treten hier so gut wie gar nicht auf, daher ist der 5er Ring sehr stabil.
Konformationen der Pyranoseformen
Der 6er Ring liegt in einer von zwei Konformationen vor, bei denen die C-Atome ebenfalls Bindungswinkel von ca. 109 Grad ausbilden können. Es gibt hier die Sesselkonformation und die Wannenkonformation.
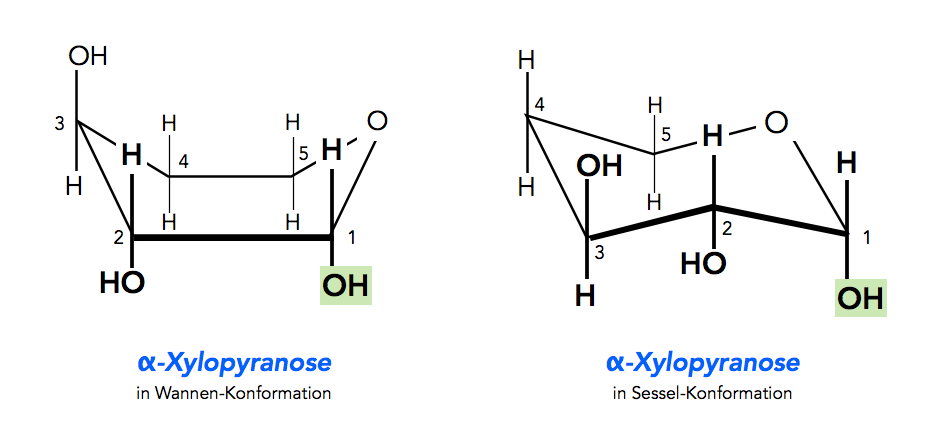
Die Wannen- und Sesselkonformation der α-Xylopyranose
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Eine völlig planare Konformation wie z.B. im Benzolring wäre hier sehr spannungsreich. Im Benzolring sind die C-Atome bekanntlich sp2-hybridisiert und können Bindungswinkel von 120 Grad ausbilden, was genau den Winkeln eines Sechsecks entspricht. Bei den Monosacchariden dagegen liegen alle C-Atome der Ringstruktur in sp3-Form vor, streben also Bindungswinkel von 109 Grad an.
Quellen:
- Fox, Whitesell: Organische Chemie, Heidelberg Berlin 1995.
- Römpp Chemie-Lexikon, 9. Auflage 1992