 |
 |
 |
|
| Brandfördernd | Ätzend | Reizend |
1. Einführung
Propansäure C2H5-COOH ist das dritte Glied in der homologen Reihe der Monocarbonsäuren nach Methansäure (Ameisensäure) und Ethansäure (Essigsäure).
2. Strukturdaten
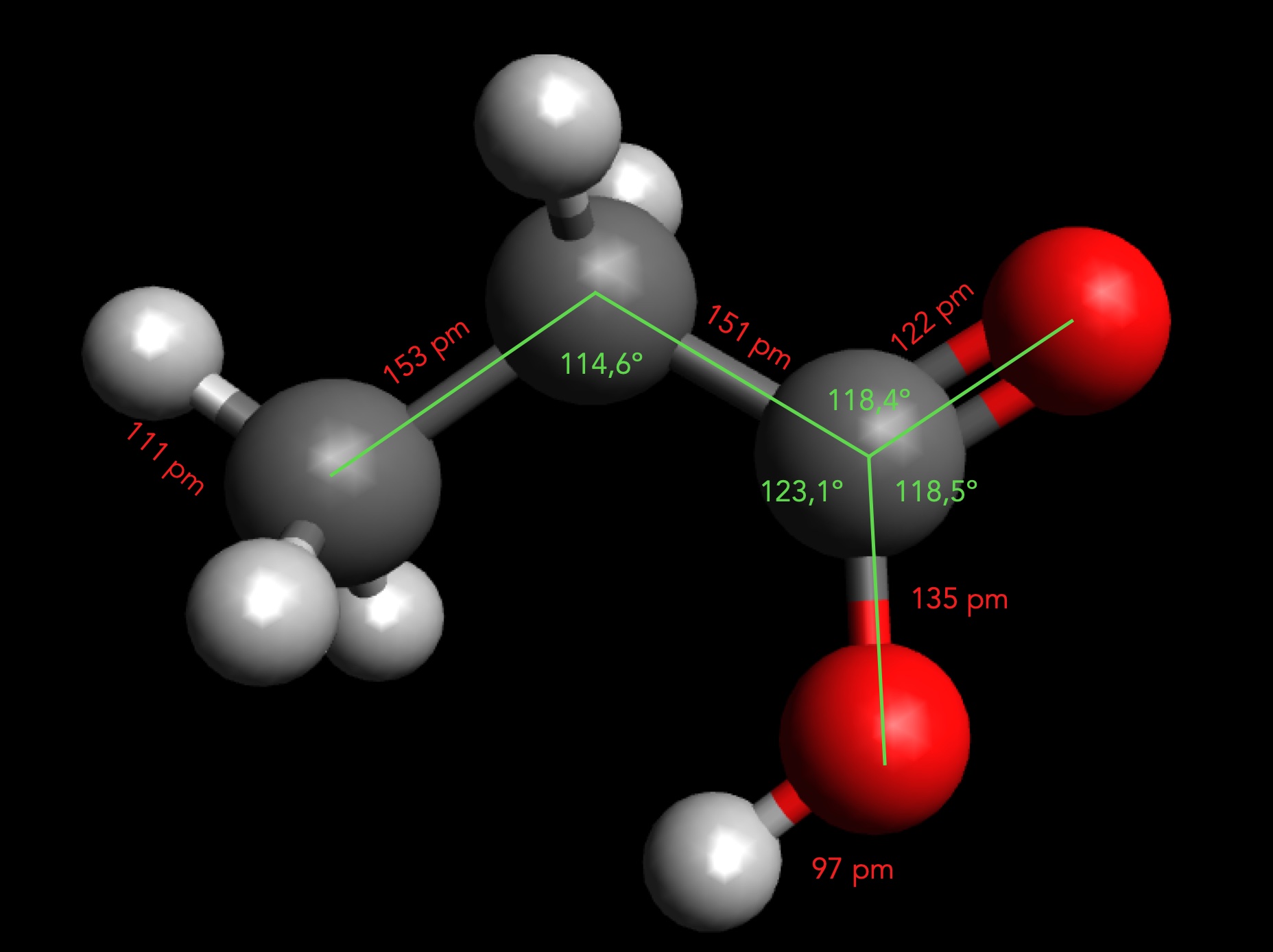
Das Propansäure-Molekül
Autor: Ulrich Helmich 2025, Lizenz: Public domain
Die Bindungswinkel und Bindungslängen wurden mit der Messfunktion der Software Avogadro ermittelt, nachdem zuvor die energetisch günstigste Konformation erzeugt wurde.
Der C-C-C-Bindungswinkel weicht mit 114,6º recht stark vom Tetraederwinkel (109,5º) ab. Die drei Bindungswinkel am sp2-hybridisierten C-Atom der COOH-Gruppe entsprechen in etwa dem idealen Winkel von 120º (C-C-OH = 123,1º, C-C=O = 118,4º und O=C-OH = 118,5º).
Die Bindungslängen zwischen den C-Atomen betragen 153 pm, die Bindungslänge der O-H-Bindung liegt bei nur 135 pm. Die C=O-Doppelbindung ist 122 pm lang.
3. Physikalische Eigenschaften
Überblick
| Molare Masse | 74,08 g/mol |
| Schmelztemperatur | -21 ºC |
| Siedetemperatur | 141 ºC |
| Dichte | 0,99 g/cm3 |
| Aggregatzustand bei 20 ºC | flüssig |
| Farbe | farblos |
| Geruch | stechend |
| Wasserlöslichkeit | unbegrenzt [1], 370 g/l [2] |
| Dipolmoment | 0,63 D [3] |
| Brennbarkeit/Zündtemperatur | 485 ºC |
| Sonstiges | Die Dämpfe bilden bei erhöhter Temperatur mit Luft explosive Gemische |
3.1 Schmelz- und Siedepunkte
Der Schmelzpunkt von Propansäure liegt bei -21 ºC, der Siedepunkt bei 141 ºC. Wie bei allen Carbonsäuren sind die Werte für die Siedetemperaturen sehr hoch, da die Moleküle nicht nur Dipoleigenschaften besitzen (Dipolmoment nur 0,63 D), sondern zudem auch noch H-Brücken untereinander ausbilden können, da die OH-Gruppe sowohl H-Brücken-Donator wie auch H-Brücken-Akzeptor ist. Außerdem ist das O-Atom der Carbonylgruppe ein zusätzlicher H-Brücken-Akzeptor, so dass die Moleküle noch mehr H-Brücken untereinander bilden können als beispielsweise Alkohole.
| Verbindung | Siedetemperatur in ºC |
| Pentan | 36 |
| Butanal | 75 |
| Butan-1-ol | 118 |
| Propansäure | 141 |
Von den hier gezeigten vier Verbindungen mit vergleichbarer molarer Masse hat die Propansäure den höchsten Siedepunkt.
3.2 Löslichkeitsverhalten
Die Wasserlöslichkeit ist im Vergleich zu Methan- und Ethansäure, die sich unbegrenzt mit Wasser mischen lassen, laut Wikipedia recht klein mit nur 360 Gramm pro Liter Wasser. Nach Römpp [1] und Seilnacht [4] ist Propansäure jedoch unbegrenzt mit Wasser mischbar. Wer hat nun Recht? Im Zweifelsfall der Römpp.
3.3 Weitere Eigenschaften
Propansäure ist bei Zimmertemperatur eine farblose und klare, aber deutlich viskose (ölige) Flüssigkeit mit einer Dichte von 0,99 g/cm3.
4. Gewinnung und Synthese
Rein theoretisch kann Propansäure auf mehrere Weisen hergestellt werden. Die bekanntesten Methoden dürfte die Oxidation von Propanal sein.
4.1 Oxidation von Propanal
Eines der industriellen Verfahren zur Synthese von Propansäure ist die Oxidation von Propanal. Propanal wird aus Produkten der Petrochemie hergestellt und steht daher in großen Mengen und zu günstigen Preisen zur Verfügung.
$CH_3 CH_2 CHO + \frac{1}{2} O_2 \to CH_3 CH_2 COOH $
Die Reaktion mit Luftsauerstoff erfolgt bei relativ niedrigen Temperaturen von 30 bis 50 ºC und bei geringen Drücken von nur 1 bis 3 bar. Als Katalysator wird Mangan(II)-propionat, also das Mangansalz der Propansäure, verwendet. Im Grunde könnte man hier schon fast von einer Autoprotolyse sprechen, da das Mangansalz ja ein Produkt der Propansäure selbst ist.
4.2 Hydrocarboxylierung von Ethen
Das zweite wichtige industrielle Verfahren zur Synthese von Propansäure ist die Reaktion von Ethen mit Kohlenmonoxid und Wasser über einen Ni(CO)4-Katalysator.
$H_2C =C H_2 + CO + H_2O \to CH_3 CH_2 COOH $
Hier sind die Temperaturen und Drücke wesentlich höher als bei der Propanal-Oxidation: 250 bis 320 ºC und 100 bis 300 bar.
4.3 Gewinnung aus Biogas
Propansäure kann auch aus Biogas gewonnen werden.
5. Reaktionen
5.1 Säure-Verhalten
Genau wie alle Carbonsäuren ist auch die Propansäure eine mittelstarke Säure. Das H-Atom der COOH-Gruppe wird relativ leicht als Proton an einen geeigneten Protonen-Akzeptor abgegeben. Der pKS-Wert der Propansäure liegt bei 4,87.
Vergleichen wir die pKS-Werte einiger Alkansäuren:
- Ameisensäure bzw. Methansäure = 3,77
- Essigsäure bzw. Ethansäure = 4,59
- Propionsäure bzw. Propansäure = 4,87
- Buttersäure bzw. Butansäure = 4,82
- Valeriansäure bzw. Pentansäure = 4,84
- Capronsäure bzw. Hexansäure = 4,85
Offensichtlich hängt die Säurestärke von der Zahl der C-Atome ab, je weniger C-Atome, desto stärker die Säure. Ameisensäure hat den kleinsten pKS-Wert und somit die größte Säurestärke der sechs aufgelisteten Monocarbonsäuren.
Aber ab der Propansäure scheint die Zahl der C-Atome keinen Einfluss mehr auf die Säurestärke zu haben. Propansäure bis Hexansäure haben alle den fast gleichen pKS-Wert und damit die fast gleiche Säurestärke.
5.2 Substitution am Carboxy-C-Atom
Die OH-Gruppe der Carboxy-Gruppe kann relativ leicht gegen andere Nucleophile ausgetauscht werden. Allerdings verläuft diese Nucleophile Substitution nicht nach dem üblichen SN1- oder SN2-Mechanismus, sondern nach dem sogenannten Additions-Eliminierungs-Mechanismus.
Additions-Eliminierungs-Mechanismus
Bei der SN1 wird im ersten Schritt das Nucleofug eliminiert und im zweiten Schritt das Nucleophil addiert.
Bei der SN2 wird in einem einzigen Schritt das neue Nucleophil addiert und gleichzeitig das Nucleofug eliminiert.
Beim Additions-Eliminierungs-Mechanismus dagegen wird im ersten Schritt das neue Nucleophil addiert, das O-Atom der Carboxy-Gruppe übernimmt die negative Ladung. Im zweiten Schritt wird dann die OH-Gruppe als Nucleofug eliminiert.
Auf der Lexikon-Seite "Additions-Eliminierungs-Mechanismus" ist dieser Mechanismus ausführlich beschrieben.
Durch diesen Additions-Eliminierungs-Mechanismus können eine Vielzahl von Carbonsäure-Derivaten gebildet werden, vor allem:
5.3 Reduktion
Carbonsäuren - und so auch die Propansäure - können mit geeigneten Reduktionsmitteln zu Aldehyden und sogar zu primären Alkoholen reduziert werden.
Siehe dazu "Carbonsäure-Reduktion" in der Studienvorbereitung Organik.
Aus Propansäure kann auf diese Weise Propanal entstehen, der weiter zu Propan-1-ol reduziert werden kann, je nach Reaktionsbedingungen auch in einer Reaktion, die allerdings in mehreren Schritten verläuft.
5.4 Decarboxylierung
Eine typische Reaktion der Carbonsäuren ist die Decarboxylierung, also die Abspaltung der COOH-Gruppe als Kohlendioxid. Zurück bleibt dann ein um ein C-Atom verkürztes Alkan. Aus Propansäure entsteht bei einer solchen Decarboxylierung dann nicht Propan, sondern Ethan.
Siehe dazu "Decarboxylierung" in der Studienvorbereitung Organik.
6. Vorkommen
Propansäure (Propionsäure) kommt natürlich in vielen Pflanzen vor, lt. Wikipedia u.a. in Teeblättern, Anis, Himbeeren, Kakao, Sojabohnen und Tomaten, um nur ein paar Beispiele zu nennen. Auch der Geruch von geröstetem Kaffee soll auf Propansäure zurückzuführen sein.
Auch einige Bakterien sind in der Lage, Propansäure zu bilden. Im Dickdarm des Menschen leben Clostridien, die unverdaute Kohlenhydrate u.a. zu Propansäure abbauen, um daraus Energie zu gewinnen.
Bei der Käseherstellung spielen Propionsäurebakterien eine wichtige Rolle, vor allem bei Käsesorten, die durch die typischen Löcher charakterisiert sind, wie zum Beispiel Emmentaler. Diese Bakterien bilden beim Abbau organischer Substanzen Kohlendioxid und Propansäure.
7. Verwendung
Neben ihrer Verwendung als Ausgangsstoff für chemische Synthesen findet Propansäure vor allem Anwendung als Konservierungsmittel für Lebensmittel und Kosmetika in Form ihrer Salze Natrium-, Kalium- und Calciumpropionat.
Die Ester der Propansäure werden als Riech- und Aromastoffe sowie als Lösungsmittel eingesetzt.
Medizin
In der Medizin wird Propansäure ebenfalls eingesetzt, vor allem als Nahrungsergänzungsmittel in Form von Natrium- und Calciumpropionat.
"Wird Propionsäure in Form von Natriumpropionat oder Calciumpropionat der Nahrung zugeführt, hat dies eine Produktion von PYY und GLP-1 zur Folge, deren Spiegel im Blut ansteigen. Im Laufe eines halben Jahres kommt es bei Übergewichtigen zu einer Gewichtsabnahme, auch im Bauchraum und der Leber, und die Insulinresistenz, die sich in der Kontrollgruppe verschlechtert, bleibt gleich." [5, erwähnt in 2].
Weitere Einzelheiten zur medizinischen Bedeutung siehe den Wikipedia-Artikel zur Propansäure.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia-Artikel "Propionsäure"
- "Propansäure" auf Internetchemie.info
- "Propionsäure" auf Seilnacht.com
- Chambers, Viardot et al.: "Effects of targeted delivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults". Gut. Band 64, Nr. 11, 2015