 |
 |
||
| Brandfördernd | Gas unter Druck |
1. Einführung
Propan C3H8 ist das dritte Glied in der homologen Reihe derAlkane nach Methan und Ethan, gefolgt vom Butan C4H10.
2. Strukturdaten
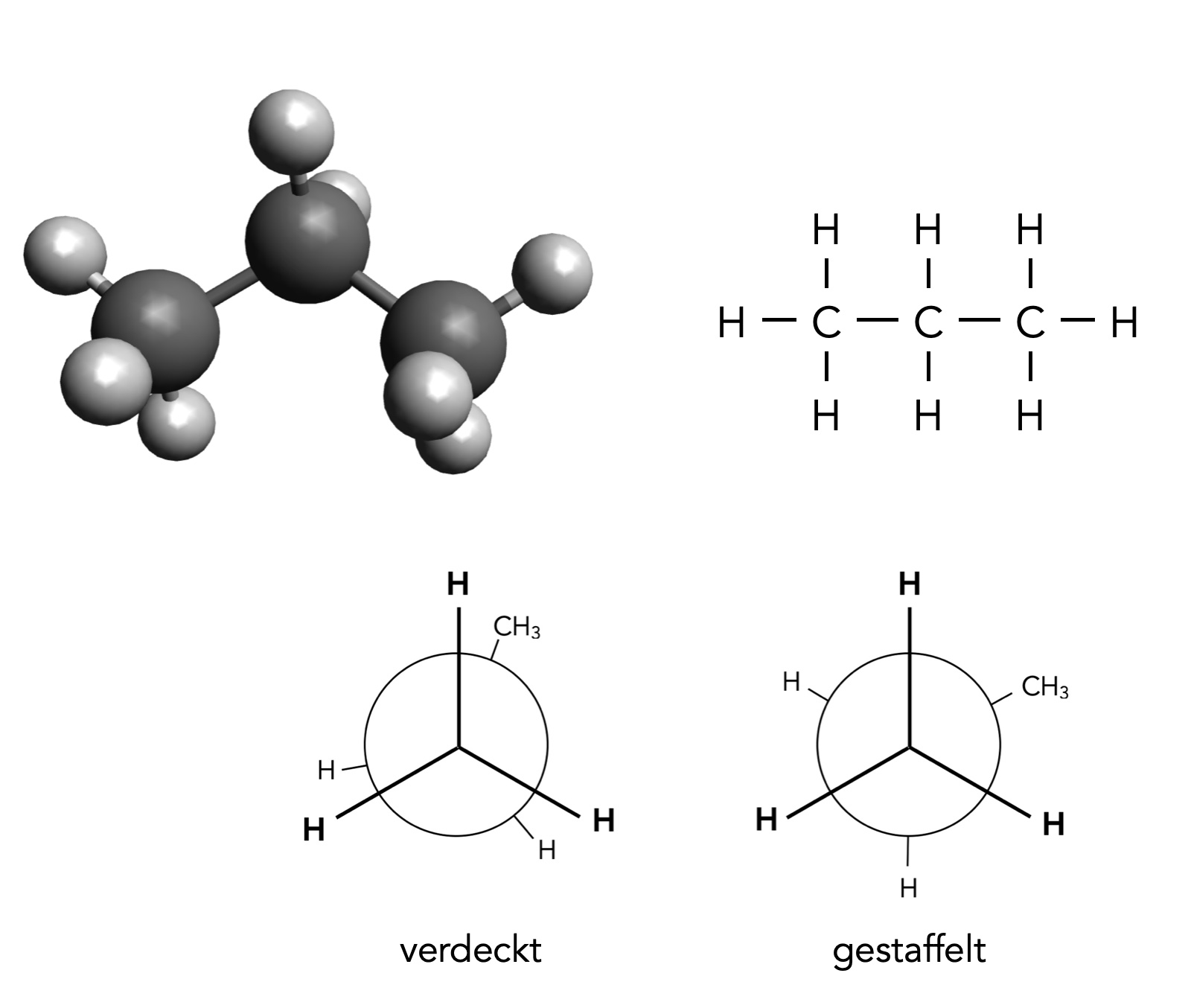
Das Propan-Molekül
Autor: Ulrich Helmich 2024, Lizenz: Public domain
Alle Bindungswinkel im Propan-Molekül betragen 109,5º. Dies entspricht genau dem Tetraederwinkel, der ja für das sp3-hybridisierte C-Atom charakteristisch ist . Die acht C-H-Bindungen sind relativ unpolar, da der EN-Unterschied zwischen Kohlenstoff (2,55) und Wasserstoff (2,20) recht klein ist. Die C-C-Einfachbindungen sind völlig unpolar!
Die Bindungslänge der C-H-Bindungen beträgt 109 pm, während die C-C-Bindung 154 pm lang ist. Das liegt daran, dass bei der C-C-Einfachbindung zwei lange sp3-Hybridorbitale überlappen, während bei der C-H-Bindung das sp3-Hybridorbital des C-Atoms mit dem kleinen s-Orbital des H-Atoms überlappt.
Ähnlich wie bei Ethan gibt es beliebig viele Konformationen des Propan-Moleküls, von besonderem Interesse sind die energetisch günstige gestaffelte Konformation und die energetisch ungünstige verdeckte Konformation. Die Torsionsenergie ist mit ca. 14 kJ/mol geringfügig höher als beim Ethan [4].
3. Physikalische Eigenschaften
3.1 Schmelz- und Siedepunkte
Der Schmelzpunkt von Propan liegt bei -189,7 ºC, der Siedepunkt bei -42 ºC [1]. Wie bei allen Alkanen sind die Werte verhältnismäßig niedrig, da die Moleküle so gut wie keine Dipoleigenschaften besitzen, wegen der geringen Polarität der Bindungen (Dipolmoment nur 0,084 D). Lediglich schwache London-Kräfte halten die Moleküle zusammen.
3.2 Löslichkeitsverhalten
Die Wasserlöslichkeit ist wie bei allen Alkanen schlecht, aber immerhin lösen sich bei 20 ºC in einem Liter Wasser 75 mg Propan [2].
3.3 Weitere Eigenschaften
Propan ist farb- und geruchlos und bei Zimmertemperatur gasförmig. Die Dichte beträgt 0,5812 g/cm3 [2]. Propan ist ein brennbares Gas, das u.a. im Erdgas enthalten ist. Der Flammpunkt liegt bei -104 ºC, der Zündpunkt bei +470 ºC.
4. Gewinnung und Synthese
Propan kommt im Erdgas und in Raffineriegasen vor, kann aber auch gezielt aus anderen Verbindungen hergestellt werden. Das meiste für die Industrie benötigte Propan wird aus diesen beiden Quellen gewonnen. Für die Darstellung von Propan im Labormaßstab kann man die Hydrierung von Propen einsetzen
4.1 Hydrierung von Propen
$C_3H_6 + H_2 \to C_3H_8$
Diese Reaktion benötigt Platin- oder Palladium-Katalysatoren [2].
4.2 Synthese nach Wurtz:
$CH_3I + C_2H_5I + 2 \ Na \to C_3H_8 + 2 \ NaI$
In dem Wikipedia-Artikel finden Sie eine ausführliche Darstellung dieser Reaktion
4.3 Kolbe-Synthese
Laut [5] kann Propan auch durch eine Kolbe-Synthese aus den Salzen der Propansäure und der Ethansäure hergestellt werden. Die Decarboxylierung des Propansäure-Anions liefert dann ein Ethyl-Radikal, und die Decarboxylierung des Ethansäure-Anions ein Methyl-Radikal. Die beiden Radikale können sich dann zu einem Propan-Molekül vereinigen. Inwieweit diese Reaktion in der Laborpraxis tatsächlich angewendet wird, geht aus der Fachliteratur nicht hervor.
5. Reaktionen
5.1 Oxidation, Verbrennungswärme
Wie alle Alkane ist auch Propan leicht oxidierbar, wenn genügend Sauerstoff vorhanden ist, verbrennt Propan zu Wasser und Kohlendioxid [6]:
$C_3H_8 + 5 \ O_{2} \to 3 \ CO_{2} + 4 \ H_{2}O \ \ \ \Delta H = -2222 kJ/mol$
Die Verbrennungswärme ist deutlich höher als beim Ethan (-1561 kJ/mol) oder beim Methan (-891 kJ/mol).
5.2 Dehydrierung
Durch Entzug von Wasserstoff kann Propan zu dem zweiteinfachsten Alken reagieren, nämlich Propen. Allerdings ist dafür eine sehr hohe Temperatur von mehr als 700 ºC nötig. Angewandt wird diese Reaktion u.a. beim thermischen Cracken bei Temperaturen von ca. 1000 ºC.
5.3 Chlorierung
Die Chlorierung von Propan ist eine industriell wichtige Reaktion und liefert wertvolle Ausgangsstoffe für weitere Synthesen.
1-Chlorpropan wird durch thermische Chlorierung von Propan mit Chlorgas bei Temperaturen von 400 - 450 ºC und Drücken von 5-10 bar industriell hergestellt [7]. Dabei entsteht aber auch 2-Chlorpropan.
Auch 1,2-Dichlorpropan, das am meisten eingesetzte Dichlorpropan, wird durch Chlorierung von Propan gewonnen.
Um die Bildung von mehrfach substituierten Chlorethanen zu vermeiden, wird mit einem Propan-Überschuss gearbeitet. Wegen der hohen Temperatur kann auf einen Katalysator verzichtet werden.
5.4 Bromierung
Eine Bromierung von Propan ist zwar möglich, wird aber so gut wie nie eingesetzt. Im Labor gewinnt man 1- und 2-Brompropan eher durch Umsetzung von 1- bzw. 2-Propanol mit Bromwasserstoffsäure [8].
6. Vorkommen und Bedeutung
6.1 Vorkommen
Propan entsteht in der Natur durch die Zersetzung organischer Stoffe innerhalb langer Zeiträume. Im Erdgas beträgt der Propananteil zwischen 1 und 10%. Im Erdöl kommt Propan zwar ebenfalls vor, aber nicht in bedeutenden Mengen. Stattdessen wird Propan als Nebenprodukt bei der Raffination von Rohöl und bei der Verarbeitung von Erdgas gewonnen. Der genaue Anteil von Propan im Rohöl variiert je nach Art des Öls, aber er ist in der Regel relativ gering.
6.2 Bedeutung
Chemische Industrie
Propan ist ein wichtiger Ausgangsstoff für die Herstellung von Propen, dem zweiteinfachsten Alken[10].
Medizin
Propan selbst hat in der Medizin keine Bedeutung, zumindest findet sich im DocCheck Flexikon kein nennenswerter Eintrag. Natürlich gibt es jede Menge Verbindungen, die direkt oder indirekt (also über Zwischenprodukte) aus Propan hergestellt und dann in der Medizin eingesetzt werden, aber Propan selbst wird nicht verwendet.
Technik, Umwelt
In der Technik wird Propan als Kältemittel R-290 in Kühlgeräten und Wärmepumpen eingesetzt, in Ländern wie Australien auch in Auto-Klimaanlagen. Propan ist im Vergleich zu anderen Alkanen relativ umweltfreundlich, das Treibhauspotenzial ist fünfzigmal kleiner als beim Kohlendioxid, auch die Ozonschicht wird durch Propan nicht gefährdet [2].
Alltag
Im Alltag begegnen wir Propan in Form von Flüssiggas, abgefüllt in rote oder graue Propangasflaschen. Propan wird in Gaskochern und Gasgrills verwendet, vor allem bei Outdoor-Aktivitäten wie Camping oder im Garten.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia-Artikel "Propan"
- Propan-Datenblatt von GisChem
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Schirmeister/Schmuck/Wich, Beyer/Walter Organische Chemie, 25. Auflage, Hirzel-Verlag 2015.
- Vorlesungsskript 9 der Uni-München
- Wikipedia, Artikel "1-Chlorpropan"
- Wikipedia, Artikel "2-Chlorpropan"
- Wikipedia, Artikel "2-Brompropan"
- Wikipedia, Artikel "Propen"