Struktur
Der Insulinrezeptor ist ein aus vier Untereinheiten bestehendens Transmembranprotein, also um ein Protein, das beide Schichten der Zellmembran durchzieht. Bei den vier Untereinheiten handelt es sich um zwei alpha- und zwei beta-Untereinheiten, die durch Disulfid-Brücken miteinander verbunden sind. Die α-Untereinheiten bestehen aus je 731 Aminosäuren, die β-Untereinheiten aus jeweils 620 Aminosäuren [1]. Beide Untereinheiten werden von dem gleichen Gen codiert, dem INSR-Gen auf Chromosom Nr. 19, das aus 22 Exons besteht [1].
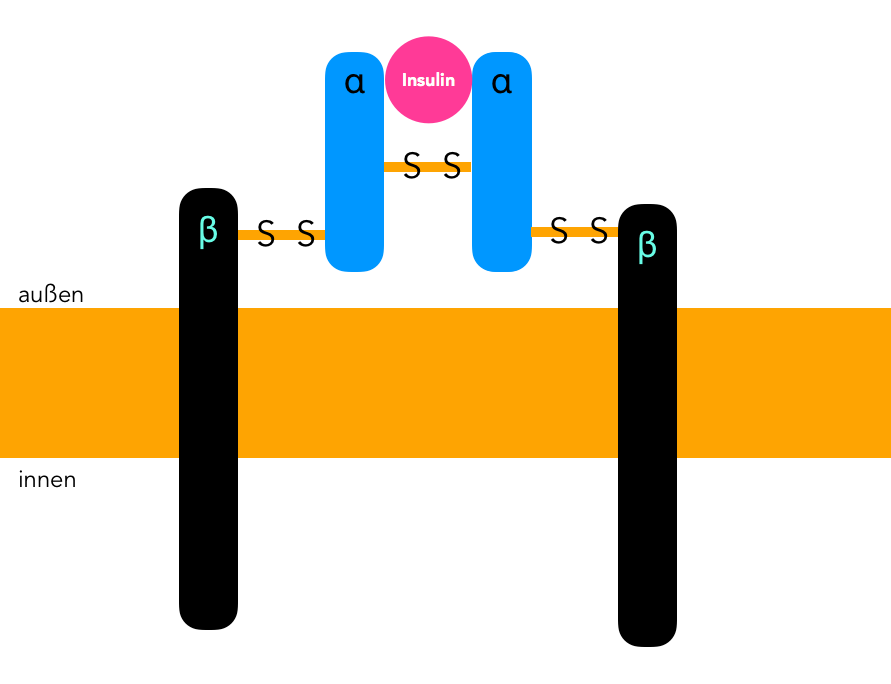
Der Insulinrezeptor, stark vereinfachte schematische Darstellung nach [2]
Funktion: Glucosetransport
Bindet ein Insulin-Molekül an die Außenseite des Rezeptors, ändert sich dessen Konformation (wie es bei Rezeptor-Molekülen eigentlich immer üblich ist). Die beiden β-Untereinheiten nähern sich einander und jetzt passiert etwas Eigenartiges: Die eine β-Untereinheit phosphoryliert die andere β-Untereinheit und umgekehrt. Man spricht hier von einer trans-Autophosphorylierung. "Auto", weil kein weiteres Enzym für die Phosphorylierung notwendig ist, und "trans", weil sie sich die beiden Untereinheiten gegenseitig phosphorylieren.
Nach dieser gegenseitigen Phosphorylierung können verschiedene andere Moleküle an die β-Untereinheiten binden und dadurch aktiviert werden. Für die Insulinwirkung wichtig ist das sogenannte Insulin-Rezeptor-Substrat, auch IRS genannt. Dieses Molekül kann an die aktivierte β-Untereinheit binden und wird dadurch selbst aktiviert. In dieser Form kann es wiederum andere Enzyme aktiv schalten, zum Beispiel die Phosphatidylinositol-3-Kinase (PI3K).
In den Zellen der Skelett- und Herzmuskeln sowie des Fettgewebes für die Aktivierung von PI3K schließlich zur Fusion der mit dem Glucosetransporter GLUT4 besetzten Vesikel mit der Zellmembran.
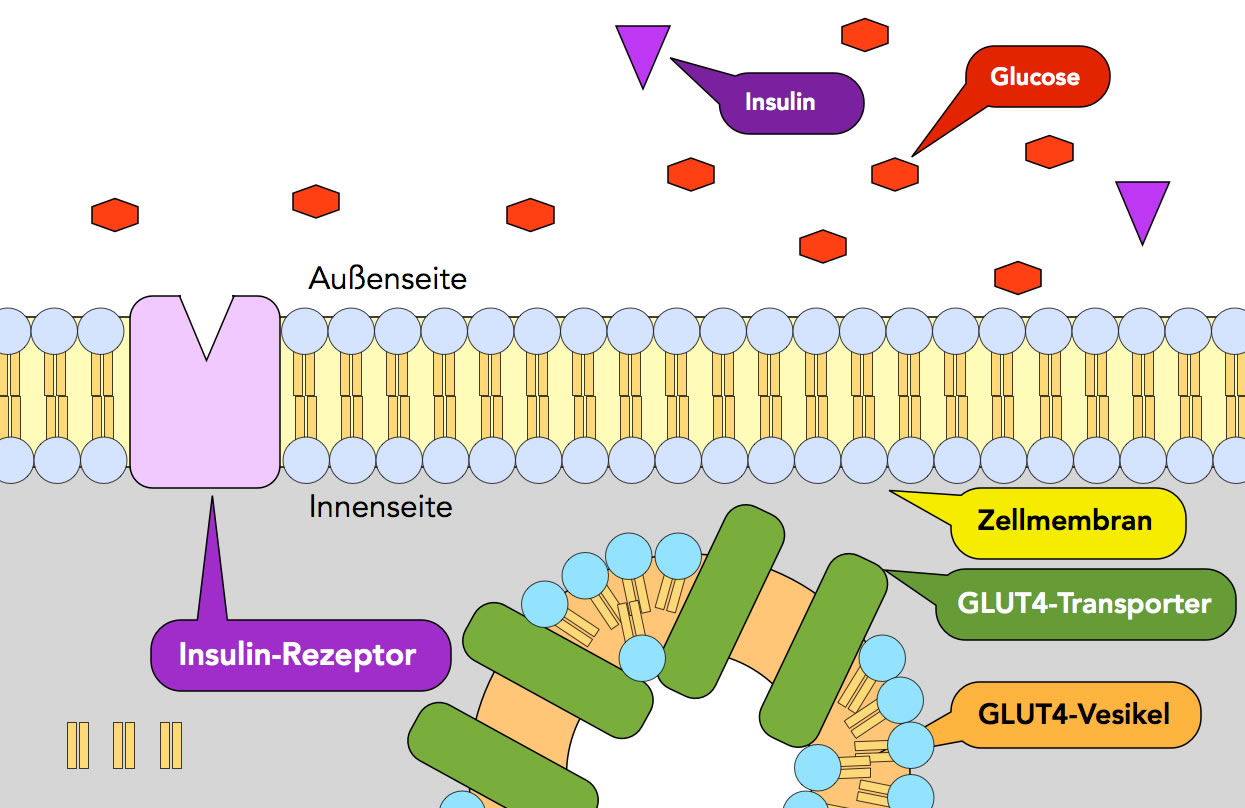
Eine Fett- oder Muskelzelle bei niedriger Insulin-Konzentration im BLut
Auf diesem Bild sieht man den nicht besetzten Insulinrezeptor (schematisiert) in der Membran einer Fett- oder Muskelzelle. Im Zellplasma befinden sich die GLUT4-Vesikel, in deren Membranen die GLUT4-Transporterproteine eingebaut sind. Dockt nun Insulin an den Insulinrezeptor an, wird die oben beschriebene Signalkaskade in Gang gesetzt, was dann zur Verschmelzung der GLUT4-Vesikel mit der Zellmembran führt. Die Glucosetransporter werden in die Zellmembran eingebaut, und Glucose kann in die Zelle diffundieren. Dadurch sinkt der Blutzuckerspiegel, was ja die Hauptaufgabe von Insulin ist.
Funktion: Hemmung anderer Prozesse
Neben der eben beschriebenen Funktion hat der Insulinrezeptor weitere wichtige Funktionen. In Leber- und Fettzellen bewirkt der durch Insulin aktivierte Rezeptor nämlich eine Absenkung der cAMP-Konzentration. Dies geschieht auch wieder über die Phosphatidylinositol-3-Kinase (PI3K), die über ein weiteres Enzym (PKB) die Phosphodiesterase aktiviert, welche cAMP in AMP umwandelt.
Nun ist es so, dass cAMP mehrere Prozesse des Stoffwechsels fördert, vor allem den Abbau von Glycogen und die Gluconeogenese (die Neu-Synthese von Glucose).
Ein hoher Insulinspiegel wird durch einen hohen Glucosespiegel im Blut verursacht. Wenn aber im Blut genug Glucose vorhanden ist, wozu soll dann das Glycogen der Leber abgebaut werden? Auch die Neusynthese weiterer Glucose aus anderen Verbindungen ist dann nicht sinnvoll.
Weiterhin fördert cAMP die Lipolyse, also den Abbau von Fett in den Fettzellen. Auch das ist überflüssig, wenn genügend Glucose im Blut vorhanden ist. Also führt ein hoher Insulinspiegel zur Hemmung dieser Lipolyse.
Schließlich wird die Glycolyse gefördert, wenn der cAMP-Spiegel absinkt. Auch das ist sinnvoll, denn wenn im Blut viel Glucose vorhanden ist, so dass Insulin an die Rezeptoren andockt und Glucose-Transporter in die Membran eingebaut werden, soll die viele Glucose ja schließlich auch verwertet werden. Daher also die Förderung der Glycolyse, die ja nichts anderes tut als Glucose abzubauen.
Quellen:
- DocCheck Flexikon, Artikel "Insulinrezeptor"
- Wikipedia-Artikel "Insulinrezeptor"