Eine Enzymreaktion wird untersucht
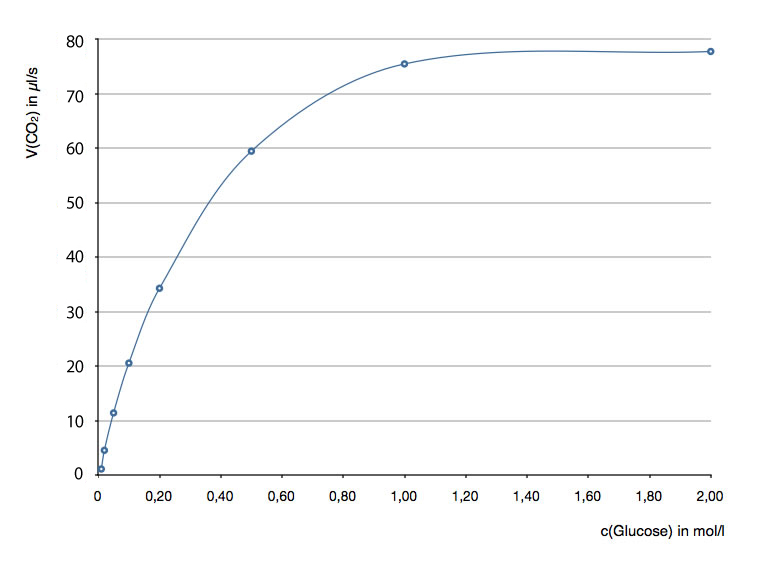
In einem Gedankenversuch werden acht Reagenzgläser mit Glucose-Lösungen unterschiedlicher Konzentration befüllt. Dann geben wir in jedes Reagenzglas je 10 Tropfen einer Lösung, die ein Enzym enthält, das Kohlendioxid aus Glucose freisetzt (Einzelheiten sparen wir uns hier, weil ich mir das Beispiel nur ausgedacht habe). Die folgende Tabelle zeigt nun die (hypothetischen) Versuchsergebnisse:
| c(Glucose) in mol/l | V(CO2) in μl / s |
| 0,01 | 1 |
| 0,02 | 4 |
| 0,05 | 12 |
| 0,1 | 21 |
| 0,2 | 34 |
| 0,5 | 59 |
| 1,0 | 75 |
| 2,0 | 78 |
Hier die graphische Darstellung der Werte (ein μl ist übrigens 1/1000 ml):
Graphische Darstellung der Versuchsergebnisse
Autor: Ulrich Helmich 2016, Lizenz: siehe Seitenende.
Diese Kurve sieht ganz nett aus, entspricht aber eigentlich gar nicht den Erwartungen, die man hat, wenn man im Chemieunterricht der Oberstufe gut aufgepasst hat. Dann sollten wir nämlich wissen, das die Geschwindigkeit vR einer chemischen Reaktion von der Konzentration c(A) der Ausgangsstoffe abhängt.
Reaktionsgeschwindigkeit vR
bei mono- und bimolekularen Reaktionen
Für monomolekulare Reaktionen, bei denen ein Ausgangsstoff A zu einem Produkt P reagiert, gilt die Gleichung
vR = k * c(A)
wobei k die Geschwindigkeitskonstante und c(A) die Konzentration (in mol/l) des Ausgangsstoffs ist.
Bei bimolekularen Reaktionen, bei denen A-Teilchen und B-Teilchen zusammenstoßen müssen, damit P-Teilchen entstehen, gilt die Gleichung
vR = k * c(A) * c(B)
Auch bei der Zersetzung der Glucose sollte die Reaktionsgeschwindigkeit auf jeden Fall von der Glucosekonzentration abhängen, also der linearen Funktion
vR = k * c(Glucose)
gehorchen. Stellt man diese Funktion graphisch dar, erhält man eine Gerade, die durch den Nullpunkt geht und mit der Glucosekonzentration kontinuierlich ansteigt.
Statt dessen sehen wir eine typische Sättigungskurve: Start im Nullpunkt, dann zunächst steiler Anstieg, dessen Steigung aber immer kleiner wird, bis sie schließlich den Wert Null hat. Am Ende verläuft die Kurve parallel zur waagerechten Achse - genau wie in Bild 1.
Erklärung
Ein Enzymmolekül kann pro Sekunde nur eine bestimmte maximale Zahl von Substratmolekülen umsetzen: die Wechselzahl ist begrenzt. Unter der Wechselzahl versteht man die Zahl der Substrat-Moleküle, die ein Enzym-Molekül in einer bestimmten Zeit höchstens verarbeiten kann. Nehmen wir nun einmal an, die Wechselzahl für unser Enzym beträgt 9000 Glucose-Moleküle pro Sekunde.
Angenommen, im ersten Reagenzglas (0,01 mol/l) trifft jedes Enzym-Molekül pro Sekunde im Schnitt auf 100 Glucose-Moleküle. Dies ist weit unter der Kapazität des Enzyms, es werden also alle 100 Substrat-Moleküle problemlos weiterverarbeitet.
Im zweiten Reagenzglas (0,02 mol/l) trifft jedes Enzym-Molekül auf ca. 200 Glucose-Moleküle. Auch dies ist weit unter der Enzymkapazität, daher können auch hier alle Glucose-Moleküle gespalten werden.
Auch bei den nächsten Reagenzgläsern ist dies der Fall: Die Enzyme treffen auf weniger Glucose-Moleküle pro Sekunde, als sie theoretisch verarbeiten könnten. Die Kapazität des Enzyms ist hier noch nicht ausgeschöpft.
Mit steigender Glucosekonzentration wird es aber langsam kritisch. In den letzten Reagenzgläsern ist die Glucosekonzentration schon so hoch, dass ein Enzym-Molekül nicht mehr jedes Glucose-Molekül verarbeiten kann, auf das es trifft. Irgendwann ist die Glucosekonzentration so hoch, dass alle Enzym-Moleküle unter Volllast arbeiten und 9.000 Glucose-Moleküle pro Sekunde umsetzen. Die Kapazitätsgrenze ist erreicht.
Wenn wir die Glucosekonzentration jetzt noch mehr erhöhen, verändert sich gar nichts mehr. Mehr als mit maximaler Kapazität können die Enzyme nicht arbeiten: 9.000 Glucosemoleküle pro Enzym und pro Sekunde.
Veranschaulichung der Enzym-Kinetik
Autor: Ulrich Helmich 2016, Lizenz: siehe Seitenende.
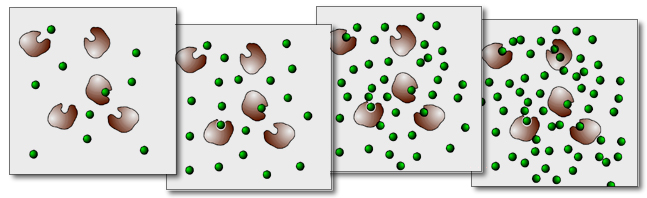
In dieser Abbildung ist das Ganze noch einmal anschaulich dargestellt. Im linken Kasten (niedrige Substratkonzentration) sind die Enzyme nicht ausgelastet. Manche Enzym-Moleküle sind im Augenblick nicht von Substrat-Molekülen besetzt, sie "haben nichts zu tun".
Im zweiten Kasten ist die Substrat-Konzentration zwar höher, aber die Enzyme arbeiten immer noch nicht mit Volllast.
Selbst im dritten Kasten ist - zur Zeit der "Aufnahme" - noch ein Enzym-Molekül nicht besetzt.
Im vierten Kasten schließlich ist die Substratkonzentration so hoch, dass die Enzyme voll ausgelastet sind, sie kommen mit ihrer Arbeit nicht mehr nach, nicht mehr alle Substrat-Moleküle können sofort umgesetzt werden. Eine weitere Erhöhung der Substratkonzentration würde jetzt keine Steigerung der Umsetzungsrate mehr nach sich ziehen.
Enzymaktivität
Die Enzymaktivität hängt von der Konzentration der Substrate ab: Je höher c(S), desto größer die Enzymaktivität, also die Geschwindigkeit, mit der das Enzym die Substrat-Moleküle umsetzt.
Allerdings ist diese Abhängigkeit nicht linear, sondern liegt in Form einer Sättigungskurve vor.
Ursache hierfür ist die begrenzte Kapazität eines Enzyms. Ein Enzym-Molekül kann pro Zeiteinheit nur eine bestimmte Anzahl von Substrat-Molekülen verarbeiten (Wechselzahl). Ist die Substratkonzentration zu hoch, sind die Enzyme voll ausgelastet. Eine weitere Steigerung der Substratkonzentration hat keine Steigerung der Enzymaktivität zur Folge; der Sättigungswert ist erreicht und kann nicht überschritten werden.
Michaelis-Menten-Kinetik
Eine typische Enzym-Kinetik
Autor: Ulrich Helmich 2016, Lizenz: siehe Seitenende.
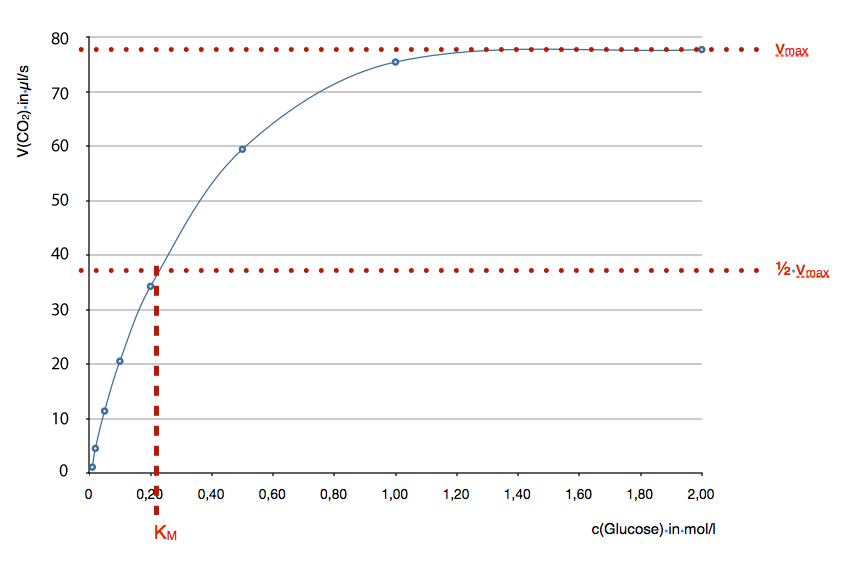
Hier sehen wir noch einmal die gleiche Enzym-Kinetik wie in der Abbildung 1. Diese Abbildung soll zeigen, wie man die sogenannte Michaelis-Konstante KM graphisch ermittelt. KM ist ein quantitatives Maß für die Enzymaktivität.
Das Problem bei einer Sättigungskurve ist, dass man die Konzentration c(Glucose)max, bei der der Sättigungswert erreicht ist, nie genau ermitteln kann, auch wenn man die Kurve äußerst sorgfältig gezeichnet hat. Ist der Sättigungswert in der Abbildung schon bei c(Glucose) = 1,40 mol/l erreicht oder erst bei 1,60 mol/l ? Vielleicht bei 1,50 mol/l?
Daher verfährt man bei der Bestimmung der Enzymaktivität etwas anders. Die maximale Geschwindigkeit vmax mit der das Enzym arbeitet, kann man recht leicht mit einem Lineal graphisch ermitteln, sie liegt bei 78 µl CO2/s (oberer rote Linie).
Nun halbiert man einfach diesen Wert und kommt auf 1/2 vmax = 39 µl CO2/s. An dieser Stelle zeichnet man eine zweite waagerechte Linie in das Diagramm ein. Diese Linie schneidet nun die Kurve, welche die Enzymkinetik darstellt. Mit einem Lineal kann man nun eine Senkrechte einzeichnen, welche die x-Achse schneidet. Und dann haben wir schon die Michaelis-Konstante KM mit 0,21 mol Glucose/l ermittelt.
Die Michaelis-Konstante KM, ist die Substratkonzentration, bei der das Enzym mit genau der halben maximalen Geschwindigkeit arbeitet. Hier bildet die Hälfte aller Enzym-Moleküle einen Enzym-Substrat-Komplex.
"Die Michaelis-Konstante steht für die Affinität des Enzyms zu seinem Substrat, je kleiner sie ist, desto höher ist die Affinität" [1].
Wie ist diese Aussage zu verstehen?
Im Laufe der Evolution haben sich die meisten Enzyme der durchschnittlich zur Verfügung stehenden Substratkonzentration angepasst. Zumindest passen die meisten KM-Werte zu der durchschnittlichen Substratkonzentration, der die Enzyme normalerweise ausgesetzt sind. Das hat den Vorteil, dass das Enzym sein Substrat rasch umsetzen kann. Auch eine leichte Erhöhung der Substratkonzentration kann das Enzym "verkraften", weil ja noch Kapazitäten frei sind. Wenn die normale Substratkonzentration dem KM-Wert entspricht, ist ja nur die Hälfte aller Enzym-Moleküle mit Substraten besetzt, die andere Hälfte "hat nichts zu tun" und kann auf Erhöhungen der Substratkonzentration reagieren.
Daher unterscheiden sich die KM-Werte verschiedener Enzyme sehr stark. Chymotrypsin hat einen KM-Wert von 5000 µmol, Carboanhydrase einen KM-Wert von 8000 µmol. Die Penicillinase hat einen geringen KM-Wert von 50, und die Arginin-tRNA-Synthetase setzt das Substrat Arginin mit einem KM-Wert von 3 um [3].
Arginin-tRNA-Synthetase ist ein Enzym, das bei der Translation eine wichtige Rolle spielt. Es belädt unter Verbrauch von ATP die transfer-RNA für Arginin, also ArgtRNA, mit der Aminosäure Arginin. Das Enzym setzt also drei Substrate um: Arginin, ArgtRNA und ATP. Man sollte nun ja denken, dass die KM-Werte für diese drei Substrate gleich groß sind. Das ist aber nicht der Fall. Der KM-Wert für Arginin liegt bei 3, der für ArgtRNA bei 0,4 und der für ATP bei 400 µmol [3].
Dieses Beispiel zeigt eindrucksvoll, dass ein- und dasselbe Enzym unterschiedliche KM-Werte für verschiedene Substrate besitzen kann.
Aufgabe:
Zwei Enzyme dienen in der Leber zum Abbau der Glucose, nämlich Hexokinase und Glucokinase. Nun hat die Glucokinase aber einen 50 mal höheren KM-Wert als die Hexokinase.
Begründen Sie, welches Enzym hauptsächlich die Glucose abbaut, wenn die Glucose-Konzentration in der Leber sehr niedrig / sehr hoch ist.
Lösungsvorschlag:
Der KM-Wert der Hexokinase wird bereits bei sehr geringen Glucose-Konzentrationen erreicht. Die Hexokinase arbeitet also schon mit "halber Kraft", während die Glucokinase noch lange nicht ausgelastet ist. Sie würde erst bei einer 50fach höheren Glucose-Konzentration mit "halber Kraft" arbeiten. Bei niedrigen Glucose-Konzentrationen wird die Glucose also hauptsächlich durch die Hexokinase abgebaut. Bei einer hohen Glucose-Konzentration ist die Hexokinase dagegen völlig ausgelastet, und nun springt die Glucokinase ein, die mit wesentlich höheren Glucose-Konzentrationen zurecht kommt.
Isoenzyme
Bei ständig wechselnden Substratkonzentrationen werden auch sogenannte Isoenzyme eingesetzt. Das sind Enzyme, die zwar unterschiedlich gebaut sind, aber trotzdem das gleiche Substrat umsetzen und die gleiche Reaktion katalysieren. Die eine Variante hat dann einen niedrigen KM-Wert und eignet sich daher gut für geringe Substratkonzentrationen, während die Iso-Variante einen höheren KM-Wert hat und somit besser für hohe Konzentrationen des Substrats geeignet ist. Oft haben die Isoenzyme eine fast identische Struktur. Genetisch kann man das leicht mit der Gen-Duplikation erklären. Das Gen für das ursprüngliche Enzyme wurde durch eine Chromosomenmutation dupliziert. Das Duplikat hat sich dann im Laufe der Evolution leicht verändert, so dass das resultierende Enzym eine etwas andere Aminosäuresequenz hat, was eine andere Struktur des aktiven Zentrums zur Folge hat.
Isoenzyme findet man auch in unterschiedlichen Zelltypen. Die Lactatdehydrogenasen vom Skelettmuskel und vom Herzmuskel sind Isoenzyme. Allerdings unterscheiden sich die beiden Isoformen nicht im KM-Wert, sondern in der Art und Weise, wie sie reguliert werden können. Die Herzmuskel-Isoform wird durch andere Stoffe gehemmt als die Skelettmuskel-Isoform.
Quellen:
- Kompaktlexikon der Biologie, Spektrum-Verlag
- Nelson, Cox: LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
Seitenanfang -
weiter mit der Beeinflussung der Enzymaktivität durch pH-Wert und Temperatur...