Enzyme als Biokatalysatoren
Die Katalysatoren, die in lebenden Zellen vorkommen, sind in der Regel Enzyme, die aus Aminosäuren zusammengesetzt sind und damit zur Stoffklasse der Proteine gehören. Einige wenige Enzyme bestehen aus RNA-Molekülen und werden als Ribozyme bezeichnet. Auf diesen Seiten besprechen wir aber nur die Protein-Enzyme.
Wenn Sie meinen, dass Sie nicht genug über Proteine (Eiweiße) wissen, gehen Sie bitte auf die sehr ausführlichen Proteinseiten meiner Homepage.
Protein-Enzyme sind in der Regel globuläre Proteine, haben also ein mehr oder weniger kugelförmiges Aussehen. Die molare Masse von Enzymen liegt zwischen 12.000 und mehr als 1.000.000 Dalton.
Aufgabe:
Aus wie vielen Aminosäuren besteht ein Enzym mit einer molaren Masse von 1.000.000 Dalton schätzungsweise?
Lösungsvorschlag:
Nehmen wir mal eine durchschnittliche Aminosäure, vielleicht Valin. Die molare Masse von Valin beträgt ca. 117 g/mol. Wenn wir 1.000.000 durch diesen Wert dividieren, erhalten wir 8.547. Ein solches "Riesen-Enzym" besteht also aus über 8.500 Aminosäuren.
Viele Enzyme sind reine Proteine, bestehen also ausschließlich aus einer Kette von Aminosäuren.
Andere Enzyme benötigen einen sogenannten Cofaktor. Das ist entweder ein anorganisches Ion wie Eisen Fe2+ oder Magnesium Mg2+, oder ein komplexes organisches Molekül, das dann als Coenzym bezeichnet wird.
Coenzyme transportieren bestimmte Atomgruppen und bringen sie zu dem Enzym.
Bekannte Beispiele für solche Transport-Coenzyme sind ATP für den Transport von Phosphatgruppen, NADH2 für den Transport von Wasserstoff oder Acetyl-Coenzym A für den Transport von Essigsäure-Einheiten.
Schauen wir uns doch ein solches Enzym einfach mal an:
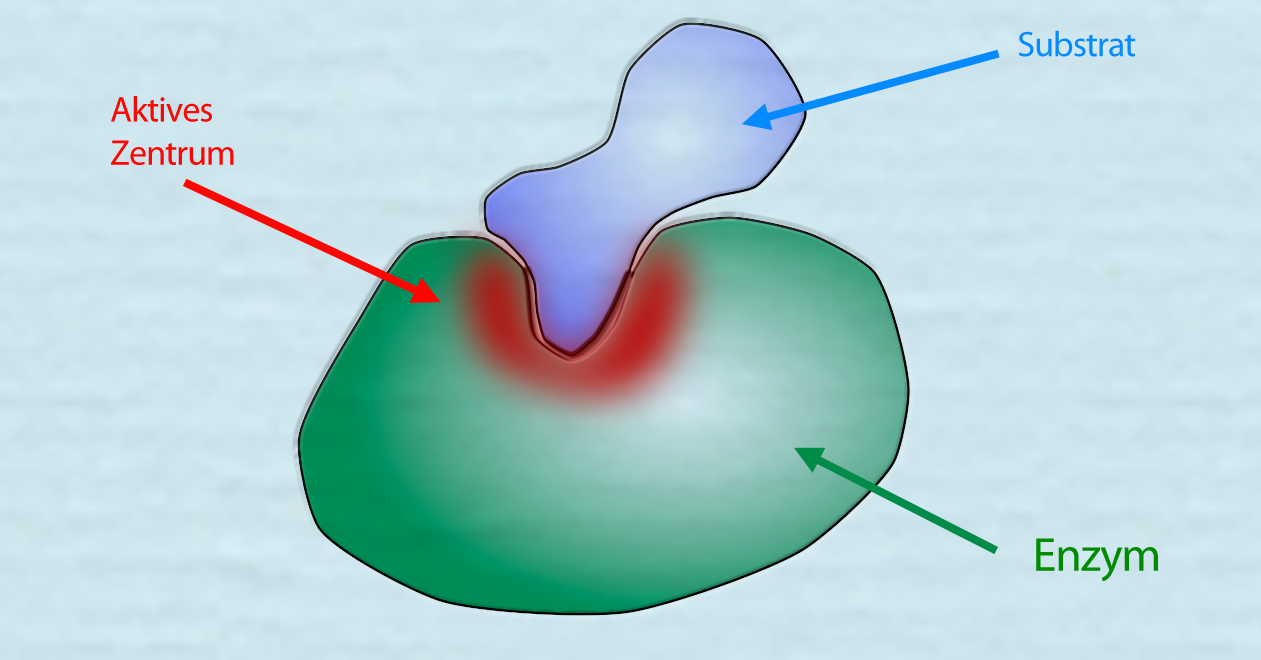
Ein Enzym mit einem Substrat
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
In diesem Bild sehen wir ein Enzym. Das Enzym hat eine taschenförmige Ausbuchtung, das sogenannte aktive Zentrum. In dieses aktive Zentrum passt ein bestimmtes Teilchen genau hinein, das sogenannte Substrat des Enzyms. Teilchen, die anderes geformt sind als das Substrat des Enzyms passen nicht in das aktive Zentrum hinein, sie können von dem Enzym daher nicht umgesetzt werden.
Schlüssel-Schloss- und Induced-Fit-Prinzip
Man spricht hier auch von dem Schlüssel-Schloss-Prinzip: das Substrat passt in das aktive Zentrum des Enzyms wie ein Schlüssel ins Schloss.
Einige Enzyme arbeiten allerdings nicht nach diesem Schlüssel-Schloss-Prinzip, sondern nach dem Induced-Fit-Prinzip: Das Substrat passt (noch) nicht in das aktive Zentrum, wird aber dennoch schon mal von ihm aufgenommen. Anschließend verändert sich die Struktur des aktiven Zentrums so, dass das Substrat genau hineinpasst. Das aktive Zentrum passt sich also an das Substrat an.
Substratspezifität
Egal, welches der beiden Prinzipien bei einem Enzym wirkt, das Schlüssel-Schloss-Prinzip oder das flexiblere Induced-Fit-Prinzip, man spricht hier allgemein von einer Substratspezifität. Enzyme sind substratspezifisch, das heißt, jedes Enzym kann nur eine bestimmte Verbindung umsetzen, die dann als Substrat des Enzyms bezeichnet wird. Das Enzym Glucose-6-Isomerase beispielsweise kann nur die Verbindung Glucose-6-Phosphat verarbeiten, aber keine andere Verbindung. Glucose-6-Phosphat ist also das Substrat dieses Enzyms.
Wirkungsspezifität
Enzyme sind aber nicht nur substratspezifisch, sondern auch gleichzeitig reaktionsspezifisch oder wirkungsspezifisch. Glucose ist eine Verbindung, die in vielen verschiedenen Stoffwechselprozessen eine Rolle spielt und daher auch von vielen verschiedenen Enzymen als Substrat akzeptiert wird. Jedes dieser Enzyme katalysiert aber eine andere Reaktion der Glucose: manche Enzyme hängen eine Phosphatgruppe an das Glucosemolekül an, andere Enzyme schneiden vielleicht eine OH-Gruppe ab, wieder andere können vielleicht zwei Glucose-Moleküle zusammenbauen etc.
Diese beiden wichtigen Spezifitäten, Substratspezifität und Wirkungsspezifität, werden auf der nächsten Seite noch näher erklärt.
Seitenanfang -
Weiter mit Substrat- und Wirkungsspezifität der Enzyme...