Temperaturabhängigkeit
Zur Veranschaulichung der folgenden Betrachtungen führen wir mal einen Gedankenversuch durch. Wir stellen uns ein Enzym vor, das in der Lage ist, ein CO2-Molekül aus einem organischen Molekül abzuspalten.
Ein solches Enzym finden wir beispielsweise im Citratzyklus, bei der Reaktion von Oxalsuccinat bzw.Oxalbernsteinsäure zum α-Ketoglutarat:
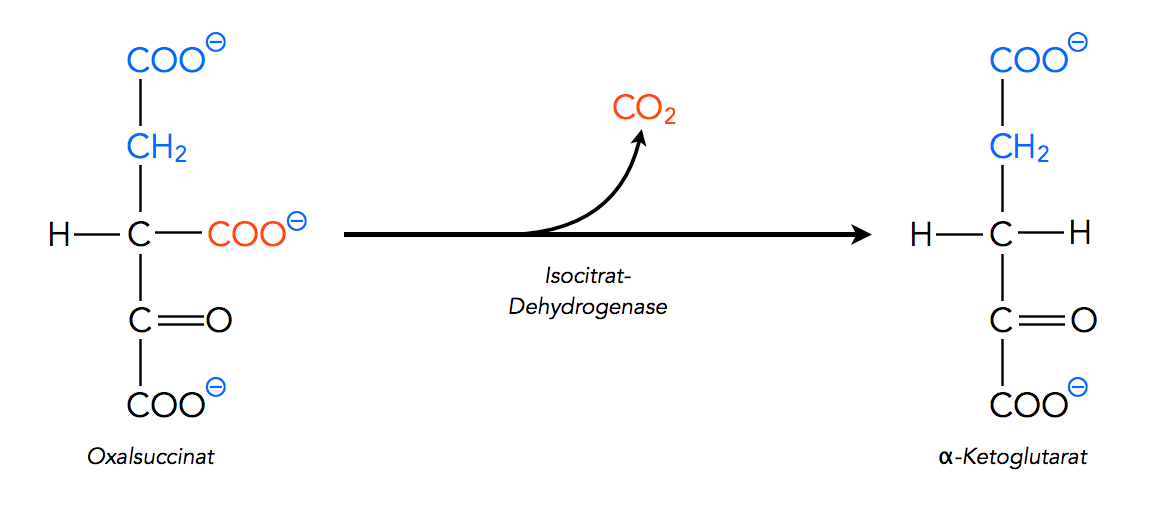
Schritt 4 des Citratzyklus: Oxalsuccinat → α-Ketoglutarat
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Das verantwortliche Enzym ist die Isocitrat-Dehydrogenase.
Gedankenversuch
Durchführung:
Eine Lösung von Oxalbernsteinsäure der Konzentration 0,1 mol/l wird auf zehn Reagenzgläser verteilt. Mithilfe von Wasserbädern werden die Reagenzgläser auf verschiedene Temperaturen gebracht, angefangen bei 0 ºC bis hin zu 45 ºC.
Gut, dass dieser Versuch nur ein Gedanken-Experiment ist. Wo sollen wir sonst so schnell zehn Wasserbäder herbekommen? In den meisten Versuchsanleitungen für solche Schul-Experimente findet man nur drei oder maximal vier unterschiedliche Temperatur-Vorgaben, zum Beispiel 5 ºC, 25 ºC, 35 ºC und 50 ºC.
Dann stellen wir eine wässrige Lösung des Enzyms her und geben von dieser Lösung genau 10 Tropfen in jedes Reagenzglas. Wir haben jetzt also 10 Reagenzgläser mit gleichen Konzentrationen von Oxalbernsteinsäure, aber jeweils unterschiedlicher Temperatur.
Wir messen nun das Kohlendioxid, das in einer bestimmten Zeit von jedem Reagenzglas freigesetzt wird.
Da es sich nur um einen Gedankenversuch handelt, müssen wir uns nicht weiter überlegen, wie das praktisch geht. Bei solchen Schulversuchen, wenn sie dann tatsächlich durchgeführt werden, setzt man unterschiedliche Methoden ein, zum Beispiel die Bläschenzählmethode, man fängt das Gas mit einem winzigen Kolbenprober oder einem mit Wasser gefüllten Reagenzglas auf, oder man misst die Veränderung des pH-Wertes oder der elektrischen Leitfähigkeit und und und...
Erwartungen:
Aus der physikalischen Chemie ist bekannt, dass die Geschwindigkeit einer chemischen Reaktion mit der Temperatur steigt. Nach der RGT-Regel führt eine Temperaturerhöhung von 10 ºC zu einer Verdopplung oder Verdreifachung der Reaktionsgeschwindigkeit. Am meisten Kohlendioxid müsste demnach in dem Reagenzglas mit der höchsten Temperatur entstehen.
Beobachtungen:
Diese rein physikalisch begründeten Erwartungen werden nicht erfüllt. In der folgenden Tabelle sind die Messwerte eines solchen (hypothetischen) Versuchs dargestellt:
| T in ºC | V(CO2) / min |
| 0 | 0 |
| 5 | 3 |
| 10 | 7 |
| 15 | 12 |
| 20 | 18 |
| 25 | 24 |
| 30 | 25 |
| 35 | 22 |
| 40 | 10 |
| 45 | 0 |
Hier die graphische Darstellung:
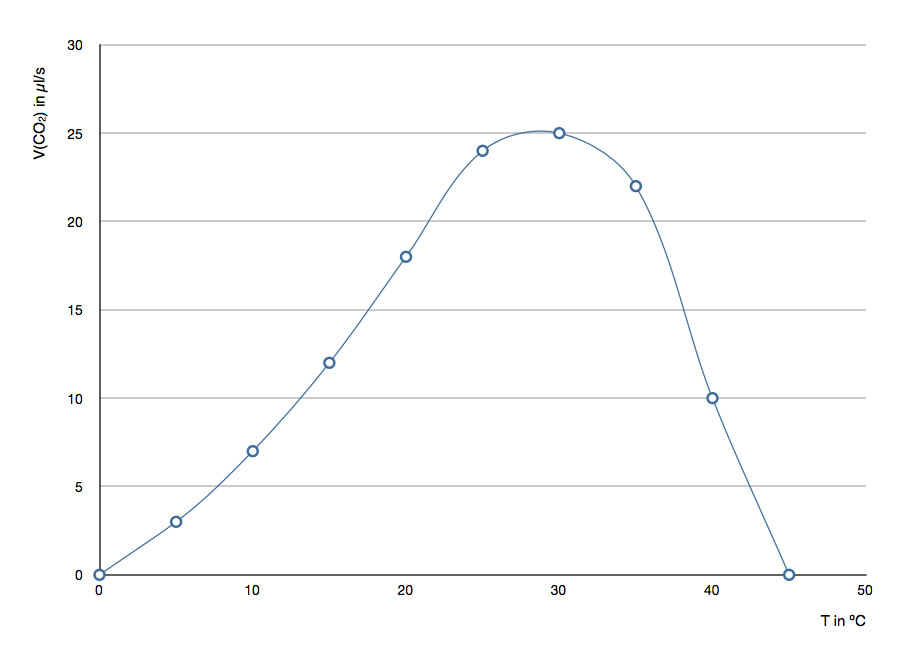
Temperaturabhängigkeit der Enzymaktivität in Form einer Optimumskurve
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Wieso erkennt man auf der Graphik eine deutliche Optimumskurve und keine kontinuierliche Steigerung der Enzymaktivität, wie es die RGT-Regel nahe legen würde?
Auf dieser Seite finden Sie die Beschreibung eines "echten" Experiments, mit dem man die Temperaturabhängigkeit des Harnstoff abbauenden Enzyms Urease untersuchen kann.
Erklärung
Der RGT-Regel sind in lebenden Zellen zwei deutliche Grenzen gesetzt. Unterhalb von 0 ºC bilden sich Eiskristalle in der Zelle, dadurch werden wichtige Strukturen zerstört und die Zelle stirbt.
Natürlich gibt es einige Lebewesen, die sich im Laufe der Evolution an niedrige Temperaturen angepasst haben und zum Beispiel die Bildung von Eiskristallen mithilfe chemischer Substanzen unterbinden können ("Frostschutzmittel"), das ist aber die Ausnahme.
Oberhalb von 40 bis 50 ºC denaturieren die meisten Proteine, so dass sie nicht mehr arbeiten können.
Auch hier gibt es wieder viele Lebewesen, die sich im Laufe der Evolution an hohe Temperaturen angepasst haben, ihre Enzyme sind auch bei 60 oder 70 ºC noch voll arbeitsfähig, aber auch das ist die Ausnahme, über die wir hier nicht reden müssen.
Normale Enzyme haben daher einen Temperaturbereich, in dem sie mit maximaler Geschwindigkeit arbeiten, und dieser Temperaturbereich liegt bei "normalen" physiologischen Temperaturen um 20 bis 35 ºC. Dort hat die Enzymaktivitäts-Temperatur-Kurve ihr mathematisches Maximum; in der Biologie spricht man hier allerdings von einem Optimum.
➥Beeinflussung der Tertiärstruktur
Auf diesen Seiten finden Sie viele weitere Informationen zu diesem Thema.
Merke:
Enzyme sind temperaturabhängig. Bei zu niedrigen Temperaturen friert die Zelle ein, bei zu hohen Temperaturen denaturieren die Proteine. Daher hat jedes Enzym einen Temperaturbereich, in dem es optimal - also mit maximaler Geschwindigkeit - arbeitet.
Auf dieser Karteikarte (PDF) habe ich noch einmal alles Wichtige zusammengefasst. Sie können sich die Karte auf eine "echte" A5-Karteikarte ausdrucken oder einfach auf ihrem Tablett als PDF-Datei anschauen.
pH-Abhängigkeit
Einen ähnlichen Versuch kann man jetzt durchführen, um die Abhängigkeit der Enzymaktivität vom pH-Wert zu ermitteln. Dazu gibt man die gleiche Konzentration Glucose in Reagenzgläser mit verschiedenen pH-Werten zwischen 3 und 12. Auch hier kann man bei der Auswertung und Darstellung der Messergebnisse eine Optimumskurve beobachten.
Merke:
Enzyme sind pH-abhängig. Bei zu niedrigen oder zu hohen pH-Werten arbeiten Enzyme nicht mehr optimal, weil sie denaturiert sind. Jedes Enzym hat einen pH-Wert, an dem es optimal arbeitet, das pH-Optimum.
Erklärung
Warum diese pH-Abhängigkeit besteht, ist ebenfalls auf den oben genannten Seiten "Beeinflussung der Tertiärstruktur" und "Denaturierung" nachzulesen.
Zum Thema "Abhängigkeit der Enzymaktivität vom pH-Wert" habe ich zwei Karteikarten geschrieben, die Sie sich hier gerne herunterladen können:
Diese Präsentation habe ich ursprünglich für meinen eigenen Unterricht im Fach Ernährungslehre geschrieben. Sie können diese Präsentation aber ohne Probleme auch in den Fächern Biologie und Chemie einsetzen.
Die Karteikarten und die Präsentation können Sie sich hier kostenlos herunterladen. Aber ich würde mich natürlich freuen, wenn Sie mir als Gegenleistung eine kleine Spende über PayPal zukommen lassen würden (siehe PayPal-Button rechts oben oder ganz unten auf dieser Seite).
Seitenanfang -
weiter mit Regulation der Enzymaktivität...