Vorkommen
Die Carbonyl-Gruppe -C=O kommt in den funktionellen Gruppen der Aldehyde, Ketone und Carbonsäuren vor, außerdem in vielen anderen organischen Verbindungen, zum Beispiel den Estern, den Carbonsäure-Chloriden oder den Carbonsäure-Amiden. Die Carbonyl-Gruppe ist laut [2] "eindeutig die wichtigste funktionelle Gruppe der Organischen Chemie".
Bei den Aldehyden ist die C=O-Gruppe stets mit einem H-Atom verbunden und mit einem Alkylrest, so wie die folgende Abbildung zeigt:
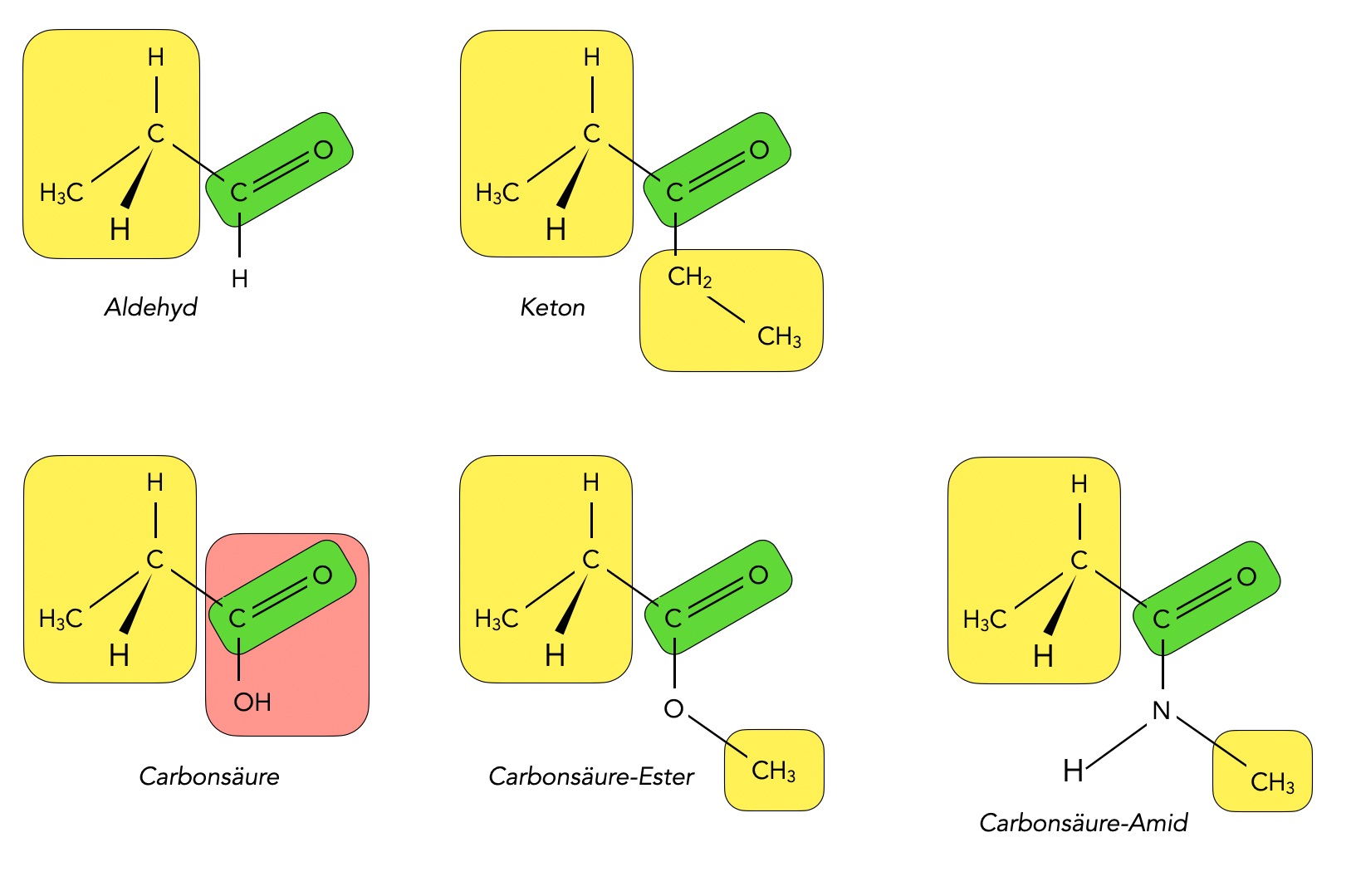
Verschiedene Verbindungen mit Carbonyl-Gruppe n
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Bei denKetonendagegen ist die C=O-Gruppe mit zwei Alkylresten verbunden, und bei den Carbonsäuren ist die C=O-Gruppe Bestandteil der Carboxygruppe -COOH.
Eine weitere Klasse von organischen Verbindungen mit einer Carbonyl-Gruppe sind die Ester, also Verbindungen aus einer Carbonsäure und einem Alkohol. Hier ist das H-Atom der COOH-Gruppe durch des Alkylgruppe des Alkohols ersetzt worden.
Schließlich sollen noch die Carbonsäure-Amide genannt werden, weil sie für die Chemie der Peptide und Proteine besonders wichtig sind. Alle Peptide und Proteine enthalten nämlich eine Peptidbindung, die aus einer Carbonyl-Gruppe besteht, die mit einem N-Atom verbunden ist (also wie ein Ester aufgebaut, aber statt dem O-Atom finden wir hier ein N-Atom).
Bau der Carbonyl-Gruppe
Die Carbonyl-Gruppe ist recht einfach aufgebaut: Das Kohlenstoff-Atom ist über eine Doppelbindung mit dem Sauerstoff-Atom verbunden. Die beiden anderen Bindungen des C-Atoms sind dann mit H-Atomen oder mit organischen Resten verknüpft.
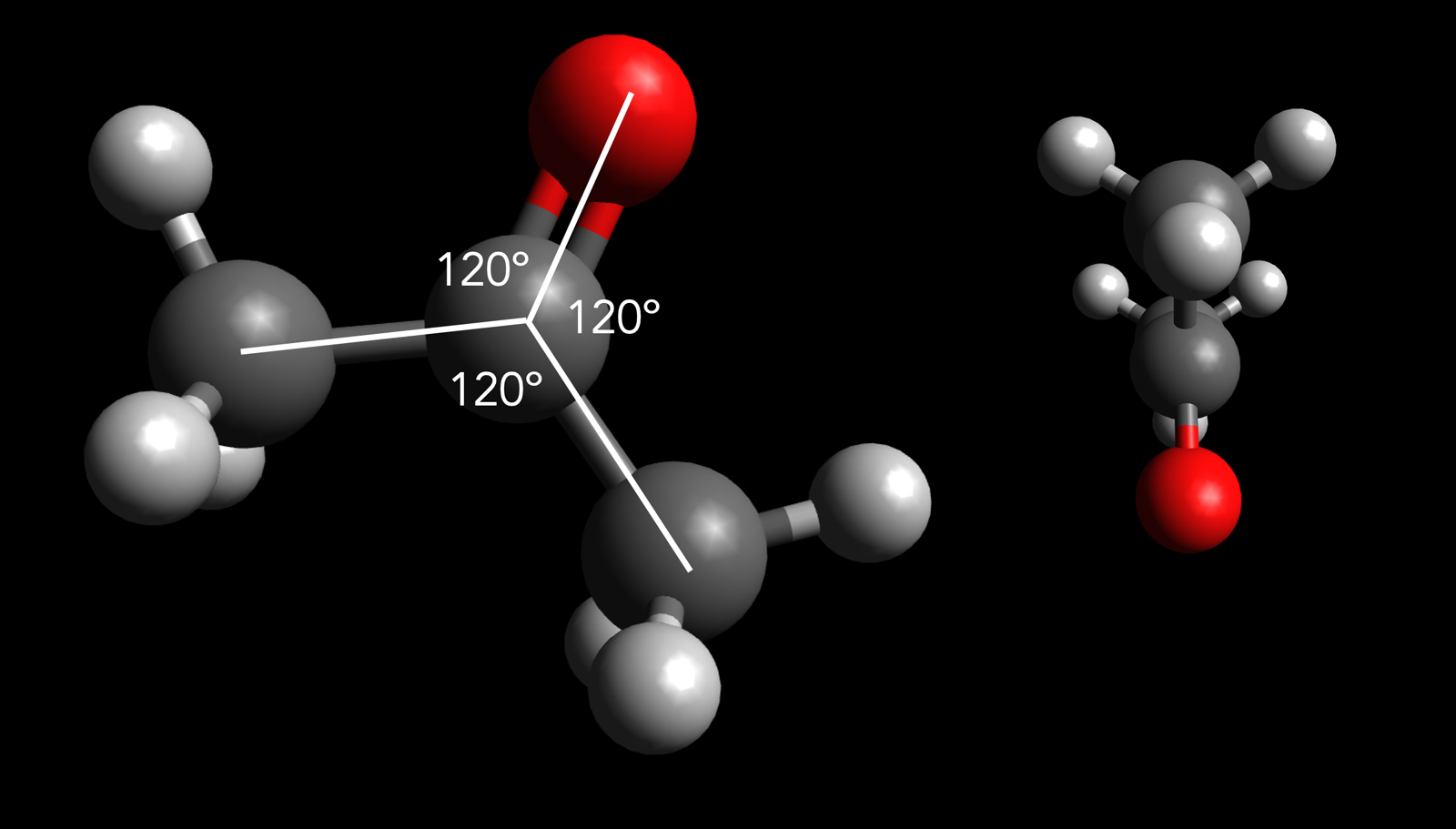
Bindungswinkel bei der Carbonyl-Gruppe
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Die Abbildung oben zeigt das Aceton-Molekül, links in der Aufsicht, rechts in einer Seitenansicht. Aceton ist das einfachste Keton. Die Carbonyl-Gruppe ist beim Aceton mit zwei Methyl-Gruppen verbunden. Alle drei C-Atome und das O-Atom liegen in einer Ebene, wie man in der Seitenansicht gut sehen kann. Man sagt daher, dass die Carbonyl-Gruppe und die beiden angrenzenden Atome planar aufgebaut sind. "Planar" heißt so viel wie "liegen in einer Ebene".
Merkhilfe: "planar" hört sich so ähnlich an wie das Wort "platt".
Was man auf dem Bild auch gut sehen kann, sind die Bindungswinkel von 120º, die zwischen der Carbonyl-Gruppe und den beiden angrenzenden Atomen bestehen.
Wer das alles noch genauer wissen möchte, vielleicht weil er oder sie gerade mit dem Chemie-Studium begonnen hat, kann sich das auf der entsprechenden Lexikon-Seite auf dieser Homepage durchlesen.
Auch auf die Eigenschaften der Carbonyl-Gruppe wird dort noch näher eingegangen als hier.
Eigenschaften der Carbonyl-Gruppe
Aufgrund der polaren C=O-Bindung verhält sich die Carbonyl-Gruppe wie ein Dipol, was sich dann auf das ganze Molekül auswirken kann.
Die Carbonyl-Gruppe kann leicht von elektrophilen und nucleophilen Teilchen angegriffen werden. Nucleophile Teilchen, sogenannte Nucleophile wie CN- oder Br- lagern sich gern an das positiv polarisierte C-Atom an (EN = 2,5), während sich elektrophile Teilchen, sogenannte Elektrophile wie zum Beispiel H+ gern an das negativ polarisierte O-Atom (EN = 3,5) der Carbonyl-Gruppe anlagern.
Eine charakteristische Reaktion der Aldehyde und Ketone ist daher die nucleophile Addition, bei der zunächst das C-Atom von einem Nucleophil angegriffen wird und dann das O-Atom von einem Elektrophil.
In der Abteilung "Mechanismen" wird die nucleophile Addition AN auf mehreren Seiten näher beschrieben.
Physikalische Eigenschaften der Aldehyde
Das O-Atom der Aldehyd-Gruppe ist negativ polarisiert und besitzt zudem zwei freie Elektronenpaare, es ist daher in der Lage, als Wasserstoffbrücken-Akzeptor zu wirken und so H-Brücken mit anderen Molekülen zu bilden, zum Beispiel mit Wasser- oder Alkohol-Molekülen. Daher sind die niedermolekularen Aldehyde wie Methanal oder Ethanal gut wasserlöslich; bei den höheren Aldehyden überwiegt dann der unpolare Einfluss der Alkyl-Gruppe.
Untereinander können Aldehyde jedoch keine H-Brücken bilden. Das H-Atom der Aldehydgruppe -CHO ist nicht an ein elektronegatives Atom gebunden (N oder O), sondern sitzt an einem C-Atom. Dieses H-Atom ist also kein H-Brücken-Donator. Daher kann es keine H-Brücken mit den O-Atomen eines anderen Aldehyd-Moleküls bilden. Die anderen H-Atome eines Aldehyds sind mit C-Atomen verbunden und können somit erst recht keine H-Brücken bilden.
Wohl aber sind Aldehyd-Moleküle permanente Dipole, wegen der polaren C=O-Doppelbindung, wobei vor allem die beiden pi-Elektronen die Polarität verstärken, da sich noch leichter vom elektronegativen Sauerstoff-Atom angezogen werden als die beiden Elektronen der sigma-Bindung.
Aus diesen Tatsachen kann man die wichtigsten physikalischen Eigenschaften der Aldehyde schon fast ableiten.
Siedepunkte
Die Siedetemperaturen sind wegen der Dipol-Eigenschaften der Moleküle deutlich höher als die vergleichbarer Alkane oder Alkene, deren Moleküle lediglich durch London-Kräfte zusammengehalten werden (intermolekulare Anziehungskräfte). Bei den Aldehyden (und Ketonen) wirken dagegen zusätzlich die Keesom-Kräfte (oft einfach als Dipol-Dipol-Bindungen bezeichnet).
Andererseits können Aldehyd-Moleküle untereinander keine H-Brücken bilden, daher sind die Siedepunkte deutlich niedriger als die vergleichbaren Alkohole.
"Vergleichbar" heißt hier stets: ähnliche molare Masse, ähnliche Grundstruktur, und der Alkohol, mit dem der Aldehyd verglichen wird, darf nur eine OH-Gruppe am C1-Atom besitzen.
| Name | Molare Masse [3] | Siedepunkt [3] | Wasserlöslichkeit [3] |
| Butan | 58 g/mol | -0,5 ºC | 61 mg/Liter |
| Propanal | 58 g/mol | +49 ºC | 679 g/Liter |
| Propan-1-ol | 60 g/mol | +97 ºC | unbegrenzt |
Wasserlöslichkeit
Mit dem elektronegativen O-Atom besitzen Aldehyde und Ketone einen H-Brücken-Akzeptor, die Moleküle können also mit Wasser-Molekülen H-Brücken bilden.
Daher ist die Wasserlöslichkeit der Aldehyde und Ketone größer als die vergleichbarer Alkane oder Alkene, aber geringer als die Wasserlöslichkeit vergleichbarer Alkohole.
| Name | Molare Masse | Siedepunkt | Wasserlöslichkeit |
| Methanal | 32 g/mol | -19 ºC | unbegrenzt |
| Ethanal | 46 g/mol | +20 ºC | unbegrenzt |
| Propanal | 60 g/mol | +49ºC | 679 g/Liter |
| Butanal | 72 g/mol | +75 ºC | 71 g/Liter |
| Pentanal | 86 g/mol | +103 ºC | 14 g/Liter |
| Hexanal | 102 g/mol | +129 ºC | 6 g/Liter |
Aber selbst Hexanal ist immer noch deutlich besser in Wasser löslich als alle Alkane oder Alkene.
Eigenschaften der Ketone
Einiges über die Eigenschaften der Ketone wurde bereits bei der Besprechung der Aldehyde erwähnt, daher wollen wir uns hier kurz fassen.
Siedepunkte und Wasserlöslichkeit
Ketone haben ebenfalls eine Carbonyl-Gruppe, allerdings mitten im Molekül: R1-CO-R2. Es ist also kein H-Atom mit der Carbonyl-Gruppe verbunden. Auch bei den Ketonen kann die polare Carbonyl-Gruppe Dipol-Eigenschaften verursachen, so dass Ketone ähnlich wie Aldehyde höhere Siedepunkte haben als vergleichbare Alkane. Wasserstoffbrücken-Bindungen können Keton-Moleküle untereinander allerdings auch nicht bilden, so dass die Siedepunkte der Ketone niedriger sind als die vergleichbarer Alkohole. Allerdings können Ketone H-Brücken mit Wasser-Molekülen bilden, so dass kurzkettige Ketone wasserlöslich sind. Aceton bzw. Propanon ist sogar unbegrenzt mit Wasser mischbar. Längerkettige Ketone sind wegen der Alkylgruppen nicht mehr wasserlöslich, wie die folgende Tabelle zeigt.
| Name | Molare Masse | Siedepunkt | Wasserlöslichkeit |
| Propanon | 58 g/mol | +56 ºC | unbegrenzt |
| Butanon | 72 g/mol | +80 ºC | 292 g/l |
| Pentan-2-on | 86 g/mol | +102ºC | 43 g/Liter |
| Hexan-2-on | 100 g/mol | +128 ºC | 17 g/Liter |
| Heptan-2-on | 114 g/mol | +151 ºC | 4,3 g/Liter |
Auch hier gilt für die Wasserlöslichkeit: Selbst Heptan-2-on mit immerhin sieben C-Atomen ist immer noch viel besser in Wasser löslich als alle Alkane und Alkene, deren Wasserlöslichkeit im Milligramm-Bereich liegt.
Quellen:
- engl. Wikipedia, Artikel "Carbonyl group".
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. 2. Auflage, Berlin 2013.
- Wikipedia, verschiedene Artikel zu den einzelnen Aldehyden und Ketonen.
Seitenanfang -
Alkohol-Oxidation - Carbonyl-Gruppe -
Nachweis -
Weitere Aspekte