Eliminierung (E2 - Mechanismus)
In diesem Video von Ramona Reinhart wird der E2-Mechanismus sehr anschaulich erklärt.
Eine SN2-Reaktion
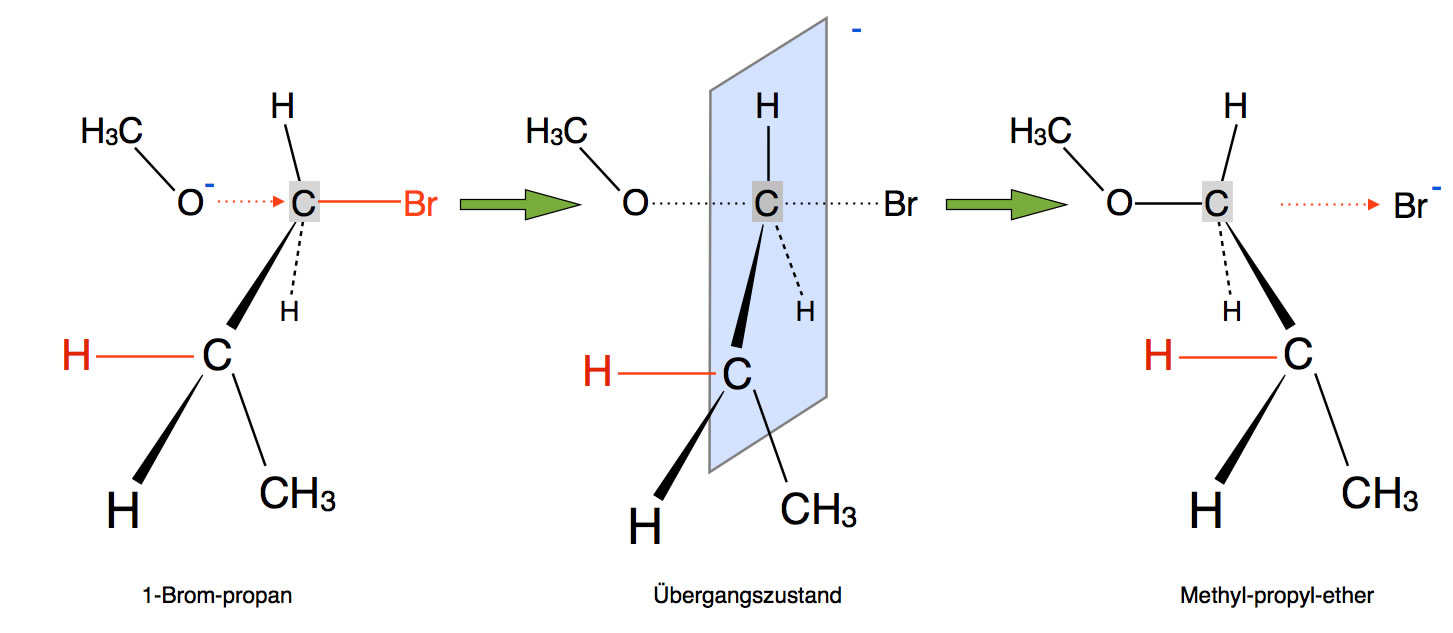
Betrachten wir einmal eine "alltägliche" SN2-Reaktion, nämlich die Umsetzung von 1-Brom-propan mit dem Methanolat-Ion als Nucleophil:
Diese Reaktion läuft nach dem SN2-Mechanismus ab. Der SN1-Mechanismus ist energetisch sehr ungünstig, weil dann ein primäres Carbenium-Ion gebildet werden müsste. Also scheidet auch eine E1-Eliminierung als Konkurrenzreaktion aus.
Trotzdem kann man bei der Reaktion ein Alken als Nebenprodukt feststellen, nämlich Propen.
Wie kann Propen entstehen, wenn keine E1-Eliminierung ablaufen kann?
Offensichtlich gibt es eine alternative Möglichkeit der Eliminierung.
Die E2-Eliminierung
Dazu betrachten wir das nächste Bild:
Die Bildung des Übergangszustandes bei der E2-Eliminierung
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
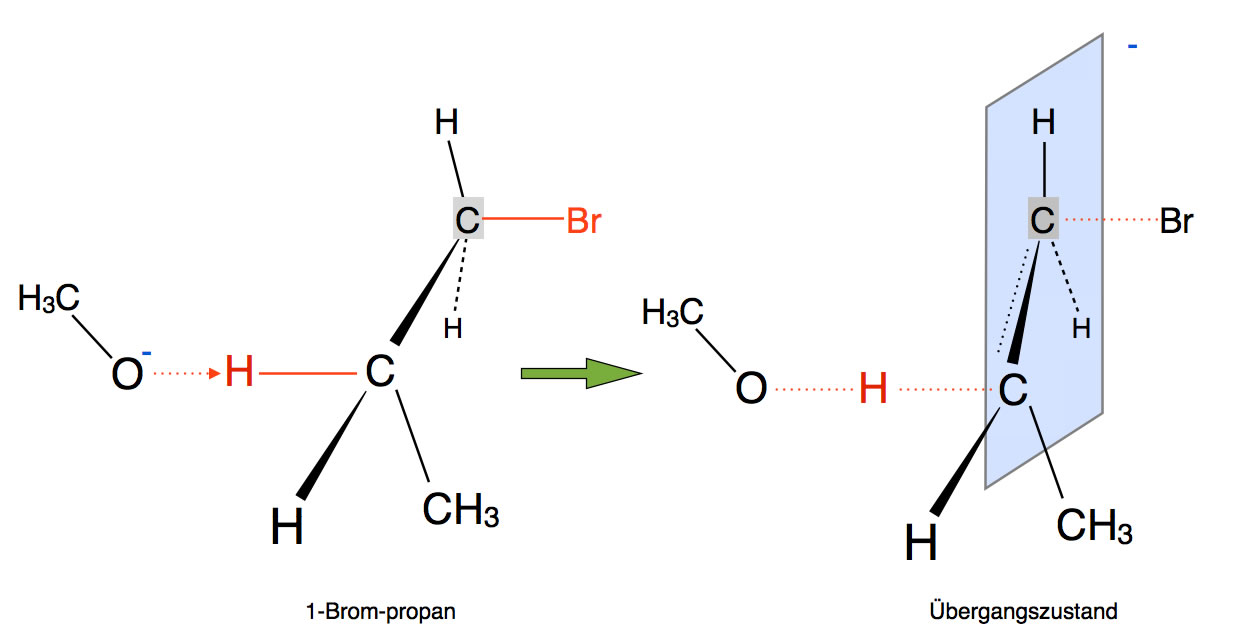
Das Methanolat-Anion greift hier nicht als Nucleophil an, sondern als Base!
Als Nucleophil würde Methanolat das Brom aus dem Molekül verdrängen (SN2-Mechanismus). Als Base dagegen zieht das Methanolat ein Proton aus dem 1-Brom-Propan.
Entfernt man ein Proton aus einem organischen Molekül, bleibt ein negativ geladenes C-Atom zurück, ein sogenanntes Carbanion. Carbanionen sind recht instabil, und wenn es eine Möglichkeit gibt, die Bildung eines Carbanions zu vermeiden, so wird diese auch gewählt.
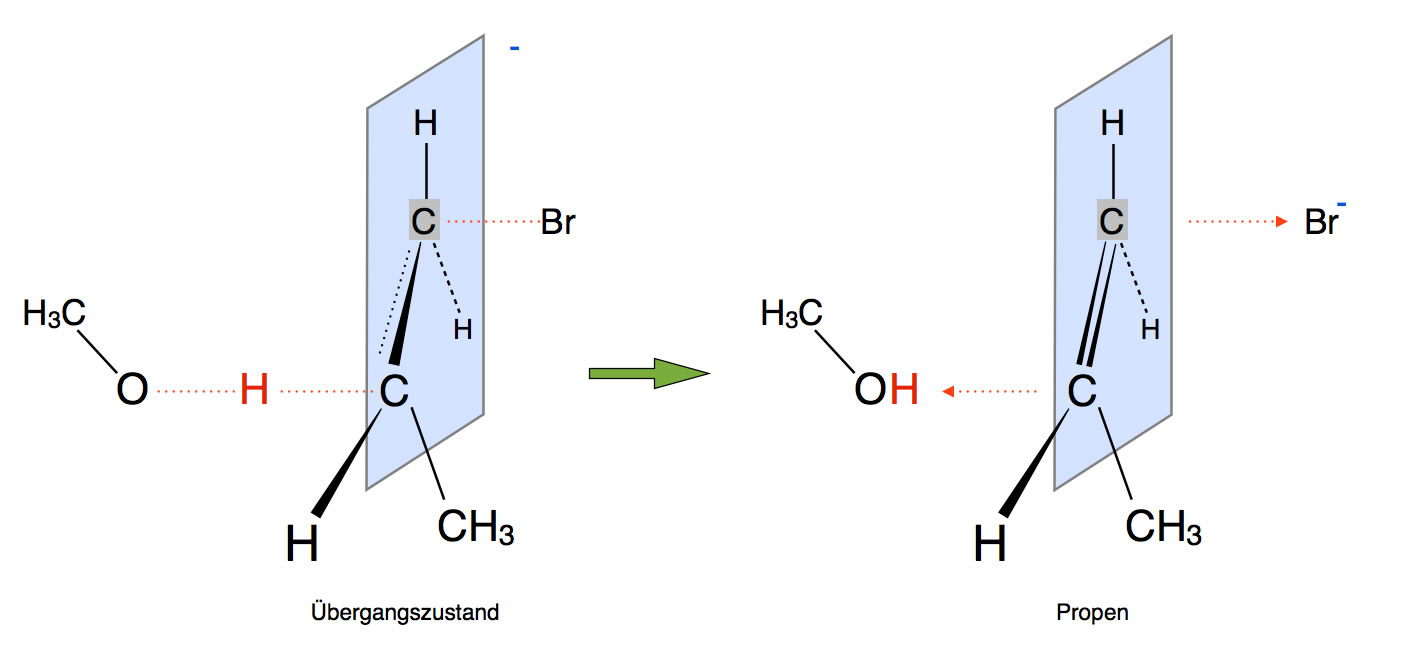
Bei der E2-Eliminierung wird die Bildung eines Carbanions vermieden, indem gleichzeitig (konzertierte Reaktion) mit der Entfernung des Protons ein Bromid-Ion abgegeben wird. Das kann man an dem Übergangszustand in der nächsten Abbildung gut erkennen.
Die Base Methanolat "zieht" das H-Atom ganz aus dem Molekül heraus, gleichzeitig entfernt sich das Brom als Bromid-Ion von dem Molekül. Aus der "halben" Doppelbindung wird eine ganze Doppelbindung.
Damit haben wir den E2-Mechanismus im Prinzip schon kennengelernt. Für den Schulunterricht der Sekundarstufe II sollte das hier Gesagte ausreichen. Man muss bedenken, dass im Zentralabitur NRW zwar der Begriff "Eliminierung" sehr oft vorkommt, dass hier aber nicht zwischen E1- und E2-Eliminierung unterschieden wird.
Diese Seite ist vor allem für Schüler(innen) geschrieben, die überlegen, das Fach Chemie zu studieren. Und auch für Erst- und Zweitsemester der Studiengänge Chemie, Pharmazie etc. könnte diese Vertiefungsseite interessant sein.
Sie finden hier weitere Informationen zur E2-Eliminierung. Vor allem wird auf trans- und syn-Eliminierung sowie auf die Regioselektivität der E2-Reaktion eingegangen. Kenntnisse des Orbitalmodells sind dabei nützlich.