E1- und E2-Eliminierungen
Bei der Einführung der nucleophilen Substitution haben wir einen grundlegenden Versuch besprochen, der sich inzwischen auch in jedem guten Schulbuch der Oberstufenchemie wiederfindet. Die drei Brombutane (1-Brombutan, 2-Brombutan und 2-Methyl-2-Brompropan) werden mit Ethanol versetzt. Bei diesem Versuch soll gezeigt werden, dass das tertiäre 2-Methyl-2-Brompropan deutlich besser mit Ethanol reagiert als das sekundäre bzw. primäre Brombutan.
Nun kann das Alkoholat-Ion, das bei dem Versuch eine entscheidende Rolle spielt, das Brombutan auf mehrere Weisen angreifen. Betrachten wir zunächst das folgende Bild:
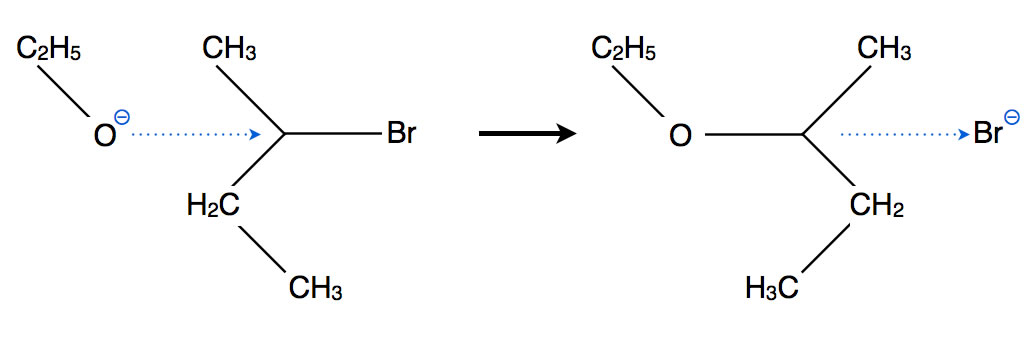
Das Alkoholat-Anion greift als Nucleophil an
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
In der Abbildung 1 ist zu sehen, wie das Ethanolat-Anion das sekundäre 2-Brombutan als Nucleophil angreift. Offensichtlich handelt es sich hier um eine Reaktion nach dem SN2-Mechanismus, was man zum Beispiel an der Inversion des Substrats erkennen kann. Gleichzeitig mit dem Eintritt des Nucleophils verlässt das Nucleofug das Substrat.
Wahrscheinlicher als ein SN2-Angriff ist jedoch eine SN1-Substitution. Das Wort "Angriff" wird hier nicht verwendet, weil der erste Schritt der SN1 ja die "freiwillige" Dissoziation des Substrates ist, erst danach erfolgt im zweiten Schritt der nucleophile Angriff:
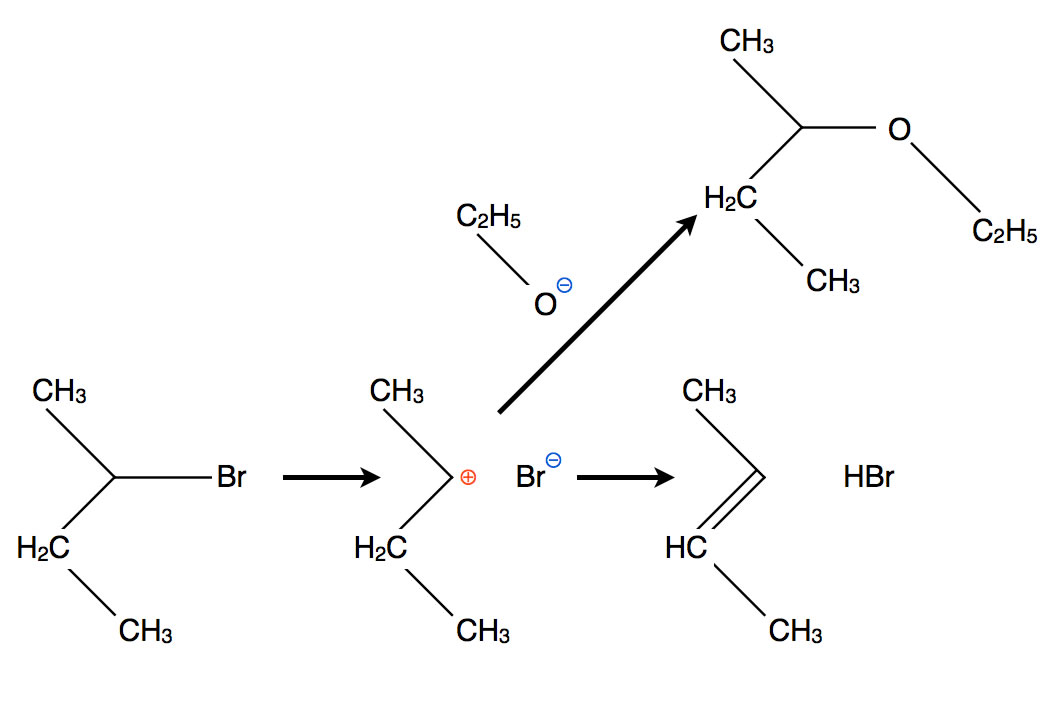
Die Eliminierung als Konkurrenzreaktion zur SN1-Substitution
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Ein sekundäres Halogenalkan wie 2-Brombutan kann sowohl nach dem SN2- wie auch nach dem SN1-Mechanismus mit Nucleophilen reagieren. Hier sehen wir einen typischen SN1-Verlauf. Im ersten Reaktionsschritt trennt sich das Brom-Atom in Form eines Bromid-Ions heterolytisch von dem Substrat ab. Dabei entsteht ein Carbenium-Ion. Dieses hat nun zwei Möglichkeiten zu reagieren. Entweder lagert es ein neues Nucleophil an, zum Beispiel ein Ethanolat-Anion. Dieser Weg ist im oberen Teil der Abbildung zu sehen. Oder es spaltet ein Proton ab und wird dann zu einem Alken. Diesen Weg sieht man rechts unten in der Abbildung. Nucleophile Substitution SN1 und Eliminierung sind dann Konkurrenzreaktionen.
Betrachten wir nun noch ein drittes Bild, um die Sache zu vervollständigen:
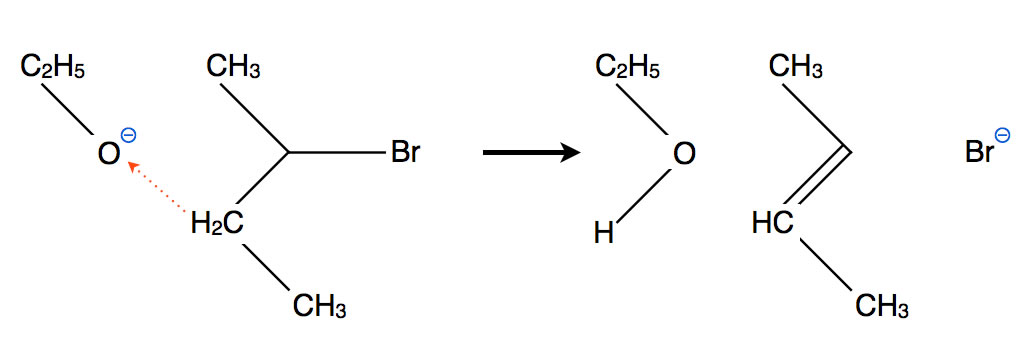
Das Alkoholat-Anion tritt als Base auf
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
In dem ersten Bild hat sich das Alkoholat-Anion als Nucleophil verhalten, im zweiten Bild ebenfalls. In der Abbildung drei sehen wir eine neue Seite das Alkoholat-Anions. Es ist nicht nur ein Nucleophil, sondern auch eine Brönsted-Base, kann also Protonen an sein Sauerstoff-Atom anlagern. Diese Protonen stammen dann aus dem Substrat. Gleichzeitig mit dem Proton wird das Brom-Atom als Bromid-Anion abgespalten. Als Ergebnis entsteht dann wieder ein Alken.
Eine Eliminierung kann als Konkurrenzreaktion zur SN1-Substitution auftreten. Das beim ersten Schritt gebildete Carbenium-Ion gibt dann einfach ein Proton ab und wird zum Alken.
Eine Eliminierung kann aber auch das Ergebnis einer Säure-Base-Reaktion sein. Eine starke Base kann einer organischen Verbindung ein Proton entziehen. Wenn dann gleichzeitig ein Anion aus der Verbindung austritt, entsteht wieder ein Alken.
Wir haben auf dieser Seite zwei verschiedene Mechanismen der Eliminierung kennengelernt. Die Eliminierung, die als Konkurrenzreaktion zur SN1 abläuft, wird als E1-Eliminierung bezeichnet, weil sie nach einer Kinetik 1. Ordnung abläuft. Das liegt an dem geschwindigkeitsbestimmenden ersten Reaktionsschritt, der Bildung des Carbenium-Ions.
Die Eliminierung, die dann eintritt, wenn eine starke Base dem organischen Substrat ein Proton entzieht, wird als E2-Eliminierung bezeichnet. Gleichzeitig mit dem Entzug des Protons wird auch ein Anion abgegeben, es handelt sich also genauso wie die SN2 um eine konzertierte Reaktion. Diese Eliminierung verläuft nach einer Kinetik 2. Ordnung, weil die Base und das organische Substrat zusammenstoßen müssen, damit die Reaktion erfolgt.
Weitere Einzelheiten zur E1- und E2-Eliminierung finden Sie auf den Folgeseiten.
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 3. Auflage, Weinheim 2000.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
Seitenanfang -
Weiter mit dem E1-Mechanismus...