Inhaltsübersicht
Struktur
Nomenklatur
Physikalische Eigenschaften
Chemische Reaktionen
Weiterführende Seiten
Struktur, Nomenklatur ⇑
Alkane sind die einfachsten Kohlenwasserstoffe. Wie alle anderen Kohlenwasserstoffe bestehen die Moleküle der Alkane nur aus Kohlenstoff- und Wasserstoff-Atomen. Während in Alkenen Doppelbindungen und in Alkinen sogar Dreifachbindungen vorkommen, finden sich in den Molekülen der Alkane ausschließlich C-C-Einfachbindungen und C-H-Einfachbindungen.
Methan ↑
Zum Methan selbst muss ja wohl nicht viel gesagt werden, es handelt sich um das einfachste Alkan mit der Summenformel CH4. Aus dem Schulunterricht sollten Sie noch wissen, dass das Methan-Molekül eine tetraedrische Struktur hat, die auf der Anordnung der vier Kugelwolken beruht (Elektronenpaarabstoßungs-Modell).
Aus den bisherigen Folgen der "Chemie für Mediziner" wissen Sie, dass das Kohlenstoff-Atom sp3 hybridisiert sein kann, und die vier sp3-Hybridorbitale nehmen - ähnlich wie die Kugelwolken im einfacheren Kugelwolkenmodell - eine tetraederförmige Anordnung ein.
Jedes Hybridorbital ist mit einem Elektron besetzt und überlappt mit den 1s-Orbitalen von vier Wasserstoff-Atomen. Bei den vier C-H-Bindungen im Methan handelt es sich also um σ-Bindungen.
Medizinische Bedeutung
Methan ist auch als "Sumpfgas" bekannt, es entsteht, wenn in einem Teich oder Tümpel organisches Material von Bakterien zersetzt wird. Ähnliche Vorgänge finden auch in unserem Dickdarm statt. Bestimmte Darmbakterien können Nahrungsmittelbestandteile enzymatisch spalten, dabei entsteht dann auch Methan, was zu unangenehmen Blähungen führen kann.
Außerdem macht das Methan den Darm träge, der Darminhalt wird nicht mehr so schnell weiter transportiert, und Verstopfungen können die Folge sein.
Laut [1] sind die methanproduzierenden Archaeen im Dickdarm auch als Adipositas-Erreger bekannt, sie gewinnen zusätzliche Energie aus der Nahrung.
Ethan ↑
Ethan C2H6 ist das zweite Glied in der homologen Reihe der Alkane. In den Ethan-Molekülen kommt zum ersten Mal eine C-C-Einfachbindung vor, die durch ihre freie Drehbarkeit gekennzeichnet ist. Das heißt, die beiden Methylgruppen des Ethans können mehr oder weniger frei gegeneinander verdreht werden. Bei der C=C-Doppelbindung im Ethen-Molekül, einem Alken, ist dies nicht mehr möglich, und beim Ethin mit seiner Dreifachbindung erst recht nicht.
Beim Ethan taucht auch zum ersten Mal das Phänomen der Konformations-Isomerie auf. Unter dem Begriff "Konformation" versteht man die exakte räumliche Anordnung der Atome eines Moleküls. Eine Konformations-Änderung kann jederzeit stattfinden, ohne dass dazu irgendwelche kovalenten Bindungen aufgebrochen werden müssen. Im Gegensatz dazu müssten für eine Änderung der Konstitution kovalente Bindungen aufgebrochen werden.
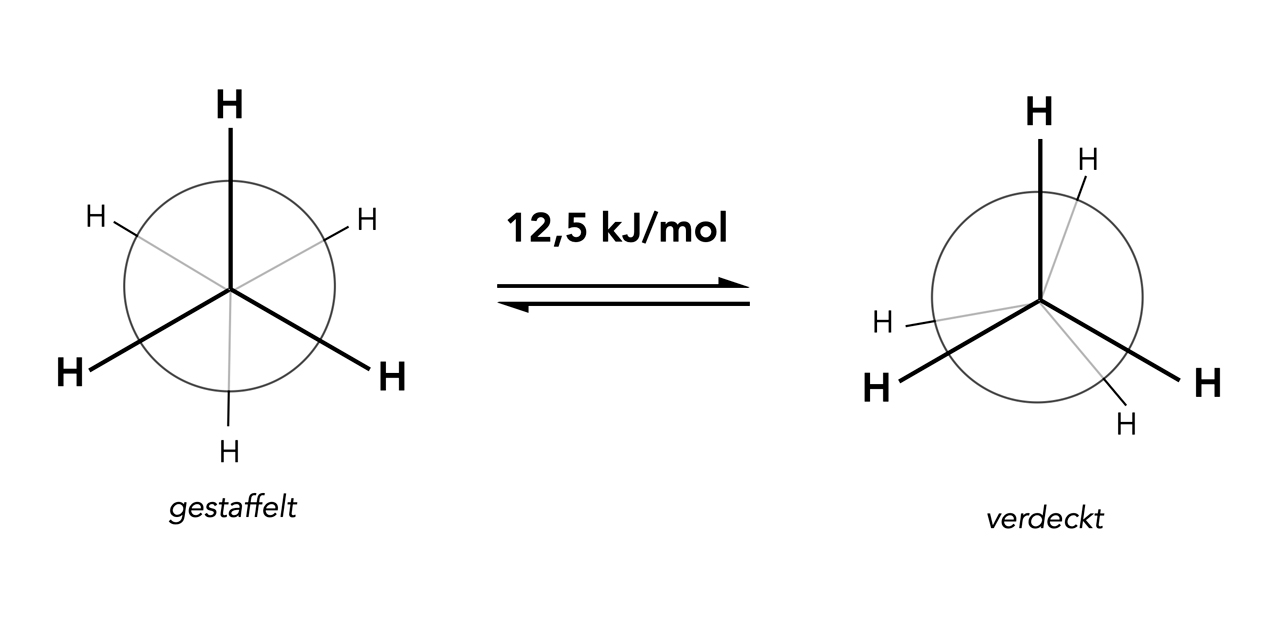
Die zwei Konformations-Isomere des Ethans
Autor: Ulrich Helmich 2022, Lizenz: Lizenz: CC BY-NC-SA 4.0
Hier sieht man die beiden bekanntesten Konformationen des Ethans, die gestaffelte und die verdeckte. Die gestaffelte Konformation ist dabei um 12,5 kJ/mol günstiger als die verdeckte. Bei der verdeckten Konformation stoßen sich die Bindungselektronen der sechs C-H-Bindungen stärker ab, weil sie näher zusammenstehen als bei der gestaffelten Konformation.
Medizinische Bedeutung
Eine medizinische Bedeutung hat das Ethan nicht, es sei denn, ein Patient hat zu viel Ethan eingeatmet und leidet jetzt unter erhöhten Atem- und Herzfrequenzen, Taubheit in den Gliedern, Schlaflosigkeit, mentaler Verwirrung und weiteren Symptomen [2].
Propan ↑
Das dritte Glied in der homologen Reihe der Alkane ist das Propan mit der Summenformel C3H8. Propan kennen Sie vielleicht von den roten Gasflaschen her, in denen das Propan als Brennstoff geliefert wird. Eine medizinische Bedeutung hat das Propan nicht. Auch chemisch ist das Propan nicht besonders "interessant", im Gegensatz zum Butan.
Butan ↑
Das vierte Glied in der homologen Reihe der Alkane ist das Butan mit der Summenformel C4H10. Butan kennen Sie sicherlich als Campinggas, es wird normalerweise in kleinen blauen Kartuschen geliefert.
Konstitutions-Isomerie
Chemisch interessant ist, dass beim Butan zum ersten Mal in der Reihe der Alkane das Phänomen der Konstitutions-Isomerie auftaucht. Es gibt nämlich zwei verschiedene Strukturen mit der gleichen Summenformel C4H10. Diese werden als n-Butan und 2-Methylpropan bezeichnet. Damit wären wir auch schon beim Thema "Nomenklatur der Alkane", das bei den meisten Studierenden nicht allzu beliebt ist.
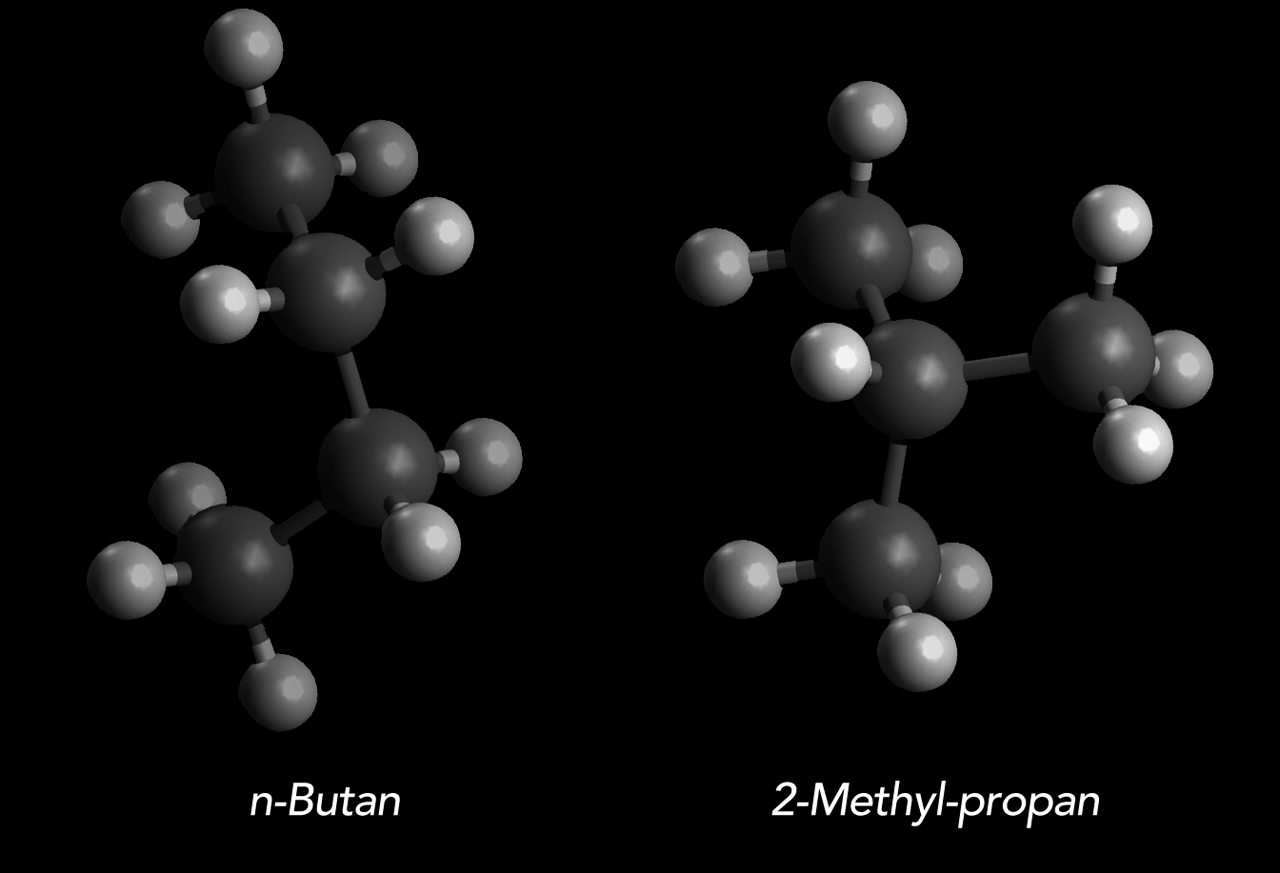
Das "normale" Butan oder n-Butan sowie das 2-Methyl-propan
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
Das 2-Methylpropan (die Schreibweise "2-Methyl-propan" ist nicht ganz korrekt, bei längeren Stoffnamen verhelfen zusätzliche Bindestriche aber zu einer größeren Übersichtlichkeit) erhält seinen Namen folgendermaßen:
Nomenklatur ↑
Die längste durchgehende Kohlenstoffkette besteht aus drei C-Atomen wie beim Propan. Das verzweigte Alkan ist also grundsätzlich ein Propan-Derivat. Am zweiten C-Atom hängt jedoch noch eine Methylgruppe, und den Namen dieser Methylgruppe stellt man nun dem Grundnamen "Propan" voran.
Beim 2-Methylpropan müsste man die Ziffer 2 eigentlich nicht mit angeben, denn es gibt keine andere Möglichkeit, die Methylgruppe unterzubringen. Säße die Methylgruppe am C-Atom Nr. 1, dann hätten wir ja das n-Butan-Molekül. Und befände sich die Methylgruppe am C-Atom Nr. 3, dann hätten wir es wieder mit n-Butan zu tun. Die Angabe einer Ziffer wäre erst bei einem Pentan-Grundgerüst notwendig. Denn hier könnte eine Methylgruppe am C-Atom Nr. 2 sitzen oder am mittleren C-Atom Nr. 3.
Medizinische Bedeutung ↑
In der Pharmazie verwendet man Butan als Treibgas für Medizinprodukte und Arzneimittel wie Sprays oder Schäume. Wegen seiner geringen Toxizität wird Butan im Alltag häufig problemlos eingesetzt. Manche Leute missbrauchen Butan auch als Rauschmittel und Schnüffelstoff [3, 4].
Die höheren Alkane ↑
Ab Pentan C5H12 sind die Alkane bei Zimmertemperatur flüssig. Neue chemische Aspekte treten bei den höheren Alkanen jetzt nicht mehr auf, wenn man mal von der interessanten Nomenklatur absieht, die bei den verzweigten höheren Alkanen notwendig ist.
Medizinische Bedeutung ↑
Paraffin ist ein zähflüssiges Gemisch verschiedener höherer Alkane. Das Paraffinöl wird als Darmgleitmittel eingesetzt. Anna Lánczos hat die Wirkung von Paraffinöl auf den Darm näher untersucht. Die Ergebnisse ihrer Untersuchungen finden sich in [5].
Paraffin ist auch Bestandteil vieler Salben und Cremes, zum Beispiel für den Hautschutz.
Nomenklatur verzweigter Alkane ⇑
Um den wissenschaftlichen Namen eines verzweigten Alkans zu ermitteln, gibt es ein paar einfache Regeln, die man befolgen sollte.
- Längste Kette suchen
- Seitenketten identifizieren
- Seitenketten alphabetisch sortieren
- Positionsnummern der Seitenketten festlegen
- Mehrfach vorkommende Seitenketten benennen
Regel 1 ↑
Identifizieren Sie die längste durchgehende Kohlenstoffkette des Alkans und benennen Sie diese, dann haben Sie schon einmal den Namen des Grundgerüstes. Betrachten Sie dazu die folgende Struktur:

Ein sehr komplex aufgebautes verzweigtes Alkan
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Auf den ersten Blick ist man geneigt, die obere Kette zum Hauptgerüst zu bestimmen. Diese Kette besteht aus acht C-Atomen, also wäre Octan der Name des Grundgerüstes.
Schauen Sie jetzt einmal genauer hin. Gibt es nicht noch eine Kette, die länger ist. Eine Kohlenstoffkette darf auch "um die Ecke" gehen.
Tatsächlich, wenn wir genau hinsehen, finden wir eine Kette aus neun C-Atomen. Auf der nächsten Abbildung ist diese Nonan-Kette grün hervorgehoben:
Benennung der Seitenketten
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
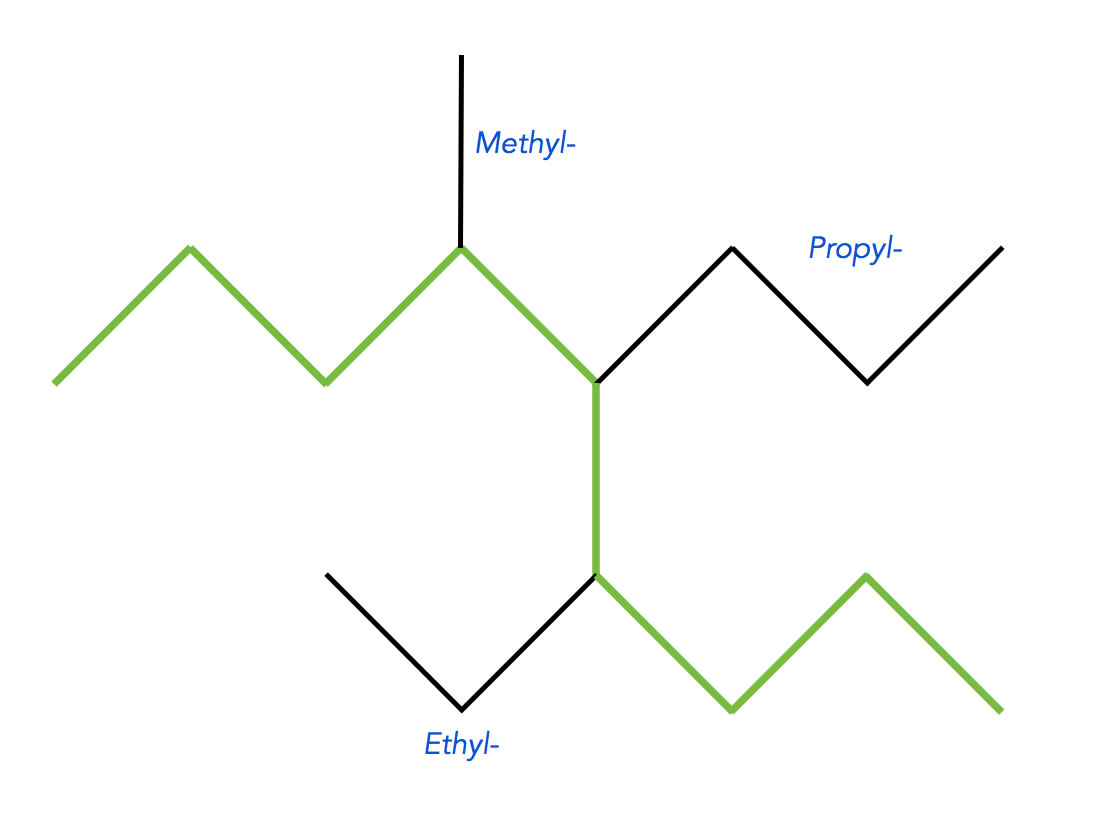
Regel 2 ↑
Identifizieren Sie die Seitenketten und notieren Sie sich ihre Positionen. Bei der Bestimmung der Positionen können Sie entweder links oder rechts mit dem Zählen der C-Atome anfangen. Am besten schreiben Sie sich beide Alternativen in verschiedenen Farben auf:

Benennung der Seitenketten und Bestimmung der Positionen
Autor: Ulrich Helmich 2023, Lizenz: siehe Seitenende
Wir finden drei verschiedene Seitenketten, eine Methyl-, eine Ethyl- und eine Propyl-Seitenkette. Die Positionen sind in grün markiert (von rechts angefangen) bzw. in rot (von links angefangen).
Regel 3 ↑
Ordnen Sie die Seitenketten alphabetisch, schreiben Sie vor jede Seitenkette die Position und hängen Sie dann den Namen des Grundgerüstes an das Ende.
Wenn wir mit den Positionsangaben links anfangen, erhalten wir den Namen
6-Ethyl-4-methyl-5-propyl-nonan
Fangen wir dagegen rechts an, ergibt sich
4-Ethyl-6-methyl-5-propyl-nonan
Regel 4 ↑
Regel 4a
Die Summe der Positionsziffern sollte minimal sein.
In unserem Fall bekommen wir stets die Summe 15, egal ob wir mit dem Zählen links oder rechts anfangen. In einem solchen Fall kann die Regel 4 ergänzt werden:
Regel 4b
Wenn die Summen der Positionsziffern sich nicht unterscheiden, wenn man links oder rechts mit dem Zählen anfängt, sollte man den Namen wählen, bei dem der alphabetisch erste Substituent die kleinste Ziffer erhält.
Damit wären wir dann bei der Bezeichnung
4-Ethyl-6-methyl-5-propyl-nonan
für das gezeigte Alkan.
Regel 5 ↑
Regel 5a
Kommt ein Substituent mehrmals in dem Alkan vor, werden die Silben "Di", "Tri", "Tetra" etc. verwendet.
Eine Nonan-Kette mit zwei Methylgruppen an den Positionen 2 und 3 sowie zwei weiteren Methylgruppen an der Position 4 wird als 2,2,4,4-Tetramethyl-nonan bezeichnet.
Regel 5b
Die Silben "Di", "Tri" etc. werden bei der alphabetischen Einordnung der Substituenten nicht berücksichtigt.
Die Bezeichnung "Tetramethyl" wird also nicht unter "T" eingeordnet, sondern unter "M", die Bezeichnung "Diethyl" nicht unter "D", sondern unter "E".
Weitere Regeln ↑
Es gibt noch weitere Regeln für die Benennung von Alkanen, die uns hier aber nicht interessieren müssen, weil sie für die Medizin-Prüfungen keine Rolle spielen.
Auf dieser Seite für Oberstufenschüler sind die Nomenklaturregeln für Alkane noch etwas genauer erläutert.
Diese Seite zur Nomenklatur der Alkane ist speziell für Studienanfänger des Faches Chemie geschrieben. Hier wird auch erklärt, wie man Alkane benennt, deren Seitenketten ihrerseits verzweigt sind. In den Prüfungen im Fach Medizin wird das aber nicht verlangt.
Physikalische Eigenschaften ⇑
Alkane haben im Vergleich zu anderen organischen Verbindungen sehr niedrige Schmelz- und Siedetemperaturen und sehr geringe Dichten. Auch die Wasserlöslichkeit der Alkane ist zu vernachlässigen, sie geht gegen Null.
Ursache für all diese charakteristischen physikalischen Eigenschaften ist die Tatsache, dass alle Alkan-Moleküle extrem unpolar sind. Der Elektronegativitäts-Unterschied zwischen Kohlenstoff und Wasserstoff ist sehr gering, daher sind die C-H-Bindungen in den Alkanen nur sehr schwach polar. Alkane haben daher auch keinen Dipol-Charakter. Als intermolekulare Anziehungskräfte kommen nur sehr schwache Kräfte in Frage, die Sie in der Schule vielleicht als van-der-Waals-Kräfte kennengelernt haben.
Allerdings ist diese Bezeichnung nicht ganz korrekt. Wenn der Chemiker von "van-der-Waals-Kräften" redet, meint er eine ganze Gruppe verschiedener Wechselwirkungen:
- Anziehung permanenter Dipol - permanenter Dipol (Keesom-Wechselwirkung)
- Anziehung permanenter Dipol - polarisierbares Teilchen (Debye-Wechselwirkung)
- Anziehung polarisierbares Teilchen - polarisierbares Teilchen (London-Wechselwirkung
All diese drei Wechselwirkungen werden als van-der-Waals-Wechselwirkung zusammengefasst. Die Kräfte, die die Alkan-Moleküle zusammenhalten, sind die London-Wechselwirkungen.
Wie in Blick in eines der bekannten Fachbücher zeigt (Zeeck, Chemie für Mediziner), wird aber auch dort der Begriff van-der-Waals-Kraft verwendet, wenn eigentlich London-Kräfte gemeint sind. Also können Sie sich für Ihre Prüfungen ruhig den Begriff "van-der-Waals-Kraft" merken.
Lipophil - lipophob - hydrophil - hydrophob ↑
Im Zusammenhang mit dem Löslichkeitseigenschaften der Alkane gibt es wieder vier neue Fachbegriffe zu lernen.
Alkane sind grundsätzlich lipophil und hydrophob. Das erste Wort können wir mit "Fett liebend" übersetzen und das zweite Wort mit "Wasser meidend". Pflanzenfette und -öle können wir problemlos in einem flüssigen Alkan wie zum Beispiel Hexan auflösen.
Alkane sind lipophil, fett liebend. Mischen wir Hexan und Wasser, dann bilden sich sofort zwei Phasen. Unten befindet sich das Wasser, und oben das Alkan. Beide Flüssigkeiten vermischen sich nicht. Wenn wir dann einmal kräftig schütteln, erhalten wir eine Emulsion mit Alkan-Tröpfchen, die im Wasser schweben. Lassen wir diese Emulsion eine Zeit lang stehen, können wir eine Entmischung beobachten, die beiden Verbindungen haben sich wieder getrennt, und nach einige Zeit können wir wieder zwei klar getrennte Phasen beobachten: Das Alkan oben und das Wasser unten. Alkane meiden also das Wasser, sie sind hydrophob.
Der Begriff lipophob trifft auf Alkane nicht zu, ebenso wenig wie der Begriff hydrophil. Aber auf Wasser treffen die beiden Begriffe sehr gut zu. Wasser ist lipophob, also "Fett vermeidend", und natürlich ist Wasser hydrophil, also "Wasser liebend".
Oft werden die Begriffe lipophil und hydrophob als Synonyme verwendet, ebenso die Begriffe lipophob und hydrophil. Ganz korrekt ist das vielleicht nicht, aber es hat sich eben so eingebürgert.
Auf dieser Seite für Studienanfänger des Fachs Chemie erfahren Sie noch Genaueres über die physikalischen Eigenschaften der Alkane.
Chemische Reaktionen der Alkane ⇑
Oxidation
Alkane sind wichtige Bestandteile in Brennstoffen wie Benzin, Diesel oder Heizöl. Bei der Verbrennung mit Sauerstoff entstehen als Endprodukte Wasser und Kohlendioxid - im Idealfall, meistens werden aber auch noch andere, teils giftige Verbindungen freigesetzt, weil in den Brennstoffen neben den Alkanen auch verschiedene andere Verbindungen enthalten sind.
Schaut man in die verschiedenen Prüfungsvorbereitungsbücher, so kann es durchaus vorkommen, dass man die Reaktionsgleichung für die Oxidation eines Alkans aufstellen muss. Wir wollen das einmal an einem nicht allzu komplizierten Beispiel üben.
Reaktionsgleichungen aufstellen
Wie sieht die Reaktionsgleichung für die Verbrennung von Butan C4H10 aus?
Als erstes stellen wir fest, dass wohl vier CO2-Moleküle bei der Verbrennung entstehen. Dazu werden dann vier O2-Moleküle benötigt. Die erste - noch unvollständige - Reaktions-"gleichung" wäre dann
C4H10 + 4 O2 → 4 CO2 + ? H2O
Dann müssen wir uns um den Wasserstoff kümmern. Die 10 H-Atome reagieren mit fünf O-Atomen zu fünf H2O-Molekülen. Also benötigen wir noch 2,5 O2-Moleküle zusätzlich:
C4H10 + 6,5 O2 → 4 CO2 + 5 H2O
Wollen wir diese "Gleichung" einmal überprüfen, so es sich wirklich um eine Gleichung handelt?
Auf der linken Seite finden wir 4 C-Atome, 10 H-Atome und 13 O-Atome.
Auf der rechten Seite sehen wir 4 C-Atome, 10 H-Atome und 13 O-Atome.
Damit hätten wir also die korrekte Reaktionsgleichung aufstellt, die auch den Namen "Gleichung" verdient.
Es gibt allerdings Lehrer und Professoren, die sich an den 6,5 O2 stören würden. Daher ist es durchaus sinnvoll, die ganze Gleichung mit dem Faktor 2 zu multiplizieren:
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Halogenierung ↑
Bei der Halogenierung reagiert das Alkan mit einem Halogen wie Fluor, Chlor oder Brom. Mit Iod reagieren Alkane in der Regel nicht, dafür ist das Iod nicht reaktiv genug. Der Reaktionsmechanismus der Halogenierung ist ein radikalischer.
Radikale und radikalische Reaktionen in Biologie und Medizin
Radikale sind Atome oder Moleküle mit einem ungepaarten Elektron, also mit einem nur einfach besetzten Orbital. Solche Teilchen sind extrem reaktionsfreudig. Um das nur einfach besetzte Orbital mit einem zweiten Elektron zu besetzen, reißen Radikale oft andere Atome aus organischen Verbindungen heraus, die dann aber selbst zum Radikal werden, weil ihnen nun ein Elektron fehlt.

Ein Radikal erzeugt ein neues Radikal
Autor: Ulrich Helmich 12/2023, Lizenz: siehe Seitenende
Das Radikal X reagiert mit der organischen Verbindung H-Y und abstrahiert aus dieser ein H-Atom samt einem der beiden Bindungselektronen. X hat nun durch das zusätzliche Elektron ein vollständig besetztes Orbital, aber die Verbindung H-Y ist jetzt zu einem neuen Radikal geworden.
Auch im menschlichen Körper kommen solche Radikale vor, vor allem bei Reaktionen, in denen Sauerstoff O2 eingesetzt wird wie in der Atmungskette der Mitochondrien. Solche Reaktionen verlaufen oft radikalisch. "Wild gewordene", also unkontrolliert freigesetzte Radikale können aber großen Schaden in den Zellen anrichten. Zum Glück gibt es aber einige Enzyme und Vitamine, die als sogenannte Radikalfänger unterwegs sind und solche Radikale unschädlich machen, indem sie sich mit ihnen zu harmlosen Molekülen verbinden. Bekannte Radikalfänger sind beispielsweise Vitamin C und Vitamin E.
Chlorierung ↑
Schauen wir und die Halogenierung eines Alkans am Beispiel der Chlorierung näher an:
Startreaktion:
Zunächst wird das Chlor-Molekül Cl••Cl durch Energie (Licht, hohe Temperatur) homolytisch in zwei Chlor-Radikale Cl• gespalten.
Cl••Cl → 2 Cl•
Erster Kettenfortpflanzungsschritt
Jedes Chlor-Radikal abstrahiert dann ein H-Atom aus dem Alkan R••H, es bilden sich das Endprodukt Chlorwasserstoff Cl••H und das Zwischenprodukt R•, ein Alkyl-Radikal.
Cl• + H••R →Cl••H + •R
Zweiter Kettenfortpflanzungsschritt
Dieses Alkyl-Radikal abstrahiert im nächsten Schritt ein Chlor-Atom Cl• aus einem Chlor-Molekül Cl••Cl, es bildet sich als Endprodukt das Chlor-Alkan R••Cl sowie ein neues Chlor-Radikal.
R• + Cl••Cl → R••Cl + •Cl
Dieses kann dann wieder mit einem Alkan-Molekül reagieren und so weiter. Insgesamt spricht man hier von einer Kettenreaktion.
Kettenabbruch
Ein einziges Chlor-Radikal kann eine ganze Reaktionskette starten, in der Tausende von Alkan-Molekülen chloriert werden. Irgendwann stoßen aber einmal zwei Radikale zusammen. Entweder zwei Chlor-Radikale, oder ein Chlor-Radikal mit einem Alkyl-Radikal, oder auch zwei Alkyl-Radikale.
Cl• + •Cl → Cl••Cl
Cl• + •R → Cl••R
R• + •R → R••R
Dann kommt die Kette zu einem Abbruch, weil bei diesen Reaktionen keine neuen Radikale entstehen, welche die Kette fortführen könnten. Solche Reaktionen werden dann als Abbruchreaktionen bezeichnet.
Fluorierung und Bromierung ↑
Fluor ist zwar noch reaktiver als Chlor, eignet sich aber für Synthesen eben wegen dieser hohen Reaktivität nicht so gut, da es unkontrolliert mit dem Alkan zu allen möglichen Fluor-Alkanen reagiert. Auch ist die Handhabung von Fluor sehr gefährlich und wegen der erforderlichen Sicherheitsmaßnahmen sehr teuer, also insgesamt recht unwirtschaftlich.
Brom kann zwar ebenfalls für eine Halogenierung von Alkanen eingesetzt werden, aber erstens ist Brom relativ teuer und zweitens verläuft die Reaktion nicht so schnell wie bei der Chlorierung. Die Bromierung ist aber eine gute Labor-Reaktion, vor allem, wenn man ein ganz bestimmtes Halogenalkan ohne viele Nebenprodukte herstellen möchte.
In der Industrie wird vor allem die Chlorierung häufig eingesetzt, weil Chlor leicht und preiswert zu gewinnen ist (aus Kochsalz NaCl durch Elektrolyse). Chlor ist nicht so reaktiv wie Fluor, kann also besser kontrolliert werden. Andererseits ist es reaktiver als Brom, so dass die Reaktionen auch bei niedrigen Temperaturen in vernünftiger Geschwindigkeit ablaufen. Bei den gestiegenen Energiekosten heute ist das ein enormer wirtschaftlicher Vorteil.
Weiterführende Seiten ⇑
Auf der Homepage www.u-helmich.de, auf der Sie sich gerade befinden, gibt es viele weiterführende Seiten zum Thema Alkane.
Diese Seiten wurden für Schüler(innen) der Sekundarstufe II geschrieben und behandeln sowohl die Nomenklatur, die Eigenschaften und die Reaktionen der Alkane recht ausführlich.
Diese Seiten wurden für Studienanfänger(innen) des Faches Chemie erstellt, sie behandeln ebenfalls die Nomenklatur, die Eigenschaften und die Reaktionen der Alkane, aber wesentlich ausführlicher als die Seiten für Schüler(innen), und auch ausführlicher als diese Seite für angehende Mediziner, auf der Sie sich gerade befinden.
Diese Seiten wurden für Schüler(innen) der Qualifikationsphase zur Abiturvorbereitung geschrieben und behandeln den Reaktionsmechanismus der Radikalischen Substitution genauer als jedes Schulbuch.
Diese Seiten wurden für Studienanfänger(innen) des Faches Chemie erstellt und behandeln den Reaktionsmechanismus der Radikalischen Substitution wesentlich genauer die Seiten für die Qualifikationsstufe und das Chemie-Abitur.
Quellen, die über die übliche Fachliteratur hinausgehen:
- Kirkamm: "Obstipation und methanbildende Darmbakterien" auf der Webseite von Dr. med. Ralf Kirkamm.
- Abschnitt "Gefahren" im Wikipedia-Artikel "Ethan".
- "Butan" im PharmaWiki
- Elsner: "Todesfälle bei Rauscherleben durch Butangasinhalation" auf Thieme-Connect.de
- Lánczos: "Über die Wirkung des Paraffinöls auf den Darm" auf SpringerLink.
Seitenanfang -
Weiter mit den Alkenen...