Synthese
Phenolphthalein ist ein wichtiger Triphenylmethan-Farbstoff, der leicht im Chemieunterricht hergestellt werden kann, aber aus Sicherheitsgründen vielleicht doch lieber nicht. Der Grundstoff Phenol ist zu gefährlich.
Zur Synthese von Phenolphthalein werden ungefähr gleich große Mengen Phthalsäureanhydrid (oder Phthalsäure) und Phenol (sehr giftig) mit ein paar Tropfen konz. Schwefelsäure in einem Reagenzglas gemischt und vorsichtig zum Schmelzen gebracht. Die Schmelze wird dann in ein großes Becherglas mit Wasser gegossen. Gibt man nun starke Natronlauge dazu, bildet sich die typische violette Färbung des alkalischen Phenolphthaleins. Chemisch gesehen handelt es sich bei der Synthese von Phenolphthalein um eine Friedel-Crafts-Acylierung.
Synthese von Phenolphthalein
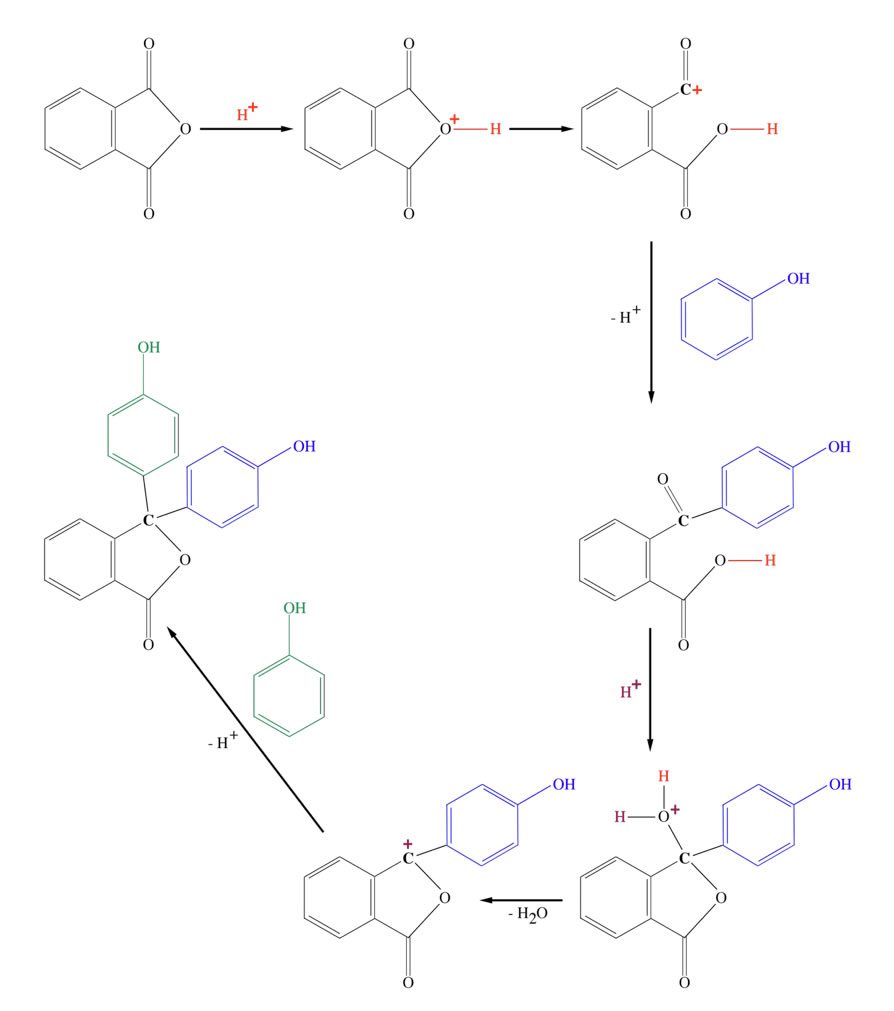
Die Synthese von Phenolphthalein komplett
Die Synthese von Phenolphthalein erfolgt im Prinzip genau so wie die von Fluorescein, nur dass man Phenol statt Resorcin als Edukt einsetzt. Das im Bild gezeigte Endprodukt ist farblos, da - ähnlich wie bei der Lactonform des Fluoresceins - das zentrale C-Atom sp3-hybridisiert vorliegt.
Farbigkeit
Phenolphthalein ist ein bekannter Indikator. Im sauren und neutralen Bereich ist er farblos, im alkalischen Bereich nimmt er einen rotvioletten Farbton an. Der Umschlagbereich liegt bei einem pH-Wert von knapp über 8 (ca. 8,2). Daher ist er gut geeignet für die Titration von schwachen Säuren mit starken Laugen, weil hier der Äquivalenzpunkt ebenfalls im alkalischen Bereich liegt.
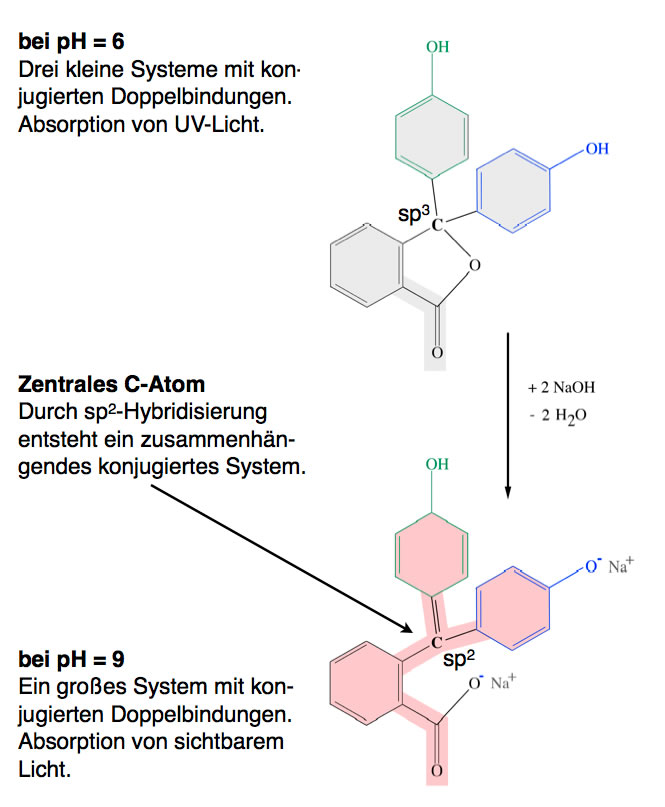
Durch Abspaltung von Protonen im alkalischen Milieu wird das Zentralatom sp2-hybridisiert
Wie man leicht sehen kann, spielt hier das zentrale C-Atom eine wichtige Rolle. Bei einem pH-Wert kleiner als 8 ist dieses C-Atom sp3-hybridisiert, es stellt also kein pz-Orbital zur Verfügung.
Bei der Zugabe von Hydroxid-Ionen gibt das Phenolphthalein-Molekül Protonen ab, was sich auf die Struktur des Moleküls auswirkt, wie man im unteren Teil des Bildes sieht. Das zentrale C-Atom bildet eine Doppelbindung zu dem einen Phenolring aus, dadurch wird das zentrale C-Atom sp2-hybridisiert und stellt ein zusätzliches pz-Orbital zur Verfügung. Dieses pz-Orbital verbindet nun die drei Benzol- bzw. Phenolringe miteinander, die pi-Elektronen dieser Ringe können sich im gesamten rot markierten Bereich des Phenolphthaleins frei ausbreiten, sie sind über das gesamte große System delokalisiert.
Dadurch wird der Abstand zwischen dem höchsten mit Elektronen besetzten Molekülorbital (HOMO) und dem niedrigsten im Grundzustand nicht besetzten Molekülorbital (LUMO) sehr viel kleiner als bei einem pH-Wert unterhalb von 8. Jetzt reicht bereits energiearmes grünes Licht aus, um den HOMO->LUMO-Transfer zu bewerkstelligen. Das Phenolphthalein erscheint dem menschlichen Auge daher rotviolett.
Phenolphthalein kann noch viel mehr…
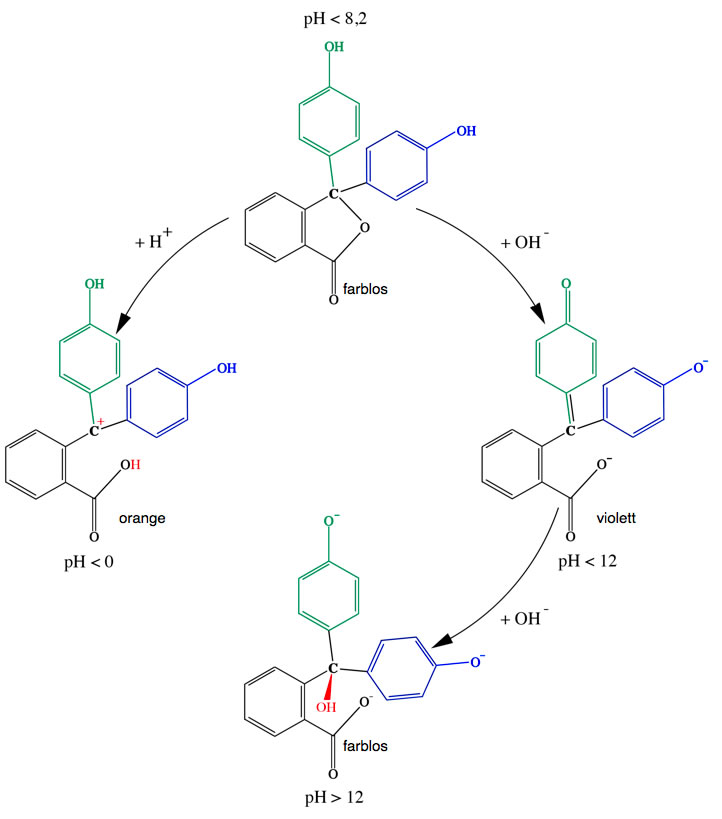
Die vier Farbstufen des Phenolphthaleins
Im normalen Chemieunterricht begegnet einem das Phenolphthalein als Indikator, der entweder farblos oder rotviolett ist. Bei extrem niedrigen pH-Werten kleiner als 0 ist das Phenolphthalein jedoch orange, das habe ich selbst in einem Schülerversuch von meinem Chemiekurs herausfinden lassen. Dazu gibt man in ein Reagenzglas zunächst 10 ml Wasser, dann ein paar Tropfen Phenolphthalein-Lösung. Natürlich passiert jetzt noch nichts. Wenn man dann aber die gleiche Menge konzentrierte Schwefelsäure vorsichtig in das Reagenzglas gibt, wird die Lösung recht schnell hell-orange. Auch mit konz. Salzsäure gelingt dieser Versuch ganz gut.
Das Phenolphthalein-Molekül nimmt ein Proton von der Säure auf, das Proton setzt sich an das O-Atom des 5er-Rings, der daraufhin aufgebrochen wird - all das ist aber recht uninteressant. Viel wichtiger ist, dass sich die positive Ladung, die das Proton mitbringt, an das zentrale C-Atom "setzt", welches daraufhin zu einem sp2-hybridisierten Carbenium-Ion wird. Die pi-Elektronen der drei Ringe werden "vereinigt", und der HOMO-LUMO-Abstand wird wieder so klein, dass sichtbares Licht absorbiert wird.
Das andere Extrem: Wenn man eine hochkonzentrierte Natronlauge herstellt (einfach vier oder fünf NaOH-Plätzchen in 20 oder 30 ml Wasser auflösen) und dann ein paar Tropfen Phenolphthalein-Lösung dazugibt, wird die Lösung zunächst rotviolett, wie man es kennt. Schüttelt man dann aber das Reagenzglas für einige Zeit, so dass sich noch mehr festes NaOH auflöst, verschwindet die Violettfärbung, und der Reagenzglas-Inhalt wird wieder farblos.
Der Grund hierfür wird aus der Abbildung 2 ersichtlich. An das zentrale C-Atom setzt sich jetzt eine OH-Gruppe, das C-Atom wird wieder vierbindig/tetraedrisch und damit sp3-hybridisiert, was die freie Beweglichkeit der vielen pi-Elektronen unterbindet. Wir haben jetzt wieder einen ähnlichen Zustand wie bei einem pH-Wert unterhalb von 8.

Die vier Farbstufen des Phenolphthaleins im Versuch
Hier ein Photo von vier Reagenzgläsern mit 50%iger Schwefelsäure, Wasser, verd. Natronlauge und konz. Natronlauge. Die Flüssigkeiten wurden jeweils mit 10 Tropfen alkoholischer Phenolphthalein-Lösung versetzt.
Ein sehr schönes Video zum Verhalten von Phenolphthalein bei verschiedenen pH-Werten findet man auf YouTube. Wer die spanische Sprache nicht beherrscht, sollte vielleicht die englischen Untertitel dazuschalten.