Die Carboxygruppe ist sauer
Eine Carboxygruppe besitzt ein H-Atom, das leicht als Proton H+ abgegeben werden kann. Allerdings muss dazu eine Base :B- in der Umgebung vorhanden sein. Nur eine Base ist in der Lage, das abgegebene Proton aufzunehmen, dabei entsteht dann die Säure H:B wie die folgende Abbildung zeigt:
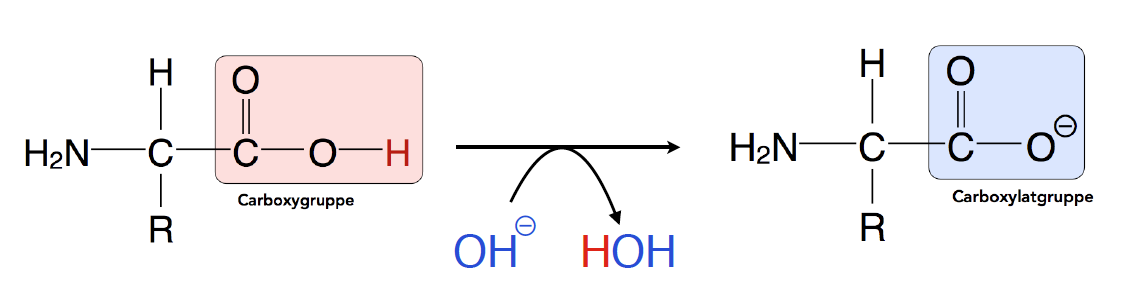
Die Carboxylgruppe kann ein Proton an ein Hydroxid-Ion :OH- abgeben
Autor: Ulrich Helmich, Lizenz: Public domain.
In einer wässrigen Lösung, wie sie zum Beispiel im Cytoplasma vorliegt, sind Hydroxid-Ionen :OH- die wohl häufigsten Basen. Wenn die Carboxygruppe einer Aminosäure ihr Proton an ein solches Hydroxid-Ion abgibt, entsteht ein Wasser-Molekül.
Wasser ist eine der stabilsten chemischen Verbindungen überhaupt. Wenn bei einer chemischen Reaktion Wasser gebildet werden kann, ist dies eine starke Triebkraft für die Reaktion. Bei vielen biochemischen Reaktionen wird in der Tat Wasser freigesetzt, man denke nur an die Bildung von Disacchariden aus zwei Monosacchariden oder an die Bildung von Dipeptiden aus zwei Aminosäuren.
Aus diesem Grund liegt die Carboxygruppe einer Aminosäure unter normalen (neutralen) Bedingungen in der Regel protonenlos vor, also als COO--Gruppe (Carboxylatgruppe).
Asparaginsäure und Glutaminsäure besitzen sogar zwei COOH-Gruppen. Nämlich einmal die "übliche", wie alle Aminosäuren sie im Grundgerüst haben, und dann noch eine zusätzliche in der Seitenkette bzw. im Rest. Diese sauren Aminosäuren können damit theoretisch sogar zwei Protonen an das umgebende Medium abgeben.
Die Aminogruppe ist basisch
Eine Aminogruppe besitzt ein Stickstoff-Atom, das wegen der hohen Elektronegativität und wegen des freien Elektronenpaars leicht das Proton H+ einer Säure H:B aufnehmen kann. Damit hat die Aminogruppe die Eigenschaften einer Base!
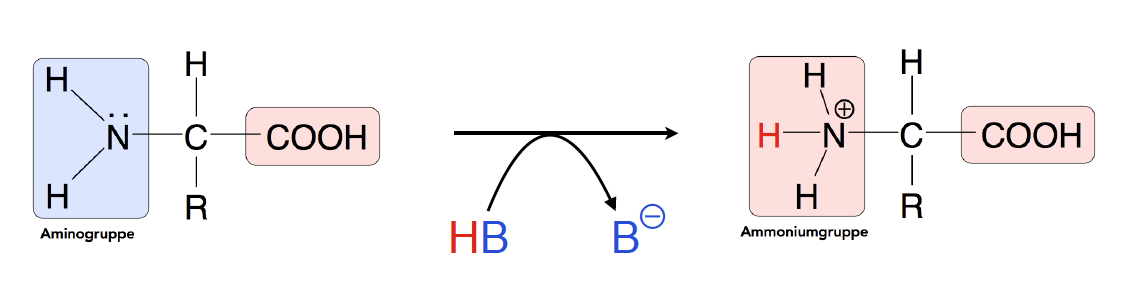
Die Aminogruppe kann ein Proton aufnehmen
Autor: Ulrich Helmich, Lizenz: Public domain.
Es gibt zwei Aminosäuren, die neben der "üblichen" Aminogruppe eine weitere Aminogruppe in der Seitenkette haben: Arginin ist stark basisch, Lysin ist etwas weniger stark basisch.
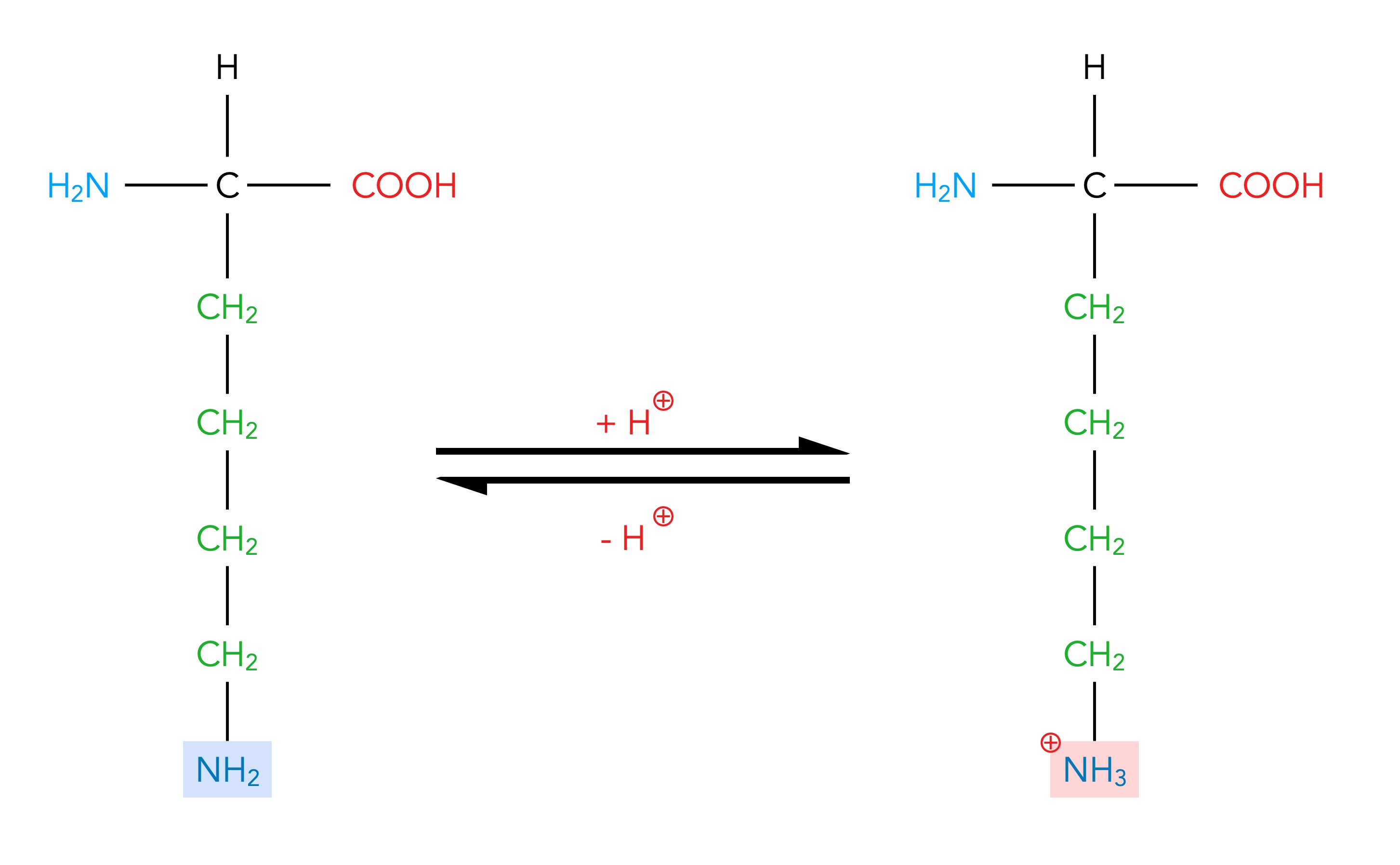
Protonenaufnahme einer basischen Aminosäure
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Hier sieht man, wie die Aminogruppe NH2 in der Seitenkette der basischen Aminosäure Arginin ein Proton aufnimmt (und wieder abgeben kann).
Aminosäuren als Zwitter-Ionen
Da eine Aminosäure sowohl eine saure Carboxylgruppe wie auch eine basische Aminogruppe besitzt, kann sie gleichzeitig positiv und negativ geladen sein.
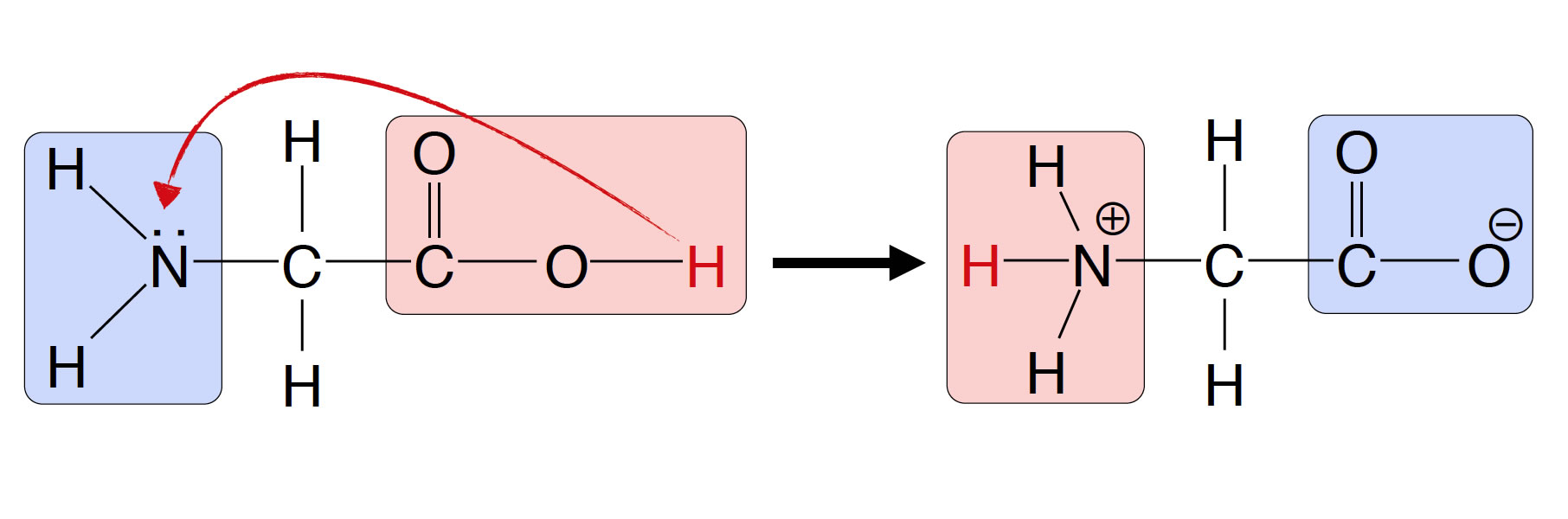
Ein Zwitterion ist gleichzeitig positiv und negativ
Autor: Ulrich Helmich, Lizenz: Public domain.
Zwitter-Ionen
Als Zwitter-Ionen bezeichnet man organische Ionen, die an einer Stelle positiv geladen sind, und an einer anderen Stelle negativ. Nach außen hin sind Zwitter-Ionen elektrisch neutral.
Die pH-Abhängigkeit der Ladung einer Aminosäure
Eine Aminosäure kann je nach pH-Wert des Lösemittels positiv oder negativ geladen sein oder als Zwitterion vorliegen. Betrachten wir dazu die folgende Abbildung:
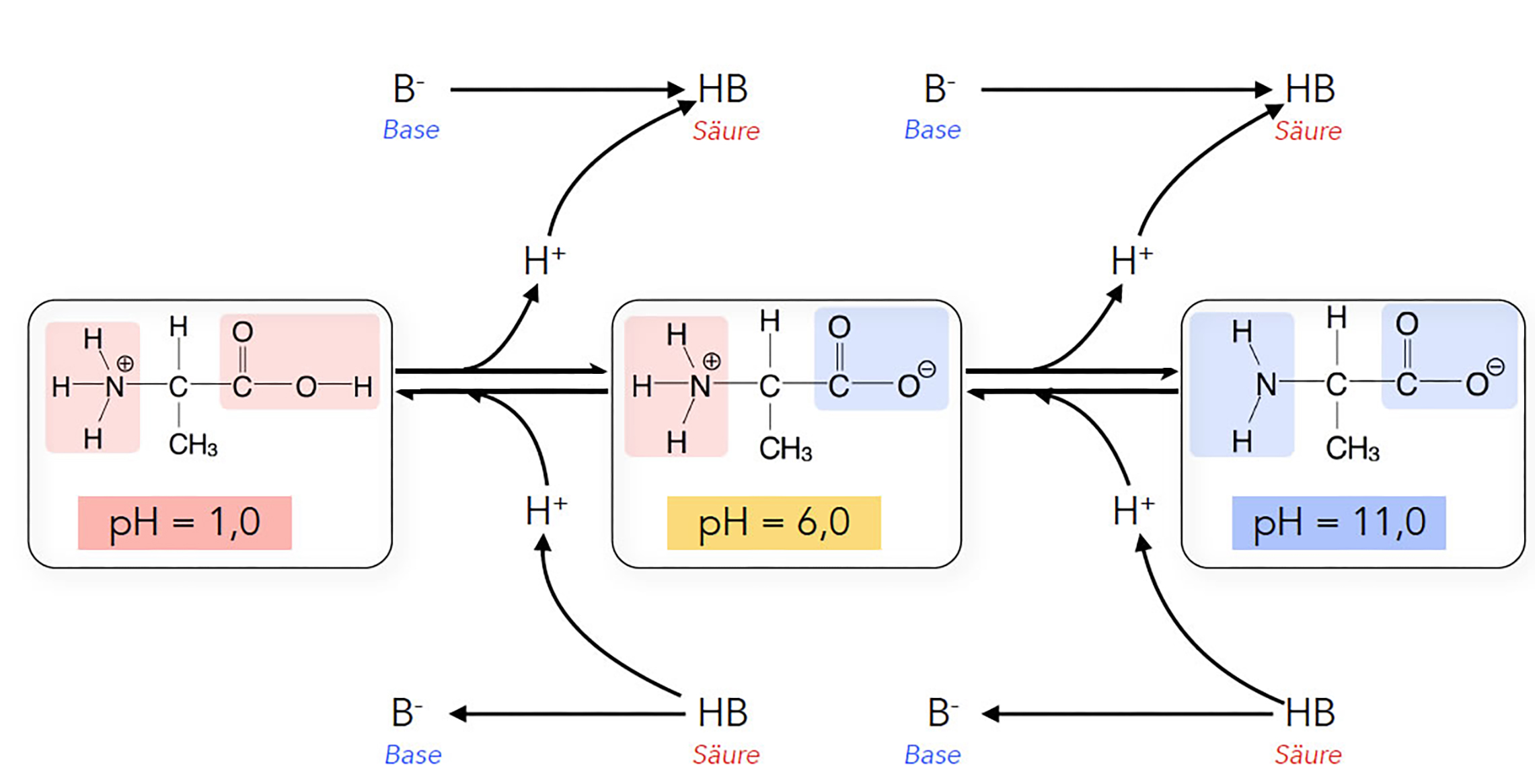
Die pH-Abhängigkeit der Ladung einer Aminosäure
Autor: Ulrich Helmich, Lizenz: Public domain
pH = 1, stark sauer
Hier liegen Protonen im Überschuss vor, in der Lösung befinden sich viel mehr Protonen als Hydroxid-Ionen. Die Wahrscheinlichkeit, dass sich daher ein Proton an das freie Elektronenpaar einer Aminogruppe setzt, ist sehr hoch. Die Aminogruppen der Aminosäuren werden daher zum allergrößten Teil als NH3+-Gruppe vorliegen, die Aminosäure ist dann positiv geladen und gut wasserlöslich.
Die Carboxygruppen der Aminosäuren geben vielleicht mal ein Proton ab, aber wegen des hohen Protonenüberschusses in dem Medium ist die Wahrscheinlichkeit hoch, dass sich sofort wieder ein Proton an die negativ geladene COO--Gruppe setzt, so dass diese wieder zur neutralen COOH-Gruppe wird. Eine negative Ladung an der Carboxygruppe ist bei einem derart sauren pH-Wert also höchst unwahrscheinlich.
pH = 6, schwach sauer bis neutral
Die Aminosäure wird hier wahrscheinlich als Zwitterion vorliegen. Die Zahl der Protonen in dem Lösemittel beträgt 10-6 mol/l, während sie bei pH=1 mit 10-1 mol/l 100.000 mal höher war.
Chemie-Nachhilfe: der pH-Wert
Der pH-Wert ist der negative dekadische Logarithmus der Protonenkonzentration einer wässrigen Lösung. Eine Lösung mit einer Protonenkonzentration von 10-4 mol/l hat demnach einen pH-Wert von 4,0. Umgekehrt ist die Protonenkonzentration c(H+) in einer Lösung mit dem pH-Wert 6 = 10-6 mol/l.
Wenn die Protonenkonzentration der Lösung steigt, nimmt der pH-Wert ab. Bei einem pH-Wert von 3 herrscht mit 10-3 mol/l eine zehnmal höhere Protonenkonzentration als bei einem pH-Wert von 4 mit 10-4 mol/l.
Es sind aber immer noch genug Protonen im Lösemittel, so dass sie die NH2-Gruppe besetzen können. Diese liegt bei diesem pH-Wert also immer noch als NH3+-Gruppe vor.
Die Konzentration der Hydroxid-Ionen liegt bei dem pH-Wert von 6 bei 10-8 mol/l.
Chemie-Nachhilfe: Zusammenhang zwischen c(H+) und c(OH-)
Das Produkt der Konzentrationen der Protonen und der Hydroxid-Ionen in einer wässrigen Lösung hat bei Zimmertemperatur stets den Wert 10-14 mol2/l2. Diesen Wert bezeichnet man auch als Ionenprodukt des Wassers.
Die biologische Konsequenz aus dieser Gesetzmäßigkeit ist die folgende: Wenn die Konzentration der Protonen sinkt, steigt automatisch die Konzentration der Hydroxid-Ionen. Bei c(H+) = 10-7 mol/l ist auch c(OH-) = 10-7 mol/l. Sinkt aber c(H+) auf 10-8 mol/l, dann steigt c(OH-) auf 10-6 mol/l. Denn das Produkt aus den beiden Konzentration muss immer 10-14 ergeben.
Es sind also noch genug OH--Ionen in der Lösung, so dass die COOH-Gruppen der Aminosäure ein Proton an diese Base abgeben können. Die COOH-Gruppe liegt also auch mit hoher Wahrscheinlichkeit als negativ geladene COO--Gruppe vor.
Die Aminogruppe ist positiv geladen, die Carboxygruppe negativ, ein solches Ion bezeichnet man als Zwitterion. Die Wasserlöslichkeit von Zwitterionen ist sehr gering, da die Zwitterionen nach außen hin elektrisch neutral sind (plus und minus heben sich auf). Auch Aminosäuren mit intakter NH2- und COOH-Gruppe sind nur schlecht wasserlöslich, auch sie sind ja nach außen hin elektrisch neutral.
Der Begriff "Zwitterion" ist sogar in englischsprachigen Fachbüchern gebräuchlich, zum Beispiel im Lehninger.
Aufgabe
Erläutern Sie, was mit einem Zwitterion passiert, wenn der pH-Wert von 6 auf 4 sinkt.
Mögliche Lösung:
Die Protonenkonzentration c(H+) nimmt wieder stark zu, sie steigt auf das Hundertfache, nämlich von 10-6 auf 10-4 mol/l. Die NH3+-Gruppen der Aminosäuren behalten also ihr Proton. Die COO--Gruppen dagegen nehmen mit höherer Wahrscheinlichkeit wieder ein Proton auf und werden zu neutralen COOH-Gruppen.
Die Aminosäuren liegen also nicht mehr als Zwitterionen vor, sondern als Kationen, also als positiv geladene Ionen.
Schön, dass wir diese Aufgabe schon gelöst haben. Aber so richtig verstanden haben Sie diese komplexen Zusammenhänge erst dann, wenn Sie auch die nächste Aufgabe lösen können (erst selbst lösen, dann mit der möglichen Lösung vergleichen):
Aufgabe
Erläutern Sie, was mit einem Zwitterion passiert, wenn der pH-Wert von 6 auf 8 steigt.
Mögliche Lösung:
Die Protonenkonzentration c(H+) nimmt jetzt stark ab, sie sinkt um das Hundertfache, nämlich von 10-6 auf 10-8 mol/l. Gleichzeitig steigt die Konzentration der Hydroxid-Ionen von 10-8 auf 10-6, also auf den hundertfachen Wert (siehe Chemie-Nachhilfe im Kasten oben).
Da jetzt hundert mal mehr Basen (die OH--Ionen) in der Lösung vorliegen, werden die NH3+-Gruppen der Aminosäuren ein H-Atom als Proton an die Basen abgeben, aus den OH--Ionen entstehen H2O-Moleküle, und aus den NH3+-Gruppen der Aminosäuren werden wieder neutrale NH2-Gruppen.
Die COO--Gruppen der Aminosäuren dagegen behalten ihre negative Ladung, da kaum noch Protonen in der Lösung sind, die sich an die negativen Carboxylatgruppen setzen könnten.
Die Aminosäuren liegen also nicht mehr als Zwitterionen vor, sondern als Anionen, also als negativ geladene Ionen.
Die elektrische Ladung einer Aminosäuren hängt also ganz stark vom pH-Wert des umgebenden Mediums ab. Nur bei einem ganz bestimmten pH-Wert liegt die Aminosäure als Zwitterion vor. Diesen pH-Wert bezeichnet man als isoelektrischen Punkt.
Isoelektrischer Punkt
Der isoelektrische Punkt ist ein pH-Wert, und zwar der pH-Wert, an dem eine Aminosäure als Zwitterion vorliegt.
Wird die Lösung saurer (pH-Wert sinkt unter den isoelektrischen Punkt), dann nehmen die COO--Gruppen Protonen auf und werden neutral. Wird die Lösung basischer (pH-Werst steigt über den isoelektrischen Punkt), dann geben die NH3+-Gruppen ihr Proton an die gelösten OH--Ionen ab.
Aufgabe für Profis
Beschreiben Sie das folgende Schema und begründen Sie die Veränderungen, die man erkennen kann:
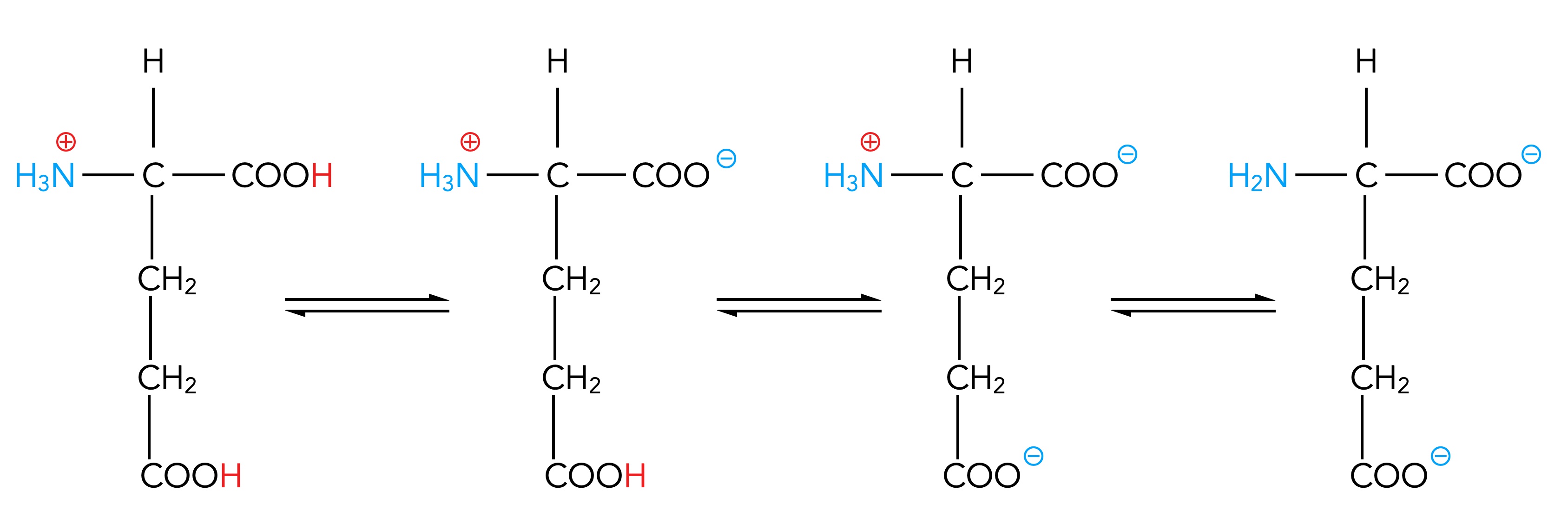
Mögliche Antwort
Hier sieht man den elektrischen Zustand der sauren Aminosäure Glutaminsäure in Abhängigkeit vom pH-Wert.
Ganz links sind beide Carboxygruppen protoniert und auch die Aminogruppe hat ein Proton aufgenommen. Die Protonenkonzentration im umgebenden Medium ist hier also offensichtlich sehr hoch, der pH-Wert entsprechend niedrig, vielleicht 1 oder 2.
Wenn der pH-Wert ansteigt und die Protonenkonzentration sinkt, gibt der COOH-Gruppe des Aminosäuren-Grundgerüstes zuerst ihr H-Atom als Proton ab. Die COOH-Gruppe in der Seitenkette von Glutaminsäure behält zunächst ihr Proton. Die Aminosäure liegt nun als Zwitterion vor.
Zusatzbemerkung eines Chemie-Profis: Offensichtlich ist die Carboxygruppe des Grundgerüstes stärker sauer als die COOH-Gruppe in der Seitenkette und gibt daher ihr Proton schon eher ab.
Steigt der pH-Wert noch mehr an, gibt auch die COOH-Gruppe der Seitenkette ihr Proton ab. Die Aminosäure ist nun einfach negativ geladen.
Wenn der pH-Wert nun noch einmal ansteigt und kaum noch Protonen in der Lösung vorliegen, gibt schließlich auch die NH3+-Gruppe ihr Proton ab. Die Aminosäure ist jetzt zweifach negativ geladen.
Seitenanfang -
Weiter mit Peptiden...