Änderungen des pH-Wertes
Trypsin ist ein Enzym des Dünndarms, das bei einem pH-Wert zwischen 8 und 9 am besten arbeitet [1], also im alkalischen Bereich. Bei einem pH-Wert von 1 bis 4 arbeitet Trypsin nicht mehr optimal, ebenso bei einem zu alkalischen pH-Wert von 12 oder 13. Man kann also sagen, dass Trypsin ein pH-Optimum im Bereich 8 bis 9 hat.
Pepsin dagegen ist ein Enzym des Magens, das sein pH-Optimum im Bereich zwischen 1 und 4 hat, also im schon stark sauren Bereich [2]. Bei einem pH-Wert von 6 oder höher stellt das Enzym seine Funktion ein.
Beide Enzyme sind also in ihrer Aktivität pH-abhängig. Wie kann man dieses Phänomen erklären?
Enzyme sind nichts anderes als Proteine mit katalytischen Fähigkeiten, also Proteine, die bestimmte Stoffwechselreaktionen beschleunigen. Ein Enzym hat eine bestimmte Region, das so genannte aktive Zentrum. In dieses aktive Zentrum setzt sich nun nach dem Schlüssel-Schloss-Prinzip ein bestimmtes Substrat, das von dem Enzym verarbeitet werden soll. Trypsin und Pepsin beispielsweise zerlegen Proteine in kleinere Peptide.
Wenn sich nun das aktive Zentrum aus irgendeinem Grund strukturell verändert, dann passt das Substrat nicht mehr perfekt in das aktive Zentrum, und das Enzym arbeitet nicht mehr zu 100%. Wenn das aktive Zentrum stark verändert wurde, kann es sogar sein, dass das Substrat nicht mehr in das aktive Zentrum hineinpasst, es wird dann überhaupt nicht mehr verarbeitet.
Fallbeispiel: Zugabe einer Säure
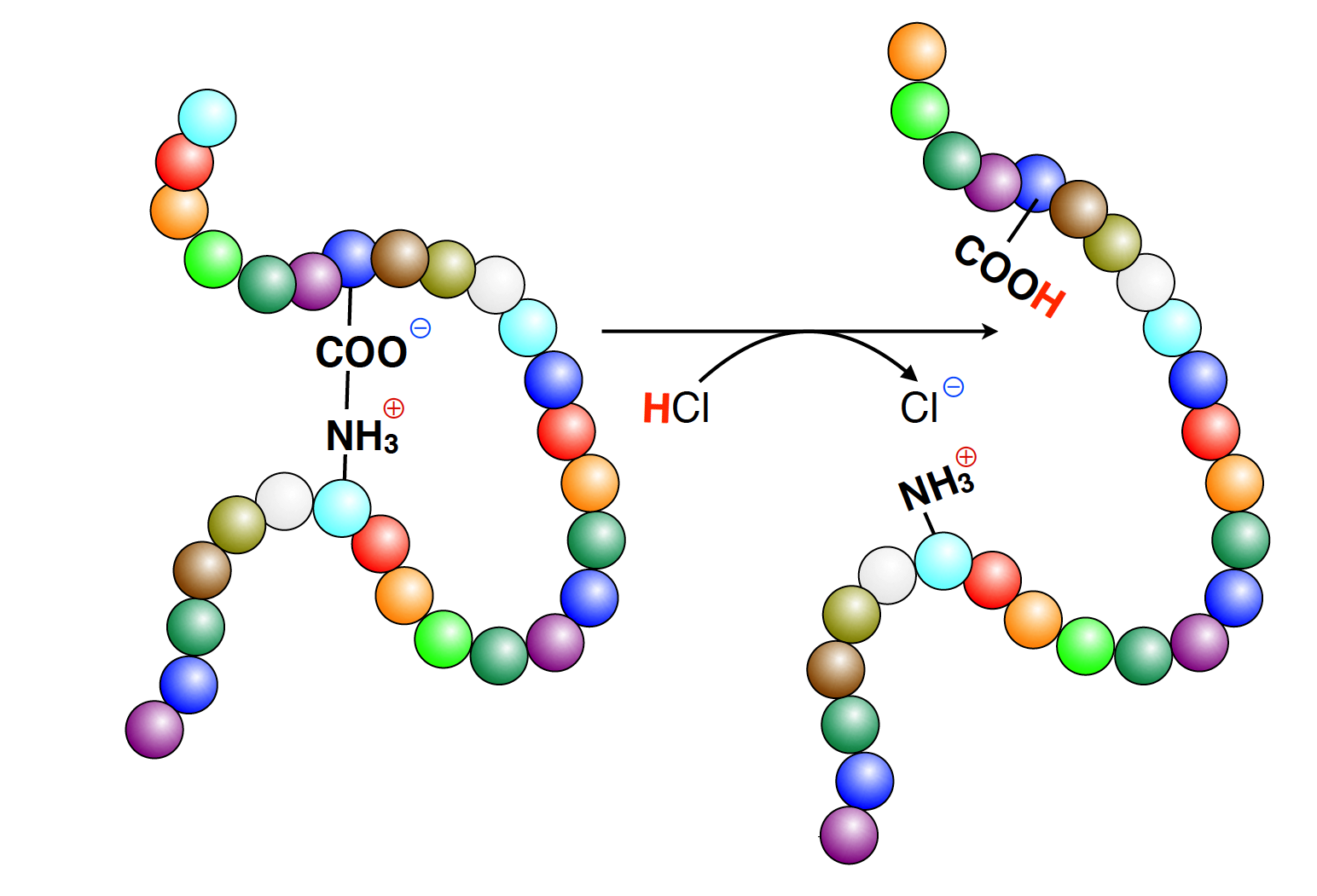
Veränderung der Tertiärstruktur durch Zugabe einer Säure
Autor: Ulrich Helmich, Lizenz: Public domain
Das Bild oben hat natürlich nur Modellcharakter; richtige Enzyme sind wesentlich komplexer aufgebaut als das kleine Peptid in der Abbildung. Links sehen wir das "Enzym" in seiner arbeitsfähigen Version. Die Tertiärstruktur des Peptids wird durch eine elektrostatische Bindung zusammengehalten.
Nun geben wir eine Säure wie HCl (Salzsäure) in das Medium, in dem sich das Enzym befindet. Zugabe einer Säure heißt immer: Erhöhung der Protonenkonzentration.
Die negativ geladene Carboxylatgruppe kann jetzt ein Proton von der zugefügten Säure aufnehmen und verliert damit ihre negative Ladung. Nun fehlt der positiven Ladung der Aminogruppe der negativ geladene Partner. Die elektrostatische Bindung löst sich auf, und das Protein verändert seine Tertiärstruktur.
Diese Veränderung kann sich auch auf die Struktur des aktiven Zentrums eines Enzyms auswirken, so dass das Substrat nicht mehr nach dem Schlüssel-Schloss-Prinzip hineinpasst. Die Enzymaktivität geht stark zurück oder sinkt sogar auf den Wert Null.
Zugabe einer Lauge
Wenn wir eine Lauge wie NaOH (Natronlauge) zu unserer Lösung mit dem Enzym geben, passiert im Prinzip das Gleiche wie bei der Zugabe einer Säure. Auch hier ändert sich die Tertiärstruktur des Enzyms und das Enzym kann nicht mehr korrekt arbeiten.
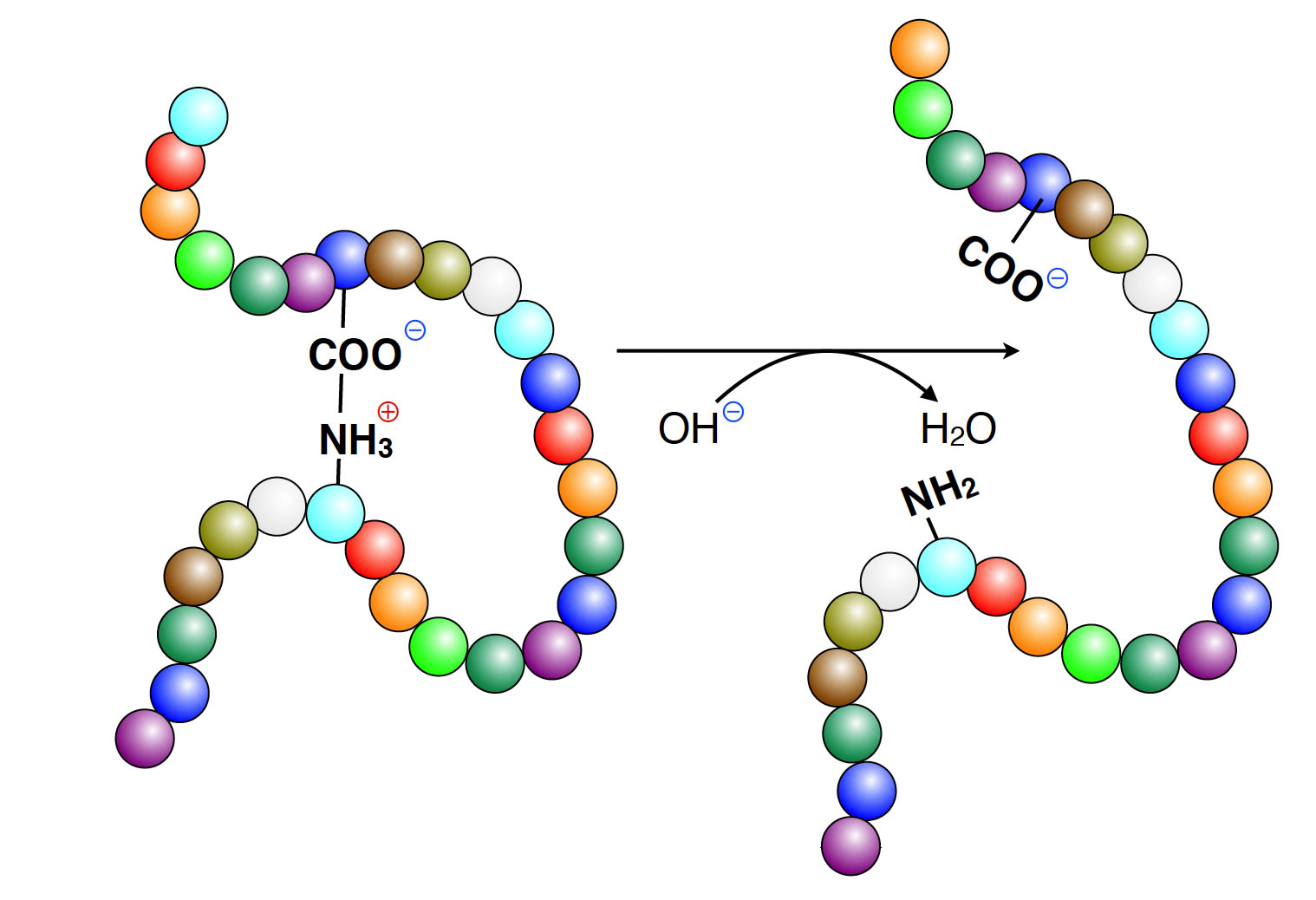
Zugabe einer Lauge zu einem Enzym
Autor: Ulrich Helmich, Lizenz: Public domain
Die Natronlauge enthält Hydroxid-Ionen OH-. Diese Hydroxid-Ionen haben nun eine starke Neigung, sich mit den Protonen des Mediums zu Wasser-Molekülen zu verbinden, sie erniedrigen also die Protonenkonzentration in dem Medium, in dem sich das Enzym befindet. Dies wirkt sich auf die positiv geladenen NH3+-Seitenketten der basischen Aminosäuren wie Arginin oder Lysin aus, diese geben ein Proton an das Medium ab (oder direkt an ein OH--Ion) werden aus den NH3+-Gruppen der Seitenketten werden elektrisch neutrale NH2-Gruppen.
Den negativ geladenen COO--Gruppen der sauren Aminosäuren fehlt nun der positive Bindungspartner, und die Tertiärstruktur wird nicht mehr an dieser Stelle zusammengehalten. Das kann sich auch auf das aktive Zentrum des Enzyms auswirken, so dass das Schlüssel-Schloss-Prinzip nicht mehr greift. Die Aktivität des Enzyms sinkt.
Änderungen der Temperatur
Erniedrigt man die Temperatur, so sinkt die Aktivität eines Enzyms gemäß der RGT-Regel. Diese Reaktionsgeschwindigkeits-Temperatur-Regel besagt, dass sich die Geschwindigkeit einer chemischen Reaktion um das Doppelt erhöht, wenn sich die Temperatur um 10 Grad Celsius erhöht. Das ist natürlich nur eine grobe Faustregel, kann aber fast immer auf biochemische Reaktionen angewandt werden. Diese RGT-Regel gilt natürlich auch dann, wenn man die Temperatur absenkt. Vermindert man die Temperatur um 10 Grad Celsius, so halbiert sich die Reaktionsgeschwindigkeit entsprechend.
Die Tertiärstruktur eines Enzyms ändert sich allerdings nicht, wenn man die Temperatur absenkt, die verringerte Enzymaktivität ist einzig und allein auf die RGT-Regel zurück zu führen.
Wenn man die Temperatur erhöht, greift zunächst auch die RGT-Regel. Die Enzymaktivität erhöht sich. Das geht aber nur bis zu einem bestimmten Punkt. Irgendwann ist es so warm, dass das Enzym instabil wird. Die Atome im Enzym beginnen immer stärker zu schwingen, und irgendwann brechen die Bindungen innerhalb des Proteins auf. Zunächst die schwachen chemischen Bindungen wie hydrophobe Wechselwirkungen, van-der-Waals-Bindungen und so weiter. Bei höheren Temperaturen werden auch die Wasserstoffbrücken-Bindungen instabil. All diese Veränderungen sind aber reversibel. Das heißt, bei einer Absenkung der Temperatur bilden sich diese Bindungen vollständig zurück.
Wird die Temperatur noch weiter erhöht, lösen sich schließlich auch die starken kovalenten Disulfid-Brücken auf. Auch diese Spaltung ist im Prinzip reversibel, das heißt, bei Temperaturabsenkung können sich neue Disulfidbrücken bilden. Dazu muss das Umgebungsmedium allerdings oxidierende Bedingungen zur Verfügung stellen, denn zur Bildung einer Disulfidbrücke muss bekanntlich Wasserstoff entfernt werden.
Eine solche Hitze-Denaturierung ist ein alltäglicher Vorgang, den man gut beobachten kann, wenn man ein Hühnerei in die Pfanne schlägt. Das klare Eiweiß wird sofort trübe und fest.
Reduktions- und Oxidationsmittel
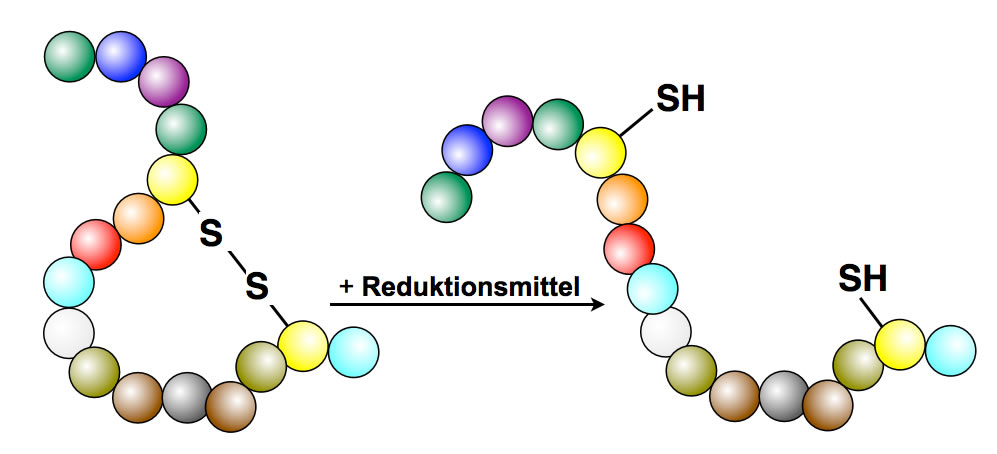
Zugabe eines Reduktionsmittels zu einem Peptid
Autor: Ulrich Helmich, Lizenz: Public domain
Auch durch bestimmte chemische Substanzen können Disulfidbrücken geöffnet werden, wie das Bild oben zeigt. Reduktionsmittel "setzen" wieder H-Atome an die S-S-Brücken, so das wieder -SH HS- Gruppen entstehen, zwischen denen keine Bindung mehr besteht.
Umgekehrt können Oxidationsmittel Wasserstoff aus Cystein-Resten entfernen, die nicht in Disulfidbrücken eingebunden sind. Dann können sich sogar zusätzliche neue Disulfidbrücken bilden (sofern das jeweilige Cystein ein zweites Cystein als Bindungspartner findet).
Disulfid-Brücken und Dauerwellen
Disulfid-Brücken spielen beim Formen der Haare beim Friseur (oder wie sagt man heute - Hairstyler?) eine große Rolle. Die Haare werden zunächst in der gewünschten neuen Form fixiert (Lockenwickler), dann wird ein Reduktionsmittel wie beispielsweise β-Mercaptan oder Thioglycolsäureester dazugegeben [4], so dass sich ca. 25% der Disulfidbrücken in den Strukturproteinen der Haare lösen. Die feuchte Wärme, die während der Behandlung angewandt wird, hilft dabei, sie bricht Wasserstoffbrücken-Bindungen und elektrostatische Anziehungen innerhalb der Proteine auf.
Dann wird das Reduktionsmittel ausgewaschen und ein Oxidationsmittel wie Wasserstoffperoxid oder eine Bromat-Lösung dazugegeben [4]. Es bilden sich neue Disulfidbrücken. Durch diese neuen Disulfid-Brücken bleiben die Haare dann längere Zeit in der neuen Form (Dauerwelle).
Schwermetalle
Schwermetalle bzw. Schwermetall-Ionen (Blei, Quecksilber, Cadmium, Zink) sind bekanntlich bereits in geringen Konzentrationen giftig. Wie kommt das? Schwermetalle hemmen Enzyme irreversibel, das heißt, sie setzen sie auf Dauer außer Kraft. Bereits Schwermetallkonzentrationen von über 10-5 mol/l vermindern die Aktivität der meisten Enzyme, und eine 100fach höhere Konzentration reduziert die Aktivität auf Null [3].
Schwermetalle können auf zwei Arten ein Enzym denaturieren:
- Bindung an Disulfidbrücken
- Bindung an ionische Bindungen
- Verdrängung von Metall-Ionen aus einem Protein
Bindung an Disulfidbrücken
In der analytischen Chemie weist man bestimmte Schwermetall-Ionen mit Hilfe von Schwefelwasserstoff nach. Es bilden sich dann schwerlösliche Metallsulfide, die im Reagenzglas mit einer charakteristischen Farbe ausfallen. Eine ähnliche Reaktion läuft dann im Protein ab, wenn die Schwefel-Atome einer Disulfidbrücke mit einem Schwermetall-Ion reagieren.
Bindung an ionische Bindungen
Schwermetall-Ionen sind grundsätzlich positiv geladen, und an ionischen Bindungen sind negativ geladene COO--Gruppen beteiligt. Bringt man ein Protein mit einer Schwermetall-Lösung zusammen, dann können sich die positiven Kationen des Metalls an diese COO--Gruppen setzen. Die gegenüberliegenden NH3+-Gruppen haben dann keinen Bindungspartner mehr, und die Tertiärstruktur des Proteins verändert sich.
Schwermetall-Ionen können nicht nur an die negativen COO--Gruppen binden, sondern auch an neutrale -OH, -NH2 oder -COOH-Gruppen und diese so blockieren [4].
Verdrängung von Metall-Ionen aus einem Protein
Einige wichtige Proteine enthalten Metall-Ionen in ihrer Mitte. Hämoglobin beispielsweise enthält Eisen-Ionen, Chlorophyll Magnesium-Ionen. Bestimmte Schwermetalle können nun diese Ionen aus dem Protein verdrängen und dieses dadurch unwirksam machen.
Metalle können auch wichtige Funktionen erfüllen
Eisen, Mangan, Molybdän, Kupfer und Zink gelten dagegen als essentielle Metalle, der menschliche Körper benötigt sie als Spurenelemente. Auch diese Metalle binden oft an die SH-Gruppen von Cysteinresten. Dabei werden aber keine Disulfidbrücken zerstört, sondern die Metall-Ionen werden in das Protein eingebunden, wo sie dann eine wichtige Funktion übernehmen.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Lexikon der Biologie, Spektrum-Verlag, Artikel "Pepsin"
- Grafl, Schwantes, Der Einfluss von Cadmium, Zink, Blei und Quecksilber auf die Enzymaktivität bei Saccharomyces cervisiae in vitro. Zeitschrift für Ernährungswissenschaft 22, 205-212 (1983).
- Lexikon der Biologie, Spektrum-Verlag, Artikel "Schwermetalle".
Seitenanfang -
Weiter mit Domänen-Theorie... (noch nicht fertig)