Siedepunkte
Siedepunkt und Kettenlänge
Vergleichen wir einmal die Siedepunkte der ersten vier Alkane mit den Siedepunkt der von diesen Alkanen abgeleiteten Chlor-Alkane.
| n | Alkan | Chlor-Alkan |
|---|---|---|
| 1 | Methan: -161.6 | Chlor-methan: -23,8 |
| 2 | Ethan: -88,6 | Chlor-ethan: 13,1 |
| 3 | Propan: -41,1 | 1-Chlor-propan: 47 |
| 4 | Butan: -0,5 | 1-Chlor-butan: 78 |
Die Siedepunkt der Chlor-Alkane liegen also deutlich höher als die Siedepunkt der entsprechenden Alkane. Extrem ist dies beim Methan. Der Siedepunkt vom Chlor-methan liegt 137,8 Grad über dem Siedepunkt des Methans.
Verständnisfrage
Warum nimmt die Differenz zwischen den Siedepunkten des Chlor-Alkans und dem Alkan mit zunehmender Kettenlänge immer mehr ab?
Erst überlegen - dann weiterlesen!
Antwort: Mit zunehmender Kettenlänge nimmt die Zahl der unpolaren C-C- und C-H-Bindungen zu, und der Einfluss der C-Cl-Bindung wird im Vergleich dazu immer geringer. Im Chlor-methan stellt die C-Cl-Bindung ein Viertel aller kovalenten Bindungen, im Chlor-butan nur noch ein Dreizehntel.
Diese Aussage - je größer die C-Kette, desto geringer der Unterschied in den Siedepunkten, wollen wir an einem weiteren Beispiel überprüfen: Hexan hat einen Siedepunkt von 69 ºC, 1-Chlor-hexan einen Siedepunkt von 135 ºC. Die Differenz beträgt 66 ºC und ist damit noch kleiner als die Differenz zwischen Butan und 1-Chlor-butan.
Siedepunkt und molare Masse
Schauen wir uns nun die folgende Tabelle an:
| Name | molare Masse in g/mol | EN-Differenz bei C-X | Siedepunkt in ºC |
| Ethan | 30,07 | 0,4 | -88,6 |
| Fluor-ethan | 48,06 | -1,5 | -37,1 |
| Chlor-ethan | 64,15 | -0,5 | 13,1 |
| Brom-ethan | 108,97 | -0,3 | 38 |
| Iod-ethan | 155,97 | 0 | 71 |
Die Siedepunkt nehmen vom Ethan zum Iod-ethan immer mehr zu.
Verständnisfrage
Wenn die hohen Siedepunkt der Halogenalkane auf die Polarität der C-X-Bindung zurückzuführen sind, müsste dann nicht der Siedepunkt von Iod-ethan kleiner sein als der von Fluor-ethan?
Erst überlegen - dann weiterlesen!
Offensichtlich ist die Polarität der C-X-Bindung nicht der einzige Faktor, der die Höhe des Siedepunkts bestimmt. Genau so wichtig ist auch die molare Masse der Verbindung. Iod-Atome sind sehr schwer, sie haben eine Atommasse von 126,9 g/mol. Fluor dagegen hat eine Atommasse von lediglich 19 g/mol. Obwohl also die C-I-Bindung völlig unpolar ist (zumindest wenn man die EN-Differenz betrachtet), hat Iod-ethan auf Grund der hohen molaren Masse von 155,97 g/mol einen derart hohen Siedepunkt.
Siedepunkt und schwache Wechselwirkungen
Dass die molare Masse einen erheblichen Einfluss auf den Siedepunkt von Verbindungen hat, haben wir eben gesehen. Betrachten wir jetzt ein weiteres Beispiel.
Verständnisfrage
Fluor-ethan mit seiner molaren Masse von rund 48 g/mol hat einen Siedepunkt von -37,1 ºC. Das Alkan n-Butan hat eine molare Masse von 58 g/mol und einen Siedepunkt -0,5 ºC. Die molaren Massen beider Verbindungen sind in etwa vergleichbar, und Butan besitzt keine C-X-Bindung, trotzdem ist der Siedepunkt von Butan deutlich höher als der von Fluor-ethan mit seiner stark polaren C-F-Bindung.
Wie kann man diese Tatsache erklären?
Erst überlegen - dann weiterlesen!
Moleküle mit polaren Bindungen wie zum Beispiel Fluor-ethan sind permanente Dipole. Solche Moleküle werden durch intermolekulare Dipol-Dipol-Kräfte zusammengehalten, zumindest werden diese Kräfte in den meisten Schulbüchern so bezeichnet. In der Fachliteratur spricht man dagegen von Keesom-Wechselwirkungen und nicht von Dipol-Dipol-Kräften.
Neben diesen relativ starken Dipol-Dipol- bzw. Keesom-Wechselwirkungen sind in Alkanen und Halogenalkanen aber auch noch viel schwächere Kräfte wirksam. In den meisten Schulbüchern werden diese sehr schwachen intermolekularen Wechselwirkungen als van-der-Waals-Kräfte bezeichnet. In der Fachliteratur spricht man dagegen von London-Kräften. Der Begriff "van-der-Waals-Wechselwirkung" ist in der Fachliteratur ein Oberbegriff, der drei schwache intermolekulare Wechselwirkungen umfasst.
Da sich diese Webseiten nicht nur an Schüler(innen) der gymnasialen Oberstufe richten, sondern auch an Studierende der Fächer Chemie, Biologie, Medizin etc. werden im Folgenden die Fachbegriffe verwendet, wie sie in der Fachliteratur üblich sind (siehe Kasten unten).
van-der-Waals-Kräfte:
- Keesom-Wechselwirkungen zwischen permanenten Dipolen wie zum Beispiel Chlor-methan / Chlor-methan
- Debye-Wechselwirkungen zwischen permanenten Dipolen und polarisierbaren Nicht-Dipolen wie zum Beispiel Chlor-methan / Butan
- London-Wechselwirkung zwischen polarisierbaren Nicht-Dipolen wie zum Beispiel Ethan / Ethan
Mehr zu den van-der-Waals-Kräften erfahren Sie auf dieser Lexikon-Seite.
Der Siedepunkt von Butan ist höher als der Siedepunkt von Fluor-ethan, weil nicht nur die Keesom-Kräfte für den Zusammenhalt der Moleküle verantwortlich sind, sondern auch die viel schwächeren London-Kräfte. Je mehr C-Atome ein Alkan oder Halogenalkan hat, desto mehr unpolare Bindungen kommen in den Molekülen vor, und desto stärker wird der Einfluss der schwachen London-Kräfte. Beim Butan ist dieser Einfluss schon sehr deutlich. Die Folge ist der relativ hohe Siedepunkt des Butans, obwohl die Butan-Moleküle keine permanenten Dipole sind.
Die hohen Siedepunkte der Halogenalkane sind im Wesentlichen auf drei Faktoren zurückzuführen:
- Die Keesom-Wechselwirkungen zwischen den polaren C-X-Bindungen.
- Die hohen molaren Massen der Moleküle.
- Die London-Wechselwirkungen zwischen den Alkylresten der Moleküle.
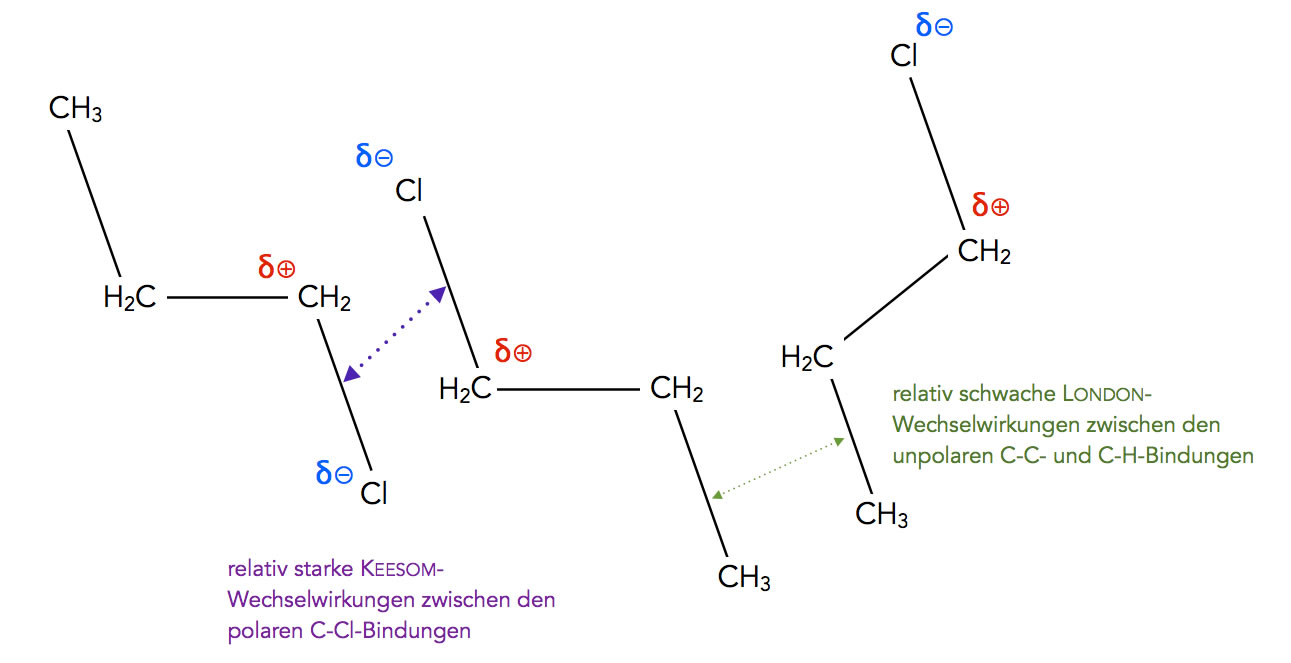
Keesom- und London-Wechselwirkungen zwischen Chlor-butan-Molekülen
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Auf diesem Bild ist noch einmal das Wichtigste zusammengefasst. Zwischen zwei Chlor-butan-Molekülen spielen sowohl die relativ starken Keesom-Wechselwirkungen eine Rolle wie auch die recht schwachen London-Wechselwirkungen.
Noch einmal zurück zum Problem Iod-ethan.
Verständnisfrage (Wiederholung)
Wenn die hohen Siedepunkt der Halogenalkane auf die Polarität der C-X-Bindung zurückzuführen sind, müsste dann nicht der Siedepunkt von Iod-ethan kleiner sein als der von Fluor-ethan?
Vorhin hatten wir den hohen Siedepunkt von Iod-ethan auf die große molare Masse der Verbindung zurückgeführt. Im Anschluss daran haben wir uns über die verschiedenen Kräfte unterhalten, die zwischen den Molekülen der Halogenalkane herrschen. Dabei haben wir herausgestellt, dass nicht nur die relativ starken Keesom-Wechselwirkungen (Dipol-Dipol-Kräfte in Schulbüchern) eine Rolle spielen, sondern auch die viel schwächeren London-Wechselwirkungen (in Schulbüchern als van-der-Waals-Kräfte bezeichnet).
Nun kommt ein weiterer Punkt hinzu, den wir noch nicht berücksichtigt hatten. Ein Iod-Atom hat nicht nur eine hohe molare Masse, sondern ist auch sehr groß. Die Außenelektronen sind also sehr weit vom Atomkern entfernt, und außerdem durch vier Elektronenschalen von der positiven Ladung des Kerns abgeschirmt. Iod-Atome lassen sich daher sehr leicht polarisieren. Je leichter ein Atom aber polarisierbar ist, desto leichter kann es London-Wechselwirkungen mit anderen polarisierbaren Atomen oder Bindungen ausbilden.
Schmelzpunkte und Dichten
Schmelzpunkte
Zu den Schmelzpunkten der Halogenalkane muss jetzt nicht mehr viel gesagt werden, das Wichtigste wurde ja bereits im Beispiel der Siedepunkt erläutert. Auf Grund ihrer hohen molaren Masse sowie der starken intermolekularen Anziehungskräfte haben Halogenalkane natürlich höhere Schmelzpunkte als die entsprechenden Alkane, wie man leicht an einem willkürlich herausgegriffenem Beispiel sehen kann. Vergleichen wir einmal die Schmelzpunkte von Butan und 1-Chlor-butan:
- Butan: Schmelzpunkt = -138,3 ºC
- 1-Chlor-butan: Schmelzpunkt = -123 ºC
Der Unterschied ist allerdings nicht so groß wie vielleicht erwartet. Sollte die Kettenlänge von 1-Chlor-butan schon so groß sein, dass der Einfluss der C-Cl-Bindung verhältnismäßig klein ist? Das überprüfen wir jetzt an einem zweiten Beispiel, nämlich Methan und Chlor-methan.
- Methan: Schmelzpunkt = -182 ºC
- Chlor-methan: Schmelzpunkt = -97,4 ºC
Hier ist der Unterschied tatsächlich sehr viel größer als bei den C4-Verbindungen.
Dichten
Auch beiden Dichten spielen die schweren Halogen-Atome eine entscheidende Rolle. Halogen-Alkane haben stets eine höhere Dichte als die entsprechenden Alkane. Das schauen wir uns wieder an zwei Beispielen näher an. Bei den Alkanen wird dabei die Dichte im flüssigen Aggregatzustand berücksichtigt, weil man Gase schlecht mit Flüssigkeiten vergleichen kann.
- Methan (flüssig): Dichte = 0,42 g/cm3
- Chlor-methan (flüssig): Dichte = 1,00 g/cm3
Und hier ein zweites Beispiel:
- Butan (flüssig): Dichte = 0,60 g/cm3
- 1-Chlor-butan (flüssig): Dichte = 0,89 g/cm3
Die Dichte der Halogenalkane nimmt also nicht unbedingt mit der Zahl der C-Atome zu, wie man beim Vergleich von Chlor-methan und 1-Chlor-butan sieht. Aber immer ist die Dichte des Halogenalkans größer als die Dichte des entsprechenden Alkans. Wegen der unerwartet niedrigen Dichte des 1-Chlor-butans schauen wir uns noch ein drittes Beispiel an, diesmal von zwei Verbindungen, die bei Raumtemperatur flüssig sind:
- Hexan (flüssig): Dichte = 0,66 g/cm3
- 1-Chlor-hexan (flüssig): Dichte = 0,88 g/cm3
Auch hier ist die Dichte des Halogenalkans größer als die Dichte des entsprechenden Alkans, jedoch ist die Dichte von 1-Chlor-hexan ungefähr so groß wie die von flüssigem 1-Chlor-butan. Allerdings muss man dazu sagen, dass die Werte der gasförmigen Verbindungen Chlor-methan und 1-Chlor-butan nahe am Siedepunkt der Verbindungen gemessen wurden. Die Verbindungen waren also flüssig, als ihre Dichte gemessen wurde, allerdings kurz vor dem Verdampfen. Leider liegen mir hier keine Dichte-Angaben von den Flüssigkeiten bei niedrigeren Temperaturen vor.
- Octan (flüssig): Dichte = 0,70 g/cm3
- 1-Chlor-octan (flüssig): Dichte = 0,87 g/cm3
Offensichtlich nehmen die Dichten der höheren Halogenalkane nicht weiter zu, wie uns das Beispiel 1-Chlor-octan zeigt. Je länger die Kohlenstoff-Kette des Halogenalkans ist, desto mehr nähren sich die Dichten an die Werte des reinen Alkans an.
- Decan (flüssig): Dichte = 0,73 g/cm3
- 1-Chlor-decan (flüssig): Dichte = 0,87 g/cm3
Und hier ein letztes Beispiel mit 12 C-Atomen:
- Dodecan (flüssig): Dichte = 0,75 g/cm3
- 1-Chlor-dodecan (flüssig): Dichte = 0,87 g/cm3
Wasserlöslichkeit
Bei den langkettigen Halogenalkanen sollte man eine extrem geringe Wasserlöslichkeit erwarten, denn die langkettigen Halogenalkane ähneln in ihrem physikalischen Verhalten den entsprechenden langkettigen Alkanen immer mehr, je länger die C-Kette ist. Interessant sind jedoch die kurzkettigen Halogenalkane. Hat die stark polare C-X-Bindung der Fluor- und Chlor-Alkane einen Einfluss auf die Wasserlöslichkeit der Verbindungen? Schauen wir uns wieder ein paar Beispiele an:
- Pentan: Wasserlöslichkeit = 39 mg / l Wasser
- 1-Chlor-pentan: Wasserlöslichkeit = 200 mg / l Wasser
- 1-Pentanol: Wasserlöslichkeit = 22.000 mg / l Wasser
Das Chlor-pentan ist also fast fünfmal besser wasserlöslich als das bei Zimmertemperatur ebenfalls flüssige Pentan. Allerdings ist der entsprechende Alkohol 1-Pentanol über 100 mal besser wasserlöslich als 1-Chlor-pentan.
Machen wir einen zweiten Vergleich
- Heptan: Wasserlöslichkeit = 2,2 mg / l Wasser
- 1-Chlor-heptan: Wasserlöslichkeit = 14 mg / l Wasser
- 1-Heptanol: Wasserlöslichkeit = 1.000 mg / l Wasser
Offensichtlich hat die polare C-Cl-Bindung einen Einfluss auf die Wasserlöslichkeit. Dies ist zunächst etwas verwunderlich, da die Halogenalkane ja keine Wasserstoffbrücken-Bindungen mit Wasser-Molekülen eingehen können. Allerdings sind Halogenalkan-Moleküle permanente Dipole, genau wie Wasser-Moleküle. Daher können sich Keesom-Wechselwirkungen (Dipol-Dipol-Kräfte) zwischen den Molekülen des Halogenalkans und den Wasser-Molekülen ausbilden. Wie man beim Vergleich mit den entsprechenden Alkoholen sieht, sind diese Wechselwirkungen aber sehr schwach im Gegensatz zu den Wasserstoffbrücken-Bindungen, die sich zwischen den OH-Gruppen der Alkohole und den Wasser-Molekülen bilden können.
Zusammenfassung
Die physikalischen Eigenschaften der Halogenalkane werden weitgehend durch die polare C-X-Bindung bestimmt. Halogenalkane haben höhere Dichten, Siedepunkte und Schmelzpunkte als die Alkane mit gleicher Kettenlänge, aber auch eine bessere Wasserlöslichkeit. Je größer die Kettenlänge eines Halogenalkans, desto mehr ähneln die physikalischen Eigenschaften denen des entsprechenden Alkans, weil der Einfluss der C-X-Bindung immer geringer wird, je länger die C-Kette ist.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Webseite zum Lösungsbuch zu "Get Ready for Organic Chemistry" von Leroy G. Wade, ISBN 032183296
- Wikipedia, verschiedene Artikel zu Halogenalkanen
Seitenanfang -
Zurück zur Hauptseite...