 |
 |
 |
|
| Brandfördernd | Ätzend | Reizend |
1. Einführung
Butan-1-ol C4H9-OH ist das vierte Glied in der homologen Reihe der Alkanole nach Methanol, Ethanol und Propan-1-ol.
2. Strukturdaten
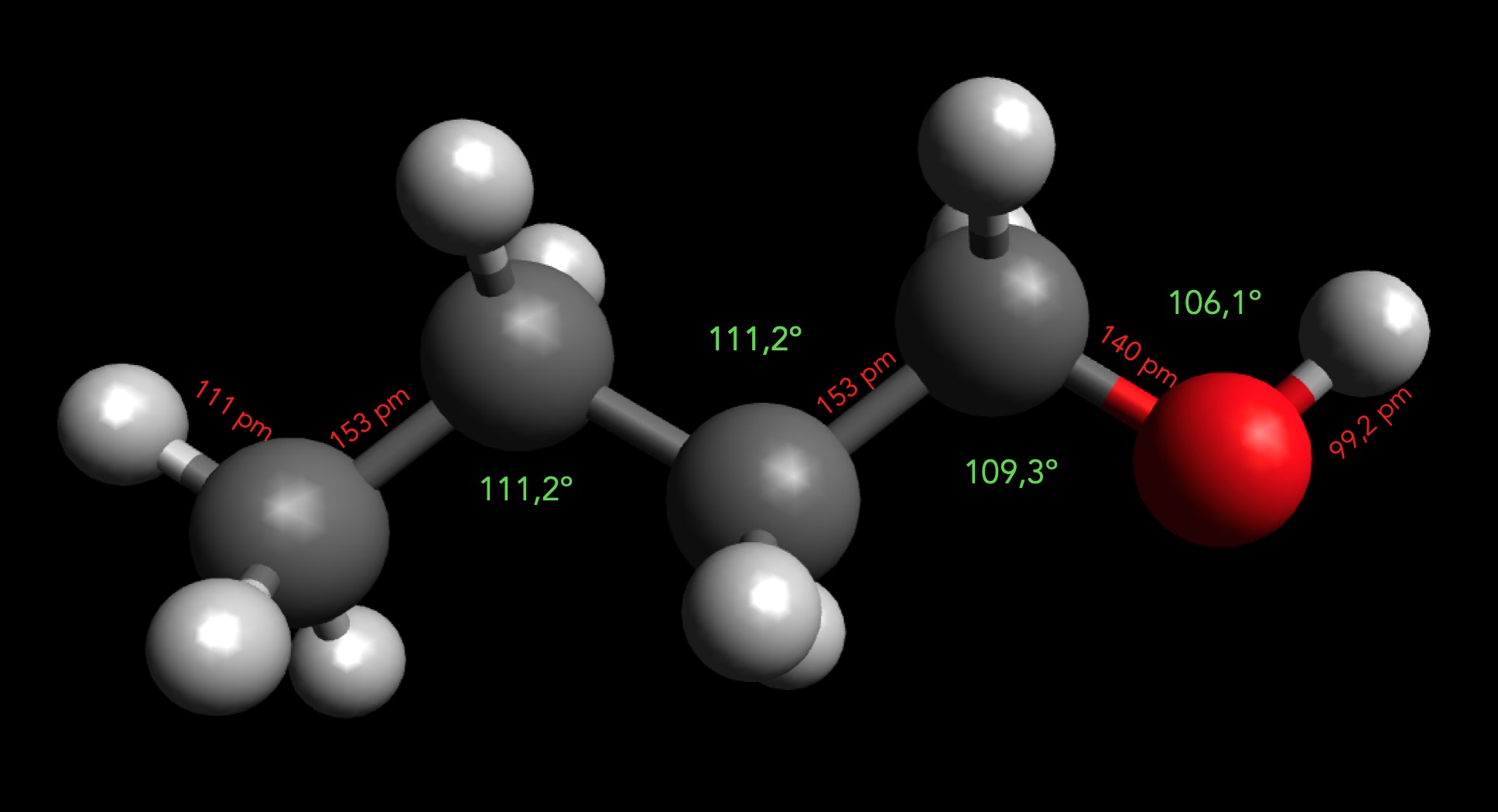
Das Butan-1-ol-Molekül
Autor: Ulrich Helmich 2025, Lizenz: Public domain
Die Bindungswinkel und Bindungslängen wurden mit der Messfunktion der Software Avogadro ermittelt, nachdem zuvor die energetisch günstigste Konformation erzeugt wurde.
3. Physikalische Eigenschaften
Überblick
| Molare Masse | 74,12 g/mol |
| Schmelztemperatur | -89 ºC |
| Siedetemperatur | 118 ºC |
| Dichte | 0,81 g/cm3 |
| Aggregatzustand bei 20 ºC | flüssig |
| Farbe | farblos |
| Geruch | weinartig, herb, süßlich, ranzig |
| Wasserlöslichkeit | 77 g/l |
| Dipolmoment | 1,66 D [3] |
| Brennbarkeit/Zündtemperatur | 355 ºC |
| Sonstiges | Die Dämpfe bilden bei erhöhter Temperatur mit Luft explosive Gemische |
3.1 Schmelz- und Siedepunkte
Der Schmelzpunkt von Butan-1-ol liegt bei -89 ºC und ist damit deutlich höher als der Schmelzpunkt des "Vorgängers" Propan-1-ol mit -129 ºC.
Die Siedepunkt von Butan-1-ol ist mit 118 ºC ebenfalls deutlich höher als der von Propan-1-ol (97 ºC).
Wie bei allen Alkanolen sind die Werte für die Siedetemperaturen verhältnismäßig hoch, da die Moleküle nicht nur Dipoleigenschaften besitzen, sondern zudem auch noch H-Brücken untereinander ausbilden können, weil die OH-Gruppe sowohl H-Brücken-Donator wie auch H-Brücken-Akzeptor ist.
| Verbindung | Siedetemperatur in ºC |
| Pentan | 36 |
| Butan-1-ol | 118 |
| Butan-2-ol | 99 |
| Propansäure | 141 |
Die Propansäure (ähnliche molare Masse wie die Butanole) hat einen noch höheren Siedepunkt als die Butanole, da sie mit der COOH-Gruppe über zwei H-Brücken-Akzeptoren verfügt.
3.2 Löslichkeitsverhalten
Die Wasserlöslichkeit ist mit 77 g/l noch einigermaßen groß.
3.3 Weitere Eigenschaften
Butan-1-ol ist bei Zimmertemperatur eine farblose und klare Flüssigkeit mit einer Dichte von 0,81 g/cm3. Der Alkohol hat einen weinartigen, der laut Wikipedia auch als "herb fuselähnlich mit Bananenaroma" oder als "süßlich ranzig" beschrieben wird.
Der Alkohol ist leicht entzündlich, der Flammpunkt liegt bei 35 ºC, die Entzündungstemperatur bei 325 ºC.
4. Gewinnung und Synthese
Rein theoretisch kann Butan-1-ol auf mehrere Weisen hergestellt werden. Die bekanntesten Methoden dürften die Hydratisierung von But-1-en sowie die Reduktion von Butanal sein, und natürlich dürfte auch die Substitution des Cl-Atoms von 1-Chlorbutan, das man durch Chlorierung von Butan gewinnen kann, eine Möglichkeit sein, Butan-1-ol herzustellen.
In der chemischen Industrie haben sich jedoch andere Methoden zur Synthese von Butan-1-ol durchgesetzt.
4.1 Hydroformylierung von Propen
In der Industrie wird Butan-1-ol aus dem leicht zugänglichen Propen hergestellt.
Im ersten Reaktionsschritt reagiert Propen mit Kohlenmonoxid und Wasserstoff zu Butanal und Methylpropanal (Isobutanal):
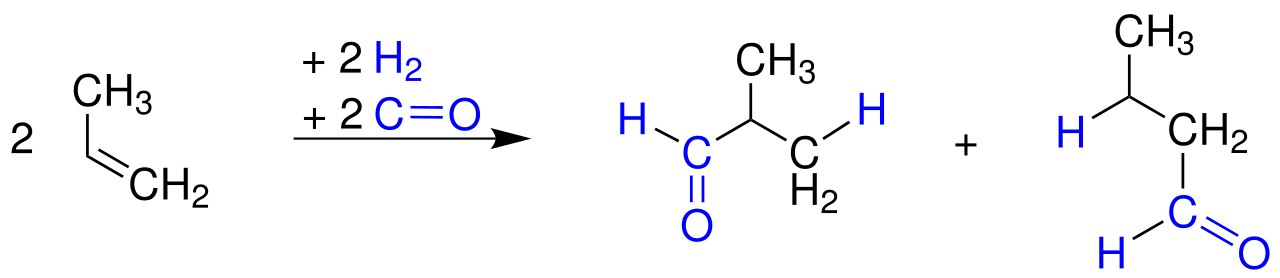
Der erste Reaktionsschritt
Quelle: Wikipedia, lizenzfrei.
Der zweite Reaktionsschritt ist dann eine einfache Reduktion des Butanals zu Butan-1-ol.
4.2 Biobutanol
Es gibt eine eher "exotische" Gärung, die sogenannte Aceton-Butanol-Ethanol-Gärung von Zucker und Stärke, die aus nachwachsenden Rohstoffen gewonnen werden. Eine solche Gärung wird u.a. von dem Bakterium Clostridium acetobutylicum durchgeführt.
Bei diesem Prozess entstehen Butanol, Aceton und Ethanol im Verhältnis von 6:3:1, insgesamt beträgt die Konzentration des Produktgemischs ca. 12-22 g/l.
Das Produktgemisch wird anschließend destilliert, um die einzelnen Komponenten zu gewinnen, deren Siedepunkte weit genug auseinander liegen:
- Butanol: 118 ºC
- Aceton: 56 ºC
- Ethanol: 78 ºC
4.3 Nucleophile Substitution von 1-Chlorbutan
Auch diese Reaktion ist theoretisch zwar möglich, wird aber so gut wie nie durchgeführt. Zumindest findet man in der Fachliteratur keine Erwähnung, dass diese Reaktion tatsächlich praktisch durchgeführt wird.
5. Reaktionen
5.1 Oxidation, Verbrennung
Wie alle Alkanole ist auch Butan-1-ol leicht oxidierbar. Bei der Verbrennung entstehen Kohlendioxid und Wasser, bei der Oxidation mit Oxidationsmitteln wie Kupferoxid, Kaliumpermanganat etc. bildet sich die Verbindung Butanal, ein Aldehyd.
5.2 Dehydratisierung
Durch Entzug von Wasser (Eliminierung) kann Butan-1-ol zu dem AlkenBut-1-en reagieren. In der Schule werden solche Versuche gelegentlich durchgeführt (siehe "Dehydratisierung eines Alkohols"), in der Industrie spielt die Dehydratisierung jedoch so gut wie keine Rolle. Allerdings eignet sich der sekundäre Alkohol Butan-2-ol besser für solche Versuche.
5.3 Dehydrierung
In der Industrie wird der Aldehyd Butanal aus Butan-1-ol gewonnen, es handelt sich um eine klassische Dehydrierung, also den Entzug von Wasserstoff.
5.4 Kondensation zu einem Ether
Aus zwei Molekülen Butan-1-ol kann unter saurer Katalyse durch Entzug von Wasser ein Ether hergestellt werden, nämlich der Dibutylether.
5.5 Veresterung
Wie alle Alkohole, kann auch Butan-1-ol zur Bildung von Carbonsäure-Estern verwendet werden.
5.6 Substitution
Schließlich sollte noch die Möglichkeit der Substitution der OH-Gruppe erwähnt werden.
Verwendung
Neben seiner Verwendung als Ausgangsstoff für chemische Synthesen findet Butan-1-ol vor allem Anwendung als Lösemittel, zum Beispiel bei der Herstellung von Farbstoffen und Lacken. Wenn Lacke getrocknet werden, laufen sie oft weiß an. Durch den Zusatz von Butan-1-ol wird dieses Weißanlaufen verhindert.
In der Medizin wird Butan-1-ol als Extraktionsmittel zur Gewinnung von Arzneistoffen eingesetzt.
Butan-1-ol wird auch als Biokraftstoff eingesetzt. Dazu ist im Spiegel ein interessanter Artikel erschienen, der frei zugänglich ist: "Sprit aus Stroh: Mit Superhefe Treibstoff brauen", Spiegel vom 18.08.2008.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia-Artikel "1-Butanol"