Einfluss auf den SN2-Mechanismus
Betrachten wir wieder unser bekanntes Beispiel für den SN2-Mechanismus:
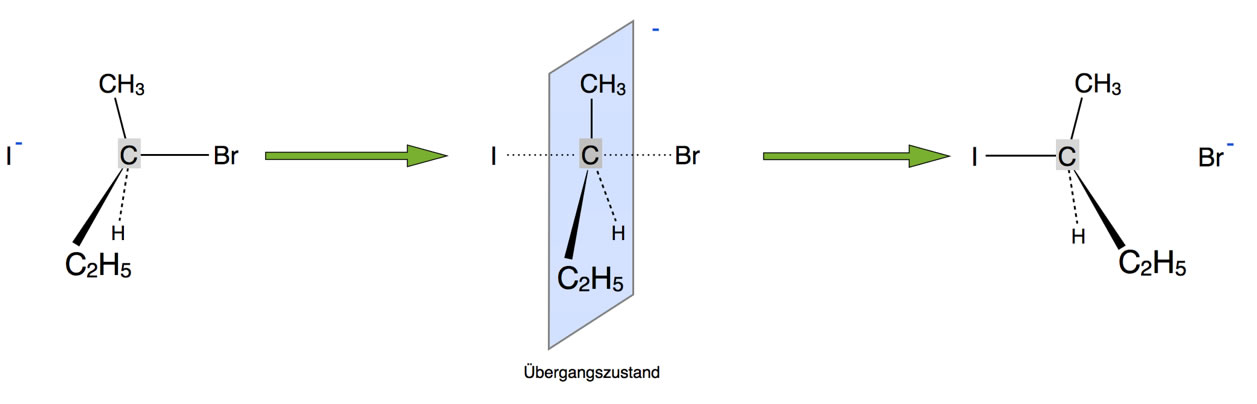
Bei der SN2-Reaktion "klappen" die Bindungen des zentralen C-Atoms um
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Bei der Bildung des Übergangszustandes ändert sich die Geometrie des zentralen C-Atoms. Die vier Bindungen des zentralen Kohlenstoff-Atoms müssen quasi wie ein Regenschirm "umklappen". Dieses "Umklappen" erfordert durchaus einen gewissen Energiebetrag, wie man ja auch an dem Energiediagramm sehen kann[3]:
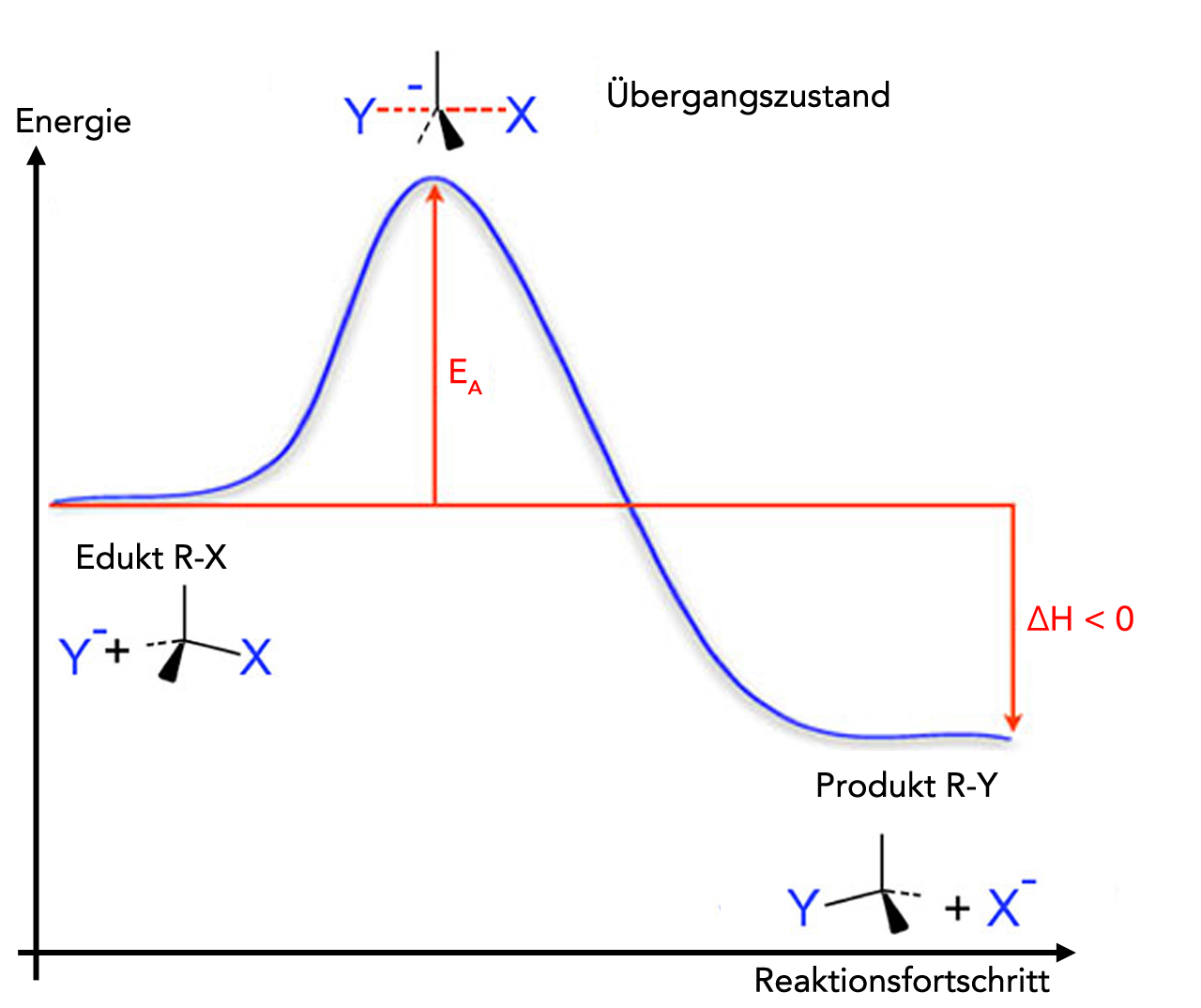
Das "Umklappen" der vier Bindungen kostet einen gewissen Energiebetrag
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Wenn jetzt große Alkylgruppen an dem zentralen C-Atom hängen, wie beispielsweise bei der Verbindung 3-Brom-3-ethyl-pentan, dann ist dieses "Umklappen" gar nicht so einfach. Hängen dagegen kleine Gruppen an dem zentralen C-Atom, zum Beispiel Methylgruppen oder gar H-Atome, dann geht das Umklappen im Prinzip einfacher. Allerdings ist die Sache mit dem Umklappen nicht ganz so einfach, wie es auf den ersten Blick aussieht. Warum nicht, ist im folgenden Experten-Kasten erläutert.
Für Experten
Die Elektronen in den vier Substituenten des Edukts stoßen sich gegenseitig ab. Dieser sterische Druck[1] ist ja auch der Grund dafür, dass das sp3-hybridisierte C-Atom überhaupt eine Tetraederstruktur hat. Der Übergangszustand der SN2-Reaktion ist aber sp2-hybridisiert und damit planar. Die drei noch vorhandenen Substituenten sind jetzt wegen des Bindungswinkels von 120 Grad (vorher: 109,5 Grad) weiter voneinander entfernt. Dieser verminderte sterische Druck begünstigt dann den Übergangszustand energetisch.
Insgesamt gilt aber: Einfach gebaute Verbindungen R-X mit kleinen Alkylgruppen "bevorzugen" den SN2-Mechanismus. Siehe dazu auch folgende Tabelle:
| Organisches Edukt | Geschwindigkeit der SN2 | Geschwindigkeit der SN1 |
| H3C-X | schnell | vernachlässigbar |
| RCH2-X | schnell | langsam |
| R2CH-X | gemäßigt | gemäßigt |
| R3C-X | langsam | schnell |
Einfluss auf den SN1-Mechanismus
Welche Substrate werden nun eher nach den SN1-Mechanismus reagieren? Die obige Tabelle gibt die Antwort schon mehr oder weniger vor.
Hängt die Abgangsgruppe an einem sekundären C-Atom, konkurriert die SN1-Reaktion mit der SN2-Reaktion, beide Mechanismen laufen weder langsam noch schnell ab, und andere Faktoren spielen eine wichtige Rolle bei der Wahl des Mechanismus.
Sitzt das Nucleofug an einem tertiären C-Atom, so verläuft die die SN2-Reaktion nur noch sehr langsam (sterische Hinderung durch die drei Reste), während die die SN1-Reaktion schnell erfolgt, was vor allem an der hohen Stabilität des tertiären Carbenium-Ions liegt.
Alkylgruppen üben einen positiven induktiven Effekt auf C-Atome aus, das hat verschiedene Gründe, die an anderer Stelle näher erläutert werden. Beim SN1-Mechanismus ist der erste und geschwindigkeitsbestimmende Schritt die Bildung eines Carbenium-Ions. Carbenium-Ionen sind instabil, da sie eine leere Kugelwolke bzw. ein leeres pz-Orbital haben. Seitengruppen mit +I-Effekt stabilisieren aber ein Carbenium-Ion. Je mehr Seitengruppen, desto stärker der +I-Effekt und desto stabiler das Carbenium-Ion. Eine Verbindung, bei der drei große Alkylgruppen am zentralen C-Atom hängen, bildet also sehr leicht stabile tertiäre Carbenium-Ionen. Eine Verbindung wie Brommethan dagegen, wo das zentrale (und einzige) C-Atom nur mit drei H-Atomen verbunden ist, hat so gut wie gar keine Tendenz, ein Carbenium-Ion zu bilden.
Abgangsgruppen an einem Methylrest oder einem primären Alkylrest begünstigen den SN2-Mechanismus, Abgangsgruppen an einem tertiären C-Atom begünstigen die SN1-Reaktion. Bei Abgangsgruppen an einem sekundären C-Atom konkurrieren SN1- und SN2-Mechanismus. Dann hängt es weitgehend von anderen Faktoren ab, welcher Mechanismus begünstigt wird.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Morrison/Boyd, Organic Chemistry, 7th Edition, 2011
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995