Die Austrittsgruppe
Nicht alle Abgangs- oder Austrittgruppen (Nucleofuge) lösen sich leicht von ihrem C-Atom. Wenn durch die Abspaltung einer nucleofugen Gruppe ein besonders stabiles Anion entsteht, ist das sowohl für die SN1 wie auch für die SN2-Reaktion günstig. Ein gutes Beispiel für eine solche Gruppe ist die SO3H - Gruppe bzw. das entsprechende Anion. Warum ist diese Gruppe eine gute Abgangsgruppe? Das liegt daran, dass die negative Ladung des Nucleofugs durch Mesomerie stabilisiert werden kann:
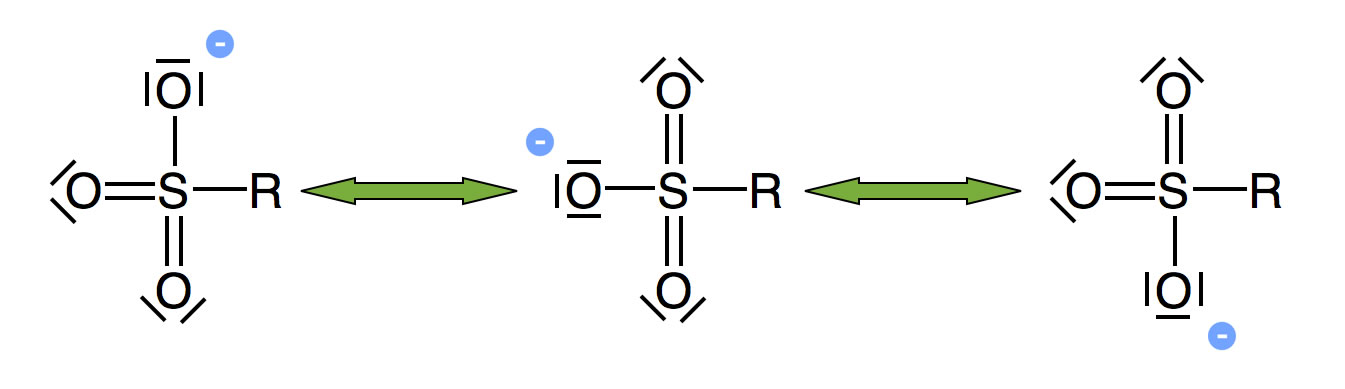
Mesomeriestabilisierung beim R-SO3--Ion
Autor: Ulrich Helmich 2018, Lizenz: ---
Als gute Austrittsgruppe gilt auch das Iod-Atom, während das Chlor-Atom eher eine schlechte Austrittsgruppe ist.
Allgemein gilt für die "Güte" oder "Eignung" eines Halogen-Atoms als Nucleofug folgende Reihenfolge:
I- > Br- > Cl- > F-
Das entspricht genau der Stärke der Nucleophile einem protischen Lösemittel wie Wasser oder Ethanol, was bereits unter "Einfluss des Lösemittels" ausgeführt wurde. Auch die OH-Gruppe ist eine schlechte Abgangsgruppe. Aber durch Protonierung kann man aus dieser schlechten Abgangsgruppe eine gute Abgangsgruppe machen.
Experimentell beweisen kann man diese Reihenfolge, indem man einen Konkurrenz-Versuch durchführt:
Gleiche Stoffmengen Iod-ethan und Brom-ethan (alternativ auch 1-Brom-3-Iod-propan oder eine ähnliche Verbindung) werden in einem geeigneten Lösemittel einem Nucleophil ausgesetzt.In der Regel wird dann das Iod-Atom substituiert, während das Brom-Atom im Molekül verbleibt.
Auch das Lösemittel spielt eine wichtige eine Rolle dabei, ob ein Nucleofug eine gute Austrittsgruppe ist. Kann das Lösemittel beispielsweise H-Brücken mit dem Nucleofug bilden, so wird der Austritt erleichtert und der Wiedereintritt erschwert (die Rückreaktion wird also behindert).
Reinhard Brückner listet in seinem Buch [5] folgende gute Abgangsgruppen auf:
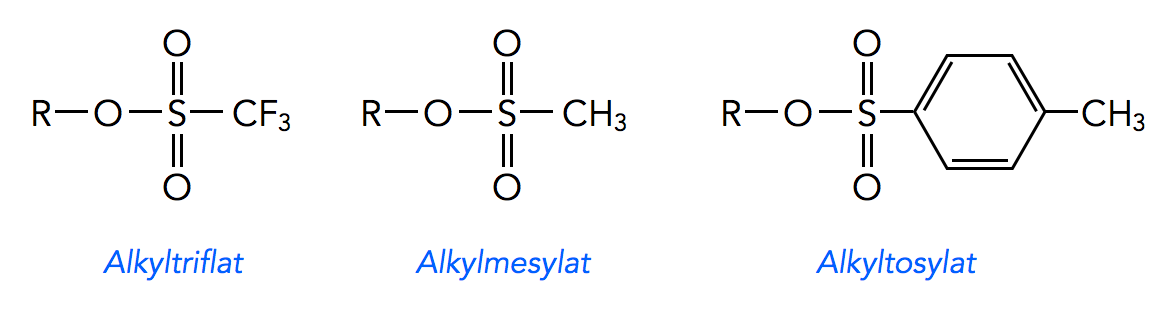
Drei besonders gute Nucleofuge
Autor: Ulrich Helmich 2022, Lizenz: ---
Alkyltriflate werden durch Deprotonierung eines Alkohols und Reaktion des Alkoholats mit Trifluormethansulfonylchlorid hergestellt (Einzelheiten siehe Wikipedia). Die Triflatgruppe ist eine sehr gute Abgangsgruppe und wird häufig in der präparativen Chemie (Labor-Synthesen) verwendet.
Alkylmesylate sind Ester der Methansulfonsäure. Sie können durch Reaktion von Methansulfonylchlorid mit Alkoholen hergestellt werden (Einzelheiten siehe Wikipedia).
Alkyltosylate sind Ester der p-Toluolsulfonsäure. Sie können durch Deprotonierung eines Alkohols und Reaktion des Alkoholats mit p-Toluolsulfonsäurechlorid hergestellt werden (Einzelheiten siehe Wikipedia). Auch die Tosylatgruppe ist eine sehr gute Abgangsgruppe und wird häufig in der präparativen Chemie verwendet.
Die OH-Gruppe und die verwandten OR-Gruppen sind deutlich schlechtere Nucleofuge. Sie können aber durch vorherige Protonierung zu guten Abgangsgruppen gemacht werden.
Das Fluor-Atom ist kein Nucleofug, auch SH- und die verwandten SR-Gruppen sind keine Abgangsgruppen, auch Aminogruppen und verwandte Gruppen (mit Alkylresten) oder Nitrogruppen sind keine Nucleofuge. Das gilt auch für Gruppen mit Phosphor als Zentralatom [5].
Wenn die Austrittsgruppe bzw. das abgegebene Anion gleichzeitig eine starke Brönsted-Base ist, so kann leicht eine Eliminierung als Konkurrenzreaktion stattfinden. Das ausgetretene Nucleofug holt sich dann nämlich ein Proton aus dem organischen Edukt, dabei entsteht dann eine C=C-Doppelbindung.
Oft hat das Nucleofug auch eine Konkurrenz "im eigenen Haus". Das Nucleophil ist ja stets auch eine Base. Findet sie in dem Substrat-Molekül ein leicht abspaltbares H-Atom, so kann das Nucleophil dieses H-Atom als Proton abstrahieren, und dann findet keine Substitution statt.
Die Austrittsgruppe als Nucleophil
Nachdem die nucleophile Substitution erfolgt ist, liegt die Austrittsgruppe als Anion in der Lösung vor. Jetzt kann natürlich eine Rückreaktion einsetzen, bei der das Anion als Nucleophil fungiert. Ist das Anion ein starkes Nucleophil, wird die Rückreaktion begünstigt.
Iodid-Ionen sind sehr starke Nucleophile, daher sollte man erwarten, dass Iod-Alkane so gut wie nicht nucleophil substituiert werden können. Gelänge es einem Nucleophil, das Iod-Atom aus dem Substrat zu verdrängen, dann wären sofort viele Iodid-Ionen in der Lösung, die das Produkt dann wieder nucleophil angreifen würden. Also muss man das Gleichgewicht der Reaktion nach rechts verschieben, indem man die Iodid-Ionen aus der Lösung entfernt. Das kann zum Beispiel leicht mit Ag+-Ionen geschehen, weil sich dann unlöstliches Silberiodid bildet.
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 3. Auflage, Weinheim 2000.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
- Wikipedia, Artikel "Trifylgruppe".