Bei dem SN1-Mechanismus wird als Zwischenprodukt ein Carbenium-Ion gebildet. Alle Faktoren, die Carbenium-Ionen stabilisieren, erhöhen die Wahrscheinlichkeit für den SN1-Mechanismus. Dazu gehört auch die Polarität des Lösemittels. Polare Lösemittel wie Wasser oder Alkohol stabilisieren abgespaltene Nucleofug-Anionen durch Solvatation (zum Beispiel Bildung einer Hydrathülle beim Wasser als Lösemittel). Polare Lösemittel begünstigen also den SN1-Mechanismus, während unpolare Lösemittel wie Pentan oder Tetrachlorkohlenstoff den SN2-Mechanismus wahrscheinlicher machen, weil sie die Nucleophilie des angreifenden Nucleophils erhöhen (ein Nucleophil ohne Solvathülle ist reaktiver als ein solvatisiertes Nucleophil).
Beispiel Wasser/Ethanol
In einem Wasser-Ethanol-Gemisch ist das Iodid-Ion ein stärkeres Nucleophil als das Bromid-Ion, dieses ist wieder stärker als das Chlorid-Ion, und dieses stärker als das Fluorid-Ion:
I- > Br- > Cl- > F-
Die geringe Nucleophile dies Fluorids lässt sich auf die starke Hydrathülle zurückführen. Das Fluorid ist das kleinste der vier Ionen, hat aber die gleiche Ladung, nämlich -1. Die Ladungsdichte des Fluorid-Ions ist also am größten von allen vier Ionen, daher ist auch die Hydrathülle am größten und am stärksten an das Anion gebunden. Beim Fluorid werden die Wasser-Moleküle außerdem nicht nur einfach aufgrund von Dipol-Kräften angezogen, sondern vor allem durch Wasserstoff-Brücken. Daher ist hier die Hydrathülle besonders fest gebunden.
Diese Hydrathülle ist aber nun ein Hindernis, wenn es um die nucleophile Substitution geht. Das Fluorid kommt kaum an das organische Substrat heran, wenn es mit einer so mächtigen Hydrathülle umgeben ist.
Das Gleiche gilt auch für Chlorid, allerdings in abgeschwächter Form. Die Hydrathülle des Bromid-Ions ist wegen der geringeren Ladungsdichte noch kleiner und weniger stark gebunden, und das große Iodid-Ion hat eine relativ kleine Hydrathülle, ist daher das stärkste Nucleophil der vier Halogenid-Ionen.
Beispiel Aceton / DMSO
DMSO ist die Abkürzung für Dimethylsulfoxid, ein organisches Lösemittel. Die Struktur von DMSO ist fast die gleiche wie die von Aceton, nur ist hier das mittlere C-Atom gegen ein Schwefel-Atom ausgetauscht. Beide Verbindungen besitzen zwar H-Atome an den Methylgruppen, können mit diesen H-Atomen jedoch keine Wasserstoffbrücken-Bindungen zu anderen Molekülen oder Ionen bilden. Daher bezeichnet man solche Lösemittel als aprotische Lösemittel. Im Gegensatz dazu sind Lösemittel wie Wasser oder Ethanol protische Lösemittel, weil sie H-Brücken untereinander und auch mit anderen Verbindungen bilden können.
Löst man ein Salz wie Natriumbromid in Aceton oder DMSO auf, dann können sich zwar Solvathüllen um die Kationen bilden, also um die Natrium-Ionen, nicht aber um die Anionen, also um die Bromid-Ionen. Die negativ polarisierten O-Atome von Aceton und DMSO sind relativ frei zugänglich, können also mit den positiven Ionen Kontakt aufnehmen. Die positiv polarisierten C- bzw. S-Atome dagegen sind durch die beiden Methylgruppen sterisch abgeschirmt, sie können keinen Kontakt mit den negativen Ionen aufnehmen.
Aus diesem Grund besitzen die anionischen Nucleophile wie Bromid keine Solvathülle, die bei der nucleophilen Substitution "abgestreift" werden müsste. Daher sind solche anionischen Nucleophile in aprotischen Lösemitteln viel stärker nucleophil als in protischen Lösemitteln.
Bei den Bromiden kehrt sich in einem aprotischen Lösemittel die Reaktivitäts-Reihenfolge sogar gänzlich um:
F- >Cl- > Br- > I-
Mehr zu diesem Thema finden Sie auf dieser Lexikon-Seite.
Vergleich von vier Lösemitteln
Reinhard Brückner vergleicht in seinem Buch "Reaktionsmechanismen" [5] die Reaktion von Iodmethan mit Chlorid-Ionen in vier verschiedenen Lösemitteln.
H3C-I + Cl- → H3C-Cl + I-
Die Umsetzung wurde zunächst im Lösemittel Methanol durchgeführt. Die gemessene Reaktionsgeschwindigkeit wurde willkürlich auf 1 gesetzt (relative Reaktionsgeschwindigkeit).
Dann wurde die gleiche Reaktion in drei anderen Lösemitteln durchgeführt:
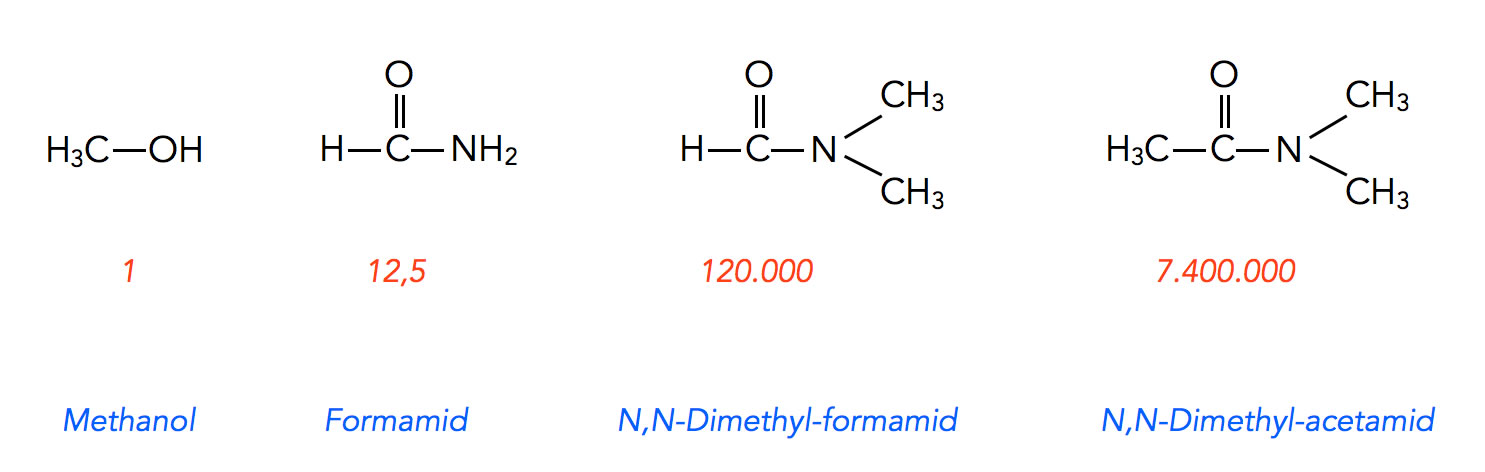
Reaktionsgeschwindigkeit in vier Lösemitteln nach Brückner
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
In Formamid, einem protischen Lösemittel, lief die Reaktion 12,5 mal so schnell ab wie in Methanol. In N,N-Dimethyl-formamid steigerte sich die Geschwindigkeit auf das 120.000fache, und in N,N-Dimethyl-acetamid mit nur einer CH3-Gruppe mehr betrug die relative Geschwindigkeit sogar das 7.400.000fache. Die Zahlen beziehen sich übrigens nicht direkt auf die gemessene Reaktionsgeschwindigkeit, sondern auf die Geschwindigkeitskonstanten.
Beispiel Kronenether als Phasentransfer-Katalysatoren
Nach dem, was wir eben gesehen haben müsste man den Nucleophilie verstärkenden Effekt von aprotischen Lösemitteln wie Aceton oder DMSO doch noch weiter steigern können, indem man ein völlig unpolares Lösemittel wie zum Beispiel Hexan verwendet. Dann würden die anionischen Nucleophile komplett ohne Solvathülle vorliegen.
Eine gute Idee, doch dummerweise lösen sich Salze wie Kaliumbromid oder Kaliumfluorid in unpolaren aprotischen Lösemitteln wie Hexan nicht im Geringsten. Wie will man solche Salze dann zur Reaktion mit einem organischen Substrat bringen?
Hier haben sich die sogenannten Kronenether bewährt. Ein bekannter Kronenether hat folgende Struktur:
![Strukturformel des Kronenethers [18]-Krone-6](Bilder/kronenether-18-6.jpg)
Strukturformel des Kronenethers [18]-Krone-6
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende.
Kationen mit der richtigen Größe können von einem solchen Ringmolekül komplett eingeschlossen werden. Man bezeichnet den Kronenether dann als "Wirt" für das Kation. Der Kronenether [18]Krone-6 hat einen Innenraum, der etwas größer ist als ein Kalium-Ion. Er wird in der organischen Synthese daher verwendet, um Kalium-Ionen zu transportieren. Das sieht dann ungefähr so aus:
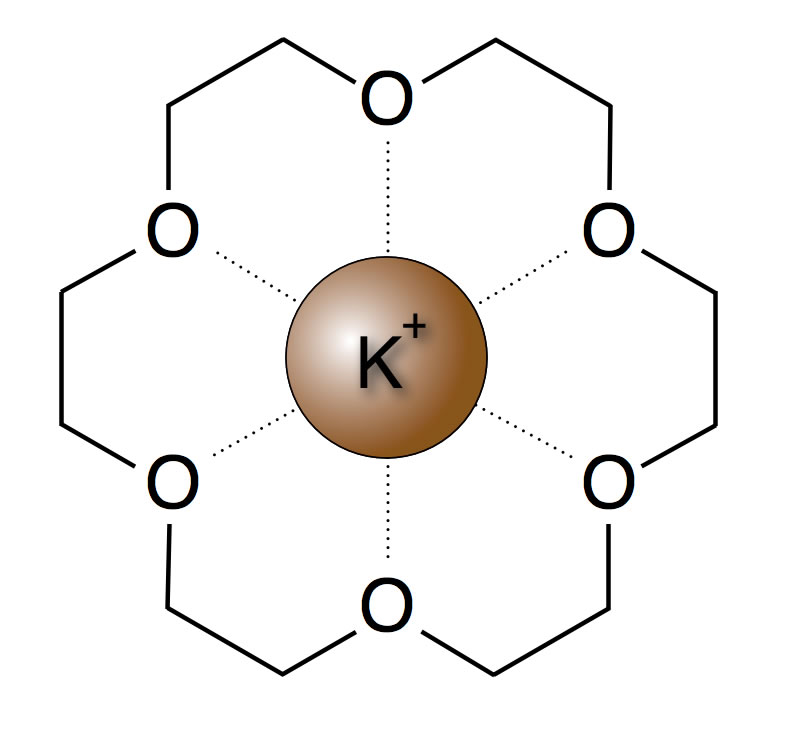
Ein Kronenether mit einem eingeschlossenem Kalium-Ion
Autor: Ulrich Helmich 2020, Lizenz: siehe Seitenende.
Welchen Vorteil bieten solche Kronenether nun für die nucleophile Substitution?
Beim Lösungsvorgang müssen Salze in ihre Ionen dissoziieren. In einem protischen Lösemittel ist das meistens kein Problem. Zwar muss die Anziehungskraft zwischen Anion und Kation überwunden werden, was einen gewissen Energiebetrag kostet. Andererseits bilden beide Ionen eine Solvathülle, im Lösemittel Wasser zum Beispiel eine Hydrathülle. Dabei werden viele neue Bindungen gebildet, und so wird ein recht hoher Energiebetrag freigesetzt. Meistens ist diese Solvationsenergie (im Falle von Wasser: Hydrationsenergie) größer als die zur Dissoziation aufgewandte Energie.
In apolaren Lösemitteln bilden sich keine Solvathüllen um die Ionen, daher zeigen die Ionen keinerlei Neigung, sich zu trennen. Warum auch?
Gibt man nun einen Kronenether zu diesem apolaren Lösemittel (der [18]Krone-6-Ether selbst ist bei Zimmertemperatur ein Feststoff), so nehmen die Moleküle des Kronenethers die Kationen auf, weil sich die negativ polarisierten O-Atome des Ethers innen befinden.
Was passiert dann mit den Anionen des Salzes? Die Anionen haben keinen Bindungspartner mehr und schwirren frei in dem organischen Lösemittel herum. Eine Solvathülle bilden sie zwar nicht, aber sie können sich frei bewegen und dann auch organische Verbindungen angreifen.
Gibt man Kaliumfluorid zu einem Gemisch aus Hexan und Kronenether, so kann eine nucleophile Substitution sehr leicht ablaufen, das Fluorid-Ion verdrängt dann die nucleofuge Gruppe aus dem organischen Substrat.
Ich habe mir mal die Mühe gemacht, ein Bild zu zeichnen, wie ich mir ein solches Lösemittel (Hexan) mit einem Kronenether, Kaliumfluorid und einem organischen Substrat (1-Brom-Butan) vorstelle:
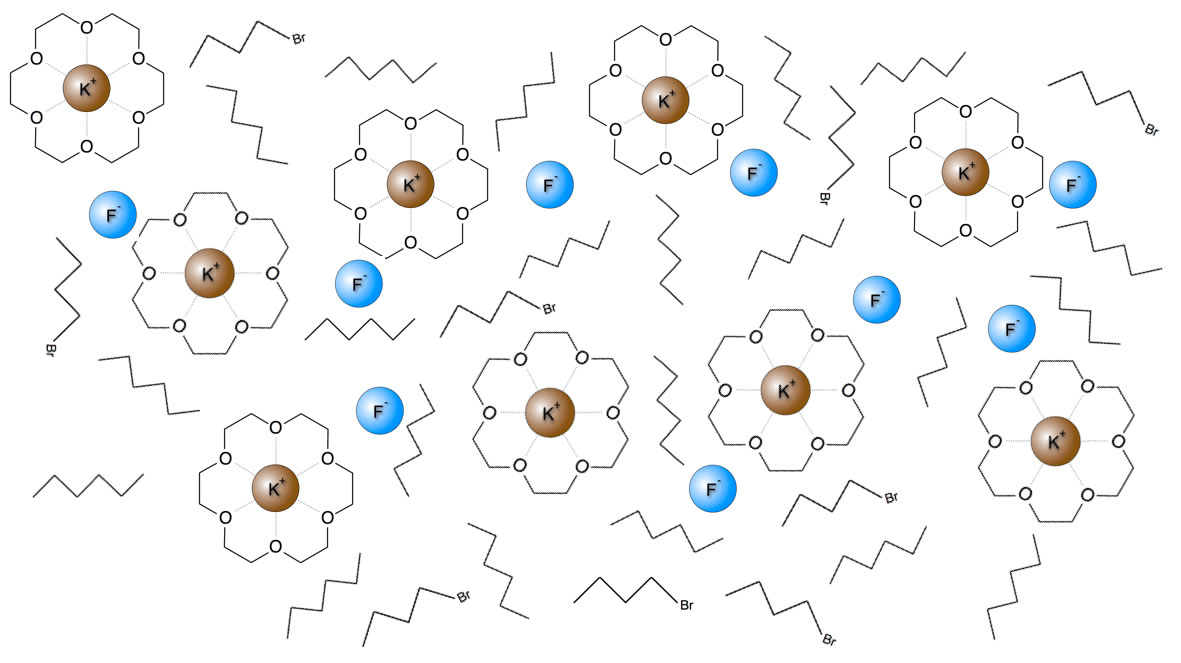
Stoffgemisch wie im Text beschrieben
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Ich hoffe, ich habe die Zeichnung einigermaßen korrekt angefertigt.
Kronenether fungieren hier als sogenannte Phasentransfer-Katalysatoren, weil sie den Phasenübergang des Kaliumfluorids von der festen Phase in die flüssige bzw. gelöste Phase katalysieren. Der Kronenether selbst nimmt nicht an der Reaktion teil, beschleunigt diese aber erheblich, deshalb kann er als Katalysator angesehen werden.
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 3. Auflage, Weinheim 2000.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.